Статеві відмінності в мотиваційних реакціях на жир у сирійських хом’яків
Джон Л. Шенноус
1 Інститут неврології, Техаський університет A&M, Коледж-Стейшн, Техас 77843
Даніель М. Терка
2 Кафедра психіатрії Медичного коледжу Вайла Корнелла, Нью-Йорк, Нью-Йорк 10021
Деніел Йорк
2 Кафедра психіатрії Медичного коледжу Вайла Корнелла, Нью-Йорк, Нью-Йорк 10021
Пол Дж. Веллман
3 Відділ психології Техаського університету A&M, Коледж-Стейшн, Техас 77843
Карунель Морган
1 Інститут неврології, Техаський університет A&M, Коледж-Стейшн, Техас 77843
2 Кафедра психіатрії Медичного коледжу Вайла Корнелла, Нью-Йорк, Нью-Йорк 10021
4 Департамент харчування та харчових наук, Техаський університет A&M, Коледж-Стейшн, Техас 77843
5 Міжвузівський факультет харчування, Техаський університет A&M, Коледж-Стейшн, Техас 77843
Анотація
ВСТУП
Сприятливий вплив їжі з високим вмістом жиру на мотиваційні збої у людей, мабуть, сприяє їх визначенню як «їжа, що забезпечує комфорт», але про те, наскільки секс відіграє роль, широко не повідомляється. Цікаво, що вважається, що статеві відмінності в мотивації та уподобаннях вживати їжу з високим вмістом жиру сприяють зростанню ожиріння у жінок більше, ніж у чоловіків [1, 2]. У дослідженнях, які контролювали генетичний фон з монозиготними близнюками, ожиріння асоціювалося з обмежувальним харчуванням, частими перекусами та спробами обмеження їжі з високим вмістом жиру [3, 4]. Крім того, жінки, що страждають ожирінням, самостійно повідомляли про більшу вразливість до вживання “їжі комфорту”, ніж жінки з нормальною вагою [4]. Як не парадоксально, але було виявлено, що жінки виявляють більшу обмеженість у харчуванні, емоційне харчування та запої, ніж чоловіки [5]. Розслідування в цій галузі є важливим, оскільки жіночі упередження встановлюються щодо розладів харчування та надмірного споживання їжі з високим вмістом жиру [6, 7], а також мотиваційних розладів [8, 9], але їх біологічні підстави не є. Вважається, що ангедонія та тривога представляють нервові дисфункції у позитивній та негативній мотивації відповідно [10, 11], і вони часто супроводжуються порушеннями харчування [12, 13].
Попередні дослідження на гризунах показали, що харчовий жир впливає на поведінку, пов'язану з депресією та тривогою. У дорослих щурів Sprague Dawley, яких піддавали материнській сепарації як цуценят, годування з високим вмістом жиру справляло анксіолітичний ефект, особливо на самців [14, 15]. Подібні анксіолітичні ефекти дієтичного жиру були продемонстровані у самців щурів Sprague Dawley без відокремлення матері [16]. Крім того, переїдання їжі з високим вмістом жиру запобігало появі тривоги після її припинення у щурів [17]. Цікаво, що хронічний жир з високим вмістом жиру збільшував нерухомість самців і самок щурів Wistar у тесті примусового плавання, що пов’язано з психомоторним гальмуванням, основним симптомом депресії у людей [18]. У самців мишей C57BL/6 годування з високим вмістом жиру послаблювало тривогу та нерухомість, спричинену стресом, але не ангедонію [19]. Однак на самцях CD-1 мишей годування з високим вмістом жиру справляло антидепресантний ефект, але також і анксіогенний ефект [20]. Припинення дієти з високим вмістом жиру погіршило тривожну та винагороджувальну поведінку мишей, і це збільшило їх готовність переносити анксіогенні умови, щоб відновити доступ до чау з високим вмістом жиру [21]. Незважаючи на види, штам та статеві відмінності, ці результати свідчать про те, що харчовий жир може покращити емоційність за певних експериментальних умов.
Існує все більше доказів того, що споживання жиру надає корисні ефекти завдяки діям у nucleus accumbens, яке є невід’ємним компонентом мезолімбічної системи винагород та важливим для біоенергетичної та емоційної інтеграції. Ця лімбічна структура впливає на стан депресії, тривогу та винагороду у щурів, мишей та людей [22–24], а також на поведінку винагороди та переваги їжі у хом'яків [25, 26]. У щурів їжа з високим вмістом жиру спричиняла більший викид аккумбалу дофаміну, що є потужним сигналом нагороди [27]. Дослідження, що оцінюють кореляцію з експресією ΔFosB або наслідками надмірної експресії ΔFosB, дозволяють припустити, що цей фактор транскрипції підвищує мотивацію винагороди з високим вмістом жиру та сприяє збереженню енергії та ожирінню [28–30]. Миші, які надмірно експресували ΔFosB у nucleus accumbens, також виявляли посилену реакцію винагороди та занепокоєння після відміни жиру [31]. Крім того, хронічне годування з високим вмістом жиру у щурів Long Evans зменшувало накопичувальну активацію анксіогенного сигналу, фосфорилювало CREB [32], а у мишей надмірне вираження ΔFosB запобігало зменшенню фосфорилювання CREB [31]. Однак у останніх двох дослідженнях поведінка винагороди не оцінювалася.
Експресія гіпоталамуса цитокіну, TLR4, була задіяна як медіатор стимулюючого впливу дієти з високим вмістом жиру на запалення нейронів, апоптоз та резистентність до інсуліну [33–35]. Ми показали, що підвищення рівня мРНК гіпоталамусу Tlr4 асоціюється з тривожністю, спричиненою поділом, та анорексією у хом'яків [36]. Крім того, було показано, що активація TLR4 опосередковує винагороду за наркотики [37–40], але нейроанатомічне місце дії не встановлено. Оскільки CREB та ΔFosB відіграють протилежні ролі в накопичувальних системах порівняно з іншими регіонами мозку [41–44], цілком ймовірно, що експресія акумуляльного Tlr4 збільшується із винагородою. Тому ми дослідили цю можливість у цьому дослідженні.
Процитовані вище дослідження в сукупності ілюструють необхідність клінічно релевантної моделі для перевірки гіпотези про те, що модуляція харчового жиру сприяє різниці статі в мотиваційних станах. Раніше ми показали, що щодо соціального житла соціальна розлука спричиняє анорексію та тривожність із жіночими упередженнями у сирійських хом'яків [36, 45, 46]. У цьому дослідженні ми прагнули визначити, чи не викликає соціальна розлука також ангедонію із упередженнями жінки, використовуючи новий аналіз - тест на винагороду за винагороду (RIP). Важливо те, що ми також прагнули визначити, чи зменшує жировий жир анхедонічну та тривожну поведінку при різниці статі.
МЕТОДИ ТА МАТЕРІАЛИ
Предмети
Сирійських золотих хом'яків (Mesocricetus auratus) штаму Crl: LVG (SYR) (Чарльз Рівер, Кінгстон, Нью-Йорк) придбали для використання в Медичному коледжі Weill Cornell або виводили протягом трьох поколінь у лабораторії досліджень тварин у лабораторії Клеберг в Техаському університеті A&M. Дотримувались графіку 14 годин: 10 годин світло-темно (світло світиться о 06:00) та температура 23 ± 3 ° C. Дієта з низьким вмістом жиру, LabDiet 5001 (Purina Mills, Richmond, IN), дієта з високим вмістом жиру, D12451 (Research Diets, New Brunswick, NJ) та водопровідна вода надавались за бажанням. Процедури, використані у цьому дослідженні, були схвалені Інституційним комітетом з догляду та використання тварин.
Експериментальні конструкції
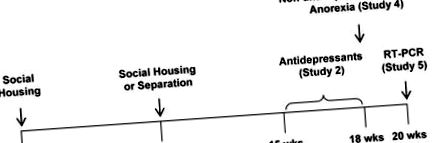
Хом'яків розміщували 2–4/клітку під час одностатевого соціального житла (ВС) після відлучення від грудей. Деякі були розміщені 1/клітка під час соціальної розлуки (СС) у віці 10 тижнів (див. Рис. 1 для графіків досліджень та часових курсів для лікування наркотиками). Територіальна агресія була мінімізована за допомогою використання односмітників для SH та щоденного скринінгу на надмірну агресивність, починаючи з віку 6 тижнів. Не потрібно було відокремлювати будь-яких товаришів по клітці.
Показані терміни соціальних маніпуляцій та введення наркотиків, а також оцінки мотивованої поведінки, анорексії та акумуляльної експресії генів-мішеней.
Дослідження 1
Жіночих та чоловічих хом'яків (n = 8) оцінювали на тривогу та ангедонію між 1000h-1600h у спеціальній кімнаті поведінки під час SH або SS. Дослід 1.1. Тривожність оцінювали в тесті на конфлікт, пов’язаний з тривожністю/дослідженням (описаний нижче) після 8 тижнів СС. Раніше ми визначили, що цей момент часу наближається до піку тривоги [36]. Дослід 1.2. Хом'яків оцінювали на ангедонію в тесті на винагороду за винагороду (описаний нижче) відразу після експерименту 1.1.
Дослідження 2
Другу і третю когорти, що містять самок (n = 6), оцінювали через 8 тижнів СС на відповідь на стандартні дози антидепресантів під час СС у тесті RIP. Дослід 2.1. Прототипний селективний інгібітор зворотного захоплення серотоніну, флуоксетин (0 або 10 мг/кг/добу, перорально), вводили у питну воду, починаючи через 5 тижнів поділу, а поведінку оцінювали через 7 та 21 день. Дослід 2.2. Вводили прототиповий трициклічний антидепресант, дезіпрамін (0 або 20 мг/кг/день, перорально), і поведінку оцінювали, як зазначено вище. Раніше ми повідомляли, що дезіпрамін у тій же дозі зменшує тривожну поведінку у хом'яків [46]
Дослідження 3
Четверту і п'яту когорти, що містять самок (n = 6), оцінювали після 8 тижнів SH або SS на відповідь на неантидепресанти в тесті RIP під час SS. Дослід 3.1. Хом'якам вводили носій, антагоніст бета-адренергічних рецепторів, пропранолол (2 мг/кг, в/в), модулятор рецепторів ГАМК, траказолат (1 мг/кг, в/в) або антагоніст опіоїдних рецепторів, налтрексон (4 мг/кг, в/в), За 30 хв до тестування. Дослід 3.2. Хом'якам вводили прототиповий бензодіазепін діазепам (0 або 1 мг/кг, в/в), як зазначено вище. Раніше ми повідомляли, що пропранолол і діазепам, але не налтрексон, застосовувані в тих самих дозах, зменшують тривожну поведінку хом'яків [46]. Траказолат є передбачуваним анксіолітиком [47].
Дослідження 4
Шоста та сьома когорти, що містять жінок та чоловіків, були оцінені на анорексію після 8 тижнів СС. Раніше ми визначили, що цей момент часу знаходиться поблизу піку для майже пікових значень для SS-індукованої анорексії [36]. Дослід 4.1. Хом'яків (n = 8) та їжу зважували під час регулярних змін клітини під час світлової фази з точністю до 0,1 г. Споживання їжі оцінювали шляхом зважування чау, вийнятого з бункера, постільної білизни та мішечків за необхідності. Під час SH прийом їжі на клітку ділився на кількість хом'яків у клітці. Калорійну ефективність розраховували як збільшення ваги (г), нормоване до споживання калорій (ккал). Дослід 4.2. Швидкість метаболізму, коефіцієнти дихального обміну та температуру шкіри вимірювали у жінок (n = 6–10) та чоловіків (n = 6–8) за допомогою непрямої калориметрії (описано нижче).
Дослідження 5
Підгрупу хом'яків з дослідження 4 (n = 5) оцінювали через 10 тижнів СС на експресію генів і вагу тканин. Дослід 5.1. Експресію гена в накопиченні оцінювали за допомогою RT-PCR (див. Таблицю 1 щодо послідовностей праймерів та умов ампліфікації). Дослід 5.2. Тканини вирізали посмертно і зважили з точністю до 0,1 г (жирова) або 1 мг (всі інші). Довжини тіла та гомілки вимірювали після забою з точністю до 1 см та 1 мм відповідно. Вага надниркових залоз та селезінки забезпечував показники хронічної активності кортикостероїдів [36, 48]. Довжини тіла та гомілки забезпечували показники лінійного зростання. Вага та довжина гомілки забезпечували сирий показник щільності кісток. Вага передньої великогомілкової кістки забезпечував показник мускулатури. Ваги жирової тканини білого кольору забезпечували показники ожиріння. Коричневі маси жирової тканини забезпечували індекс здатності до виснаження енергії через термогенез.
Таблиця 1
Праймери та умови ПЛР
| Actb | Fwd: GGTATGGAATCCTGTGGCATCCATGA Рев: ACTCCTGCTTGCTGATCCACATCT | 24 цикли, TM = 93 ° C |
| Креб1 | Fwd: ACAGATTGCCACATTAGNCCAGGTA Рев: TCCACAGACTCCTGTGAATCTTCACT | 33 цикли, ТМ = 92 ° С |
| ΔFosb | Fwd: GGAGGGTTCGCAGAGAGAGAAACAA Рев: CCGAGGACTTGAACTTCACTCGG | 35 циклів, TM = 94 ° C |
| Tlr4 | Fwd: CTCCCTGAGACCTGAAAGCTTGGAT Rev: GGTGTAGACCCTGATATGCCTTGTCTT | 35 циклів, ТМ = 91 ° С |
Тест на годування/дослідження конфлікту, пов’язаний з тривогою (AFEC)
Як ми вже описували [36, 46], особин переводили в чисті тестові клітини, і крекера з presentedрема (Набіско, східний Ганновер, Нью-Джерсі) негайно представили. Інтервали для нюхання тестованої їжі (затримка наближення) або її перекушування (латентність корму) призначались сліпим для лікування пацієнтом. Для контролю неемоційних факторів також вимірювали підхід та затримку корму після повернення до домашніх клітин. Їжу виймали з домашніх клітин за 90 хвилин до тестування. Протягом 7 днів перед тестуванням випробовуваних звикли щодня
30 мг тестової їжі.
Тест винагороди за винагороду (RIP)
Щоб мінімізувати тривогу, спричинену новизною, людей оцінювали відразу після тесту AFEC, який дозволяв приблизно 10 хвилин акліматизації до тестових клітин. Нагороду (зломщик hamрема) та порожні (порожні) касети поміщали у верхній бункер для їжі на 5 хвилин. Касети представляли собою прозорий пластиковий контейнер для відеокасети MiniDV (Maxell, Woodland Park, NJ). Сукупний час, витрачений на розслідування (тобто нюхання, подряпини та клювання) кожної касети, вимірювався за допомогою секундоміра. Збільшення розслідування винагороди та уподобання винагороди (розслідування винагороди/загальне розслідування х 100) використовувались як показники гедонічного драйву.
Непряма калориметрія
Особи оцінювались у системі Oxymax (Columbus Instruments, Columbus, OH), як ми описали [36, 45]. Проби повітря пропускали через датчики O2 та CO2, і визначали виробництво тепла як швидкість метаболізму (ккал/год/кг 2/3) та катаболізм ліпідів як відношення дихального обміну (CO2/O2).
Накопичувальна мікродисекція
Заморожений мозок вирізали посмертно, заморозили в ізопентані на сухому льоду і зберігали при -80 ° C. Пізніше вони були заблоковані, встановлені на стадії заморожування мікротомів і розділені на 150 мкм через смужку, використовуючи атлас головного мозку хом'ячка [49]. Зрізи тканин розміщували на предметних предметних стеклах на морозильній пластині, а вентральний стриатум, що містить ядро ядер, розтинали під хірургічним мікроскопом за допомогою металевих пуансонів діаметром 0,75 мм (Тед Пелла, Реддінг, Каліфорнія).
Вилучення РНК
Ми використовували модифікацію методу фенолу, ізоамілового спирту, ізотіоціанату гуанідінію, β-меркаптоетанолу (PIG-B) [50]. Коротко кажучи, зразки тканин гомогенізували в PIG-B, повторно пропускаючи їх через 1-кубові шприци, обладнані голками 18-G. Монофазні гомогенати поділяли на 2 шари з п'ятою частиною обсягу хлороформу з подальшим центрифугуванням. Водну фазу екстрагували двічі, використовуючи один об'єм 5: 1 фенол: хлороформ (рН 4,5), і один раз одним об'ємом хлороформу з подальшим осадженням ізопропанолу та промиванням 75% етанолом. Якість РНК оцінювали за допомогою електрофорезу в агарозному гелі та спектрофотометрії.
ПЛР із зворотною транскрипцією
Зворотну транскрипцію проводили, як описано [46, 51], з використанням зворотної транскриптази M-MLV (New England Biolabs, Ipswich, MA). ПЛР-реакції проводили за допомогою Taq 2X Master Mix (New England Biolabs). Ампліфікації проводили за допомогою праймерів, перелічених у таблиці 1. Ми проводили ПЛР з гарячим запуском при 91 ° C, денатурацією при 94 ° C протягом 50 секунд та циклічним переміщенням при температурах плавлення, перерахованих у таблиці 1, протягом 20 секунд. Гібридизація відбувалась при 60 ° C протягом 20 секунд, з продовженням при 72 ° C протягом 30 секунд, використовуючи номери циклів, наведені в таблиці 1. Амплікони візуалізували на 1,4% агарозі, 5 мМ гелях тетраборату натрію та фарбували бромідом етидію (ISC Bioexpress, Kaysville, UT). Інтенсивність смуг аналізували за допомогою програмного забезпечення для аналізу зображень Kodak 1D (Eastman Kodak, Рочестер, Нью-Йорк). Дані про гени, що цікавлять, є засобами трикратних реакцій, нормалізованими до медіани. Норми бета-актину проводили в трьох примірниках і корелювали один з одним (r 2> 0,9). Цільові сигнали нормалізувались відповідно до стандартів.
Наркотики
Флуоксетин-HCl та дезіпрамін-HCl вводили у питну воду, як описано [46]. Пропранолол-HCl, траказолат-HCl і налтрексон розчиняли в 0,9% фізіологічному розчині. Діазепам розчиняли в етанолі та 0,9% сольовому розчині. Наркотики були придбані у Sigma (Сент-Луїс, Міссурі).
Статистичний аналіз
Односторонній ANOVA (експеримент 3.1), t-тест Стьюдента (експеримент 3.2) та двосторонній ANOVA з подальшим t-тестом Бонферроні (інші експерименти) використовувались для визначення відмінностей середніх значень, які вважалися значущими при значеннях р менше, ніж 0,050. Результати ANOVA представлені в таблицях 2 - 10. Аналізи проводили за допомогою Prism 5.04 та InStat 3.00 (GraphPad, Сан-Дієго, Каліфорнія).
- Reddit - хом'яки - сирійський хом'як в клітці та дієта
- PRIME PubMed Дієтичне споживання гриба білого ґудзика Agaricus bisporus прискорює слину
- Поживні речовини Безкоштовно Повний текст Дієтичне поєднання форсколіну з гомотаурином, м'ятою і В
- PRIME PubMed Ефекти дієтичних підходів до зупинки гіпертонії (DASH) на дієту зі смертельним наслідком або
- Нутріція Зростаюча роль дієтичної біотики у харчуванні немовлят