Сприятливий вплив екстракту гінкго білоба на каскад сигналізації інсуліну, дисліпідемію та ожиріння щурів із ожирінням, спричинених дієтою
Р.М. Банін
1 Departamento de Ciências Biológicas, Федеральний університет Сан-Паулу, Діадема, Іспанія, Бразилія
B.K.S. Хірата
1 Departamento de Ciências Biológicas, Федеральний університет Сан-Паулу, Діадема, Іспанія, Бразилія
І.С. Андраде
2 Disciplina de Fisiologia da Nutrição, Departamento de Fisiologia, Universidade Federal de São Paulo, São Paulo, SP, Brasil
J.C.S. Земдеги
2 Disciplina de Fisiologia da Nutrição, Departamento de Fisiologia, Федеральний університет Сан-Паулу, Сан-Паулу, SP, Бразилія
А.П.Г. Клементе
4 Faculdade de Nutrição, Universidade Federal de Alagoas, Maceió, AL, Бразилія
A.P.S. Дорнели
2 Disciplina de Fisiologia da Nutrição, Departamento de Fisiologia, Федеральний університет Сан-Паулу, Сан-Паулу, SP, Бразилія
В.Т. Болдарин
2 Disciplina de Fisiologia da Nutrição, Departamento de Fisiologia, Федеральний університет Сан-Паулу, Сан-Паулу, SP, Бразилія
Д. Естаделла
3 Departamento de Biociências, Федеральний університет Сан-Паулу, Baixada Santista, SP, Бразилія
К.Т. Альбукерке
5 Curso de Nutrição, Федеральний університет Ріо-де-Жанейро, Macaé, RJ, Бразилія
Л.М.Ояма
2 Disciplina de Fisiologia da Nutrição, Departamento de Fisiologia, Федеральний університет Сан-Паулу, Сан-Паулу, SP, Бразилія
Е.Б. Рібейро
2 Disciplina de Fisiologia da Nutrição, Departamento de Fisiologia, Федеральний університет Сан-Паулу, Сан-Паулу, SP, Бразилія
М.М. Телес
1 Departamento de Ciências Biológicas, Федеральний університет Сан-Паулу, Діадема, Іспанія, Бразилія
Анотація
Вступ
Ожиріння стало основною проблемою охорони здоров’я у всьому світі (1,2). Було висловлено припущення, що високий рівень ожиріння живота та надмірне споживання насичених жирів сприяють метаболічному синдрому, пов’язаному з ожирінням (3-5), а зв’язок між ожирінням, резистентністю до інсуліну та дисліпідемією посилює ризик серцево-судинних захворювань (6).
Екстракт гінкго білоба (GbE; стандартизований препарат під назвою EGb 761, який отримують з листя G. biloba) є одним із рослинних екстрактів, що найбільш часто використовуються в терапії (7). GbE (50: 1) містить близько 24% флавоноїдних глікозидів, 6% терпеноїдів (таких як дитерпеноїди A, B, C, M та J гінкголіди та сесквітерпен білобалід), 7% проантоціанідинів та органічних кислот з низькою молекулярною масою (8). Про цю рослину повідомляють про антиоксидантні, протизапальні, судинорозширювальні та протиедематогенні властивості (9,10).
Дослідження показали, що споживання GbE хворими на цукровий діабет 2 типу (T2DM) зменшує захворювання кровообігу та покращує глікемічний профіль (11,12). Зниження рівня глікемії також повідомлялося у діабетичних щурів, індукованих стрептозотоцином (13). Було припущено, що ці сприятливі ефекти можуть бути результатом значного стимулювання функції бета-клітин підшлункової залози/вироблення інсуліну (11) та значного зниження рівня глікованого гемоглобіну у хворих на Т2ДМ (14). Незважаючи на докази позитивного впливу GbE на глікемічний гомеостаз, у літературі немає даних про дію GbE на непереносимість інсуліну, пов’язану з ожирінням.
Таким чином, можна припустити, що GbE також може покращити нечутливість до інсуліну на каскаді сигнальних інсулінових порушень, пов'язаних із ожирінням. У цьому контексті метою цього дослідження було оцінити вплив GbE на покращення ряду параметрів, пов'язаних з толерантністю до інсуліну, у щурів із ожирінням, спричинених дієтою.
Матеріал та методи
Це дослідження було схвалено Комітетом з етики з досліджень тварин Федерального університету Сан-Паулу (Процес № 0321/11). Всі зусилля були зроблені, щоб мінімізувати страждання.
Тварини
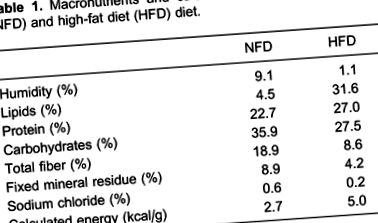
Самців щурів Wistar (2 місяці) випадковим чином розподіляли до групи нормальної жирової дієти (NFD) або групи з високим вмістом жиру (HFD). Групу NFD годували стандартною гранульованою лабораторною чау (Nuvilab ¯, Бразилія), яка забезпечувала 35,9% енергії у вигляді вуглеводів, 22,7% у вигляді білка та 4,5% у вигляді жиру, тоді як група HFD отримувала високо збагачену жирами дієту, яка готували додаванням до стандартної чау, 28% (мас./мас.) жиру, 10% (мас./мас.) сахарози, 20% (мас.) казеїну, для отримання вмісту білка в контрольній дієті та бутильованого гідрокситолуолу в кількість 0,4% (мас./мас.) додаткової олії. Це забезпечувало 19,5% енергії у вигляді вуглеводів, 23,2% у вигляді білка та 57,3% у вигляді жиру. У таблиці 1 представлені склади макроелементів та жирних кислот дієт.
Тварин поміщали чотирьох у клітку і утримували їх у контрольованих умовах освітлення (12: 12 год світло-темно, світло світиться о 6:00 ранку) та температури (23 ± 1 ° C), з вільним доступом до їжі та води. Група NFD залишалася на своїй дієті протягом усього дослідження, тоді як через 8 тижнів тварини з HFD були розділені на дві підгрупи, відповідно до фітотерапії, описаної нижче.
Лікування фітотерапією
GbE отримували з Південного Аньхой Дапенга (Китай). GbE містив флавонові глікозиди (26,12%), терпеноїди (6,86%), гінкголід А (2,20%), гінкголід Б (1,11%), гінкголід С (1,05%) та білобалід (2,50%).
Лікування фітотерапією проводили протягом 14 днів. Група HFD була поділена на дві групи: HFD + Gb та HFD + V. Групі HFD + Gb щодня давали 500 мг/кг GbE, розведеного у 2 мл 0,9% фізіологічного розчину (як розчинник), тоді як групам HFD + V та NFD давали лише 2 мл носія.
Вимірювання споживання їжі та маси тіла
Як вага тіла, так і споживання їжі протягом 24 годин вимірювали щотижня у віці від 2 до 4 місяців. Під час лікування фітотерапією тварин розміщували індивідуально, і щотижня вимірювали індивідуальне цілодобове споживання їжі та масу тіла. Щоденне споживання їжі обчислювали як різницю між кількістю запропонованої їжі та їжею, що залишилася через 24 год.
Параметри сироватки та вага жирових прокладок
Щурів обезголовили після 6-годинного періоду голодування. Кров збирали, центрифугували при 1258 g протягом 15 хв при 4 ° C, і сироватку зберігали при -80 ° C до аналізів. Концентрації глюкози, триацилгліцерину (TAG), загального холестерину, холестерину ЛПНЩ та холестерину ЛПВЩ визначали ферментативними колориметричними методами з використанням комерційних наборів (Labtest Diagnóstica, Бразилія). Рівні інсуліну вимірювали за допомогою набору ELISA (Millipore ¯, США). Оцінка оцінки моделі гомеостазу для рецептора інсуліну (HOMA-IR) була розрахована з урахуванням інсуліну натще (мкУ/мл) та глюкози натще (ммоль/л), як показано нижче: HOMA-IR = (інсулін × глюкоза)/22,5.
Ретроперитонеальні, мезентеріальні та епідидимальні склади жирової тканини розтинали і негайно зважували.
Тест на толерантність до інсуліну (ITT)
Зразки крові на хвості відбирали до (0 хв) та 5, 10, 15, 20, 25 та 30 хв після внутрішньочеревної ін'єкції звичайного інсуліну (2 ОД/кг маси тіла, Гумулін ¯ Людський інсулін, Елі Ліллі до Бразилія Лтда., Бразилія). Краплю крові додавали до реактивних смужок і вимірювали рівень глюкози за допомогою глюкометра (One Touch Ultra, Johnson & Johnson, США).
Вестерн-блот-аналіз
Щурів знеболювали тіопенталом натрію (80 мг/кг маси тіла, внутрішньочеревно). Черевну порожнину розкрили, оголили ворітну вену та ввели 6 мкг інсуліну. Шлунково-м’язовий м’яз видаляли до і через 90 с після інфузії інсуліну та гомогенізували в 1,0 мл буфера солюбілізації (100 мМ Трис, рН 7,5, 0,1 мг/мл апротиніну, 2 мМ фенілметилсульфонілфториду, 10 мМ ортованадата натрію, 100 мМ фтористого натрію, 10 мМ пірофосфату натрію та 10 мМ ЕДТА). Тритон Х-100 додавали до кінцевої концентрації 10%. Зразки центрифугували при 16000 g протягом 40 хв і поділяли рівні кількості білків, використовуючи 10% електрофорез додецилсульфат натрію в поліакриламідному гелі. Потім білки переносили в нітроцелюлозні мембрани за допомогою напівсухого апарату для перенесення (p-Akt/Akt: протеїнкіназа B, IR: рецептор інсуліну та PTP-1B: білок тирозин фосфатази 1B) або за допомогою апарату для мокрого перенесення (IRS-1 та IRS-2: субстрати рецепторів інсуліну 1 і 2; Bio-Rad, США).
Неспецифічне зв’язування білка з нітроцелюлозою зменшувалося попередньою інкубацією мембрани протягом ночі при 4 ° С в блокувальному буфері (1% бичачий сироватковий альбумін, 1 М трис, рН 7,5, 5 М NaCl, 0,02% Твін-20). Потім мембрани інкубували протягом ночі з первинним антитілом проти фосфо-Akt (Ser-473 9271S, Cell Signaling, США), IR (sc-711), IRS-1 (sc-559), IRS-2 (sc-8299), та PTP-1B (sc-1718), отримані від Santa Cruz Biotechnology (США). Потім усі мембрани інкубували зі специфічним вторинним антитілом, кон'югованим з пероксидазою хрону (Cell Signaling 7074S для мембран, інкубованих з IR, IRS-1 та IRS2; Sigma-Aldrich, США, A-51420 для мембран, інкубованих з PTP-1B) з наступною хемілюмінесценцією виявлення (Amersham Biosciences, США). Ті самі мембрани, що використовувались для фосфо-Akt, позбавляли і повторно пробували антитілом проти Akt (Cell Signaling 9272S) з наступною інкубацією зі специфічним вторинним антитілом, кон'югованим з пероксидазою хрону (Cell Signaling 7074S). Мембрани, що використовувались для ІЧ, IRS-1, IRS-2, Akt та PTP-1B, були позбавлені і повторно досліджені антитілом проти β-тубуліну (Cell Signaling 2146S).
Кількісний аналіз проводили за допомогою програмного забезпечення Scion Image (Scion Corp., США). У всіх експериментах принаймні один зразок з кожної групи аналізували паралельно, і результати повідомляли як процентну зміну щодо групи NFD.
Статистичний аналіз
- Антидіабетична та антигіперліпідемічна ефекти етанольного екстракту олео-камеді-смоли Ferula assa-foetida
- Екстракт коричневих морських водоростей щодо контролю глікемії та маси тіла - подання повного тексту
- Гострий вплив вібрації всього тіла на гальмування у здорових дітей
- Екстракт гіркого апельсина для бодібілдингу та підвищення енергії та прекрасного самопочуття завдяки побічним ефектам
- Тіло болить після баріатричної хірургії Побічні ефекти та засоби