Гіпохолестеринемічний ефект β-каріофілену у щурів, що харчуються збагаченою холестерином та жирами
Амані А. Гарб
1 Відділ біологічних наук, факультет наук, Університет Йорданії, Амман 11942, Йорданія
Ясер К. Бустанджі
2 Фармацевтичний факультет Йорданського університету, Амман 11942, Йорданія
Штайви С. Абдалла
1 Відділ біологічних наук, факультет наук, Університет Йорданії, Амман 11942, Йорданія
Анотація
Вступ
Відомо, що гіперліпідемія, особливо гіперхолестеринемія, є головним фактором розвитку серцево-судинних захворювань, жирових захворювань печінки та канцерогенезу, що призводить до проблем зі здоров'ям та смерті у всьому світі. (1) Встановлено, що дієта, що містить велику кількість жиру, пов’язана з підвищеним ризиком ожиріння та гіперліпідемії у людей та гризунів, оскільки вона підвищує рівень холестерину та тригліцеридів (ТГ) у плазмі та тканинах. (2)
В даний час доступні фармакологічні препарати для ефективного лікування гіперліпідемії, але вони мають безліч побічних ефектів, що спонукало дослідників шукати природні альтернативи. (3) Наприклад, природні антиоксидантні сполуки виявилися корисними для зменшення ступеня гіперхолестеринемії, оскільки вони коригують дисбаланс між вільними радикалами (прооксидантами), що виникають внаслідок підвищення рівня холестерину, та антивільними радикалами (антиоксидантами). (4,5)
Дієтичний сесквітерпен β-каріофілен (BCP) - це летюча сполука, яка є основним компонентом ефірних олій багатьох харчових та пряних рослин, зокрема чорного перцю (Piper nigrum), (6) материнки (Oreganum vulgare), (7) кориці (Cinnamon spp.), (8) гвоздика (Eugenia caryophyllata), (9) чебрець (Salvia spp.), (10) розмарин (Rosmarinus officinalis), (11) та хміль (Humulus lupulus) та, мабуть, багато інших видів. (12) Наприклад, було встановлено, що BCP утворює до 35% ефірної олії рослини конопель Cannabis sativa. (13) На додаток до використання в якості харчової добавки та в косметиці, BCP має помітну антиоксидантну та протизапальну дію та застосовувався при захворюваннях, пов'язаних із запаленням та окислювальним стресом. (14) Гертш та співавт. (15) показали, що BCP селективно зв'язується з тетрагідроканабінольним сайтом (сайтом зв'язування CP55940) рецептора канабіноїду-2 (CB2), що призводить до клітинної активації та протизапальних ефектів. Рецептори CB2 опосередковують багато фізіологічних та патологічних ефектів, включаючи запалення, утворення набряків, знеболюючі ефекти, реперфузійну травму ішемії, атеросклероз та остеопороз. (15)
BCP був схвалений кількома органами, що контролюють харчові продукти та смаки, для використання в якості харчової добавки і класифікувався як “загальновизнана як безпечна” сполука. (11) Ця сполука створила інтерес для багатьох дослідників як провід у розробці ліків, (21) отже, ця робота була проведена для перевірки гіпотези про те, що BCP має гіполіпідемічний ефект у щурів Wistar, які харчуються дієтою з високим вмістом холестерину та жирів.
Матеріали і методи
Хімікати
Холестерин (чистота 94%, Sigma-Aldrich, Японія), холева кислота (чистота> 98%, Sigma-Aldrich, Нова Зеландія) та BCP (чистота> 98,5%, Sigma-Aldrich, Румунія) закуповувались із зазначених джерел. Аторвастатин кальцій був люб’язно наданий компанією SANA Pharmaceuticals, Амман, Йорданія. Ферментативні набори для кількісного аналізу загального холестерину (TC), TG, HDL, аспартатамінотрансферази (AST), аланінамінотрансферази (ALT), лужної фосфатази (ALP) та лактатдегідрогенази (LDH) були придбані у Biosystem, Барселона, Іспанія. Набори для комерційного аналізу, що використовуються для визначення активності ферменту каталази (CAT) (комплект для аналізу каталази Каймана, артикул № 707002) та ферменту супероксиддисмутази (SOD) (комплект для аналізу супероксиддисмутази Каймана, артикул № 706002), придбані у Cayman Chemical Company (Енн Арбор, Мічиган).
Підготовка дієти з високим вмістом холестерину та жиру (HCFD)
HCFD - це стандартна щуряча чау з додаванням 1% холевої кислоти, 2% чистого порошку холестерину, 20% жиру (тваринне джерело) та 2% кукурудзяної олії. Компоненти додавали поступово до меленого звичайного раціону, повністю перемішували до однорідності, формували в тісто з додаванням дистильованої води (1000 мл), згортали за допомогою простих інструментів, розрізали на невеликі гранули і давали висохнути при кімнатній температурі протягом 2 -3 дні. Дієта готувалася щотижня і зберігалася при 4 ° C до використання для зменшення окислення. HCFD складався з: вуглеводів 43,57%, сирого білка 12,38%, сирої клітковини 4,73%, сирого жиру 3,17%, холестерину 2%, холевої кислоти 1%, тваринного жиру 20%, кукурудзяної олії 2%, загальної золи 4,3% та вологи 6,85%, тоді як звичайна дієта містила 58,1% вуглеводів, 16,51% сирих білків, 0% тваринного жиру, кукурудзяної олії, холестерину та холевої кислоти, причому інші компоненти суттєво не змінились. Обидва типи раціону були проаналізовані в лабораторному аналізі кормів, відділ тваринництва сільськогосподарського факультету Йорданського університету, Амман.
Тварини та експериментальний дизайн
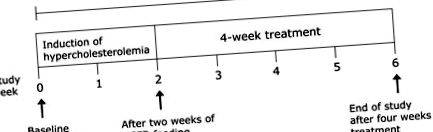
Тварин розміщували, годували та обробляли згідно з етичними рекомендаціями Університету Йорданії щодо захисту тварин та схвалення експериментів. Дорослих самців щурів Wistar (n = 48), вагою 150–180 г, протягом тижня витримували в лабораторних умовах для аклімації, а потім випадковим чином розподіляли на шість груп (по 8 тварин у кожній) наступним чином:
Група 1 (нормальний контроль), щурів годували нормальним раціоном протягом 6 тижнів. Протягом останніх 4 тижнів дослідження давали носій (кукурудзяну олію). В решті 5 групах гіперхолестеринемія індукувалась годуванням щурів HCFD протягом 2 тижнів. Щури, у яких рівень загального холестерину перевищував 200 мг/дл, розглядалися як гіперхолестеринемічні і були випадковим чином розділені на 5 груп (групи 2–6): (29)
Група 2 (негативний контроль), оброблена носієм (кукурудзяна олія).
Група 3 (позитивний контроль), які отримували референтний гіпохолестеринемічний препарат аторвастатин у дозі 20 мг/кг мас.
Група 4, які отримували БЦП у дозі 30 мг/кг маси тіла. (BCP 30).
Група 5, які отримували БЦП у дозі 100 мг/кг маси тіла. (BCP 100).
Група 6, які отримували БЦП у дозі 300 мг/кг маси тіла. (BCP 300).
Всі процедури проводили один раз на день в обсязі 0,5 мл/тварину шляхом перорального втручання згідно з протоколом, показаним на рис. 1. Дози BCP були підібрані на основі LD50 та раніше опублікованих досліджень, які показали, що пероральний LD50 BCP для щурів становить> 5000 мг/кг. (30–32)
Дизайн дослідження: За винятком групи 1, усі групи піддавались дієті з високим вмістом холестерину та жиру (HCFD) протягом 6 тижнів.
Забір крові
Кров відбирали з ретрорбітального сплетення ока на 0, 2, 3, 4, 5 і 6 тижні. Тварин голодували протягом ночі і злегка знеболювали діетиловим ефіром. Два мл крові відібрали, перенесли у стерильні вакуанти з гелем, давали згорнутися при кімнатній температурі протягом 1 год, центрифугували протягом 10 хв при 3000 об/хв. Сироватку відокремлювали і зберігали в пробірках Еппендорфа при -20 ° C для біохімічного аналізу. В кінці експерименту щурів голодували протягом ночі, зважували та жертвували передозуванням діетилового ефіру. Збирали більше крові (4 мл) через обидва ока, і отримували і зберігали сироватку, як зазначено вище. Видалили печінку, зважили і вирізали невелику частину правої частки, зафіксувавши в 10% -ному сольовому розчині формаліну для гістологічного дослідження.
Вимірювання ліпідного профілю у зразках сироватки
Рівні TC, TG та HDL вимірювали ферментативно, використовуючи комерційні набори для аналізу згідно з інструкціями виробника. LDL розраховували за рівняннями LDL = TC - [(HDL + дуже LDL (VLDL)] і VLDL = TG/5. Атерогенний індекс (AI) та співвідношення HDL/TC (HTR) були розраховані за останній тиждень експериментуйте наступним чином:
Активність ферментів печінкових маркерів у зразках сироватки
Діяльність AST, ALT, ALP та LDH вимірювали ферментативно у зразку сироватки за останній тиждень експерименту, використовуючи комерційні набори для аналізу згідно з інструкціями виробника.
Активність антиоксидантних ферментів у зразках сироватки
Супероксиддисмутаза (СОД)
Активність СОД у сироватці крові вимірювали на зчитувачі пластин ELISA при довжині хвилі 450 нм за допомогою набору для колориметричного аналізу згідно з інструкціями виробника.
Каталаза (CAT)
Активність CAT в сироватці крові вимірювали на зчитувачі пластин ELISA при довжині хвилі 540 нм за допомогою набору для колориметричного аналізу згідно з інструкціями виробника.
Вимірювання активності HMG-CoA-редуктази (співвідношення HMG-CoA/мевалонат) у гомогенаті печінки
Активність HMG-CoA-редуктази вимірювали в гомогенаті печінки за методикою Рао та Рамакрішнана. (33) Співвідношення HMG-CoA до мевалонату приймали за індекс активності ферменту, який каталізує перетворення HMG-CoA в мевалонат. Менші співвідношення свідчать про вищу активність ферментів і навпаки.
Гістологічне дослідження печінки
Печінки видаляли у щурів, фіксували у 10% -ному сольовому розчині формаліну, обробляли для вкладання парафіну, розрізали на ділянки товщиною 5 мкм за допомогою поворотного мікротома, встановлювали на предметні стекла і фарбували гематоксиліном-еозином. Десять світлових мікроскопічних полів кожного зрізу досліджували та оцінювали за ступенем стеатозу під складеним світловим мікроскопом при 200Х. Стеатоз печінки оцінювали кількісно як відсоток гепатоцитів, що містять макровезикулярний жир, за допомогою системи оцінювання та оцінки Kawasaki et al. (34) Макровезикулярний жир відноситься до крапель жиру, подібних або більших за розмір ядра, часто витісняючи ядро. (35)
Статистичний аналіз
Індекс атерогенності та співвідношення ЛПВЩ/ТК розраховували для щурів до кінця останнього тижня експерименту. Група 1, норма + кукурудзяна олія (транспортний засіб) (n = 7); група 2, HCFD + кукурудзяна олія (n = 8); група 3, HCFD + 20 мг/кг аторвастатину (n = 7); група 4, HCFD + 30 мг/кг BCP (n = 7); група 5, HCFD + 100 мг/кг BCP (n = 6); група 6, HCFD + 300 мг/кг BCP (n = 6). Дані виражаються як середні значення ± SEM і аналізуються за допомогою одностороннього ANOVA з подальшим тестом на найменшу значущу різницю Фішера. Різні літери в одному рядку вказують на значні відмінності при р 0,05) між групою 3 та групою 4 у співвідношенні HMG-CoA/мевалонат (рис. 3). Цей ефект на HMG-CoA-редуктазу спостерігався лише при 30 мг/кг BCP, але не при вищих дозах (100 та 300 мг/кг).
Вплив BCP на антиоксидантний статус
Активність СОД у сироватці крові була пригнічена (р 5 А). Істотної різниці в активності цього ферменту між групою 1 та групою 4 не спостерігалось. У групах 5 та 6 активність CAT, але не SOD, значно зросла (p 5 B). Активність СОД досить суттєво знизилась у 5 та 6 групах порівняно з 4 групою.
У цій роботі щоденне введення 30 мг/кг BCP щурам з гіперхолестеринемією протягом чотирьох послідовних тижнів спричиняло очевидне зниження рівня ТК, а також ЛПНЩ (31,6% та 39,1% відповідно), хоча це падіння ТК та ЛПНЩ був меншим, ніж індукований контрольним гіпохолестеринемічним препаратом аторвастатином (56,6% та 66,8% відповідно). Крім того, ця доза BCP збільшила рівень ЛПВЩ на 43,4%, ефект, який порівнянний з ефектом, викликаним аторвастатином (47,1%). Тим не менше, ця доза BCP не мала помітного впливу на рівень ТГ, мабуть, через низьку частку вуглеводів у раціоні, як обговорювалося вище. Ці спостереження частково узгоджуються з результатами недавнього дослідження з використанням Triton WR-1339, викликаної гіперліпідемією у щурів. (38) Це дослідження показало, що BCP знижує загальний холестерин, тригліцериди та холестерин ЛПНЩ, не підвищує рівень холестерину ЛПВЩ, пригнічує активність HMG-CoA-редуктази та покращує антиоксидантну систему.
ШІ та показники HTR% розглядались як показники атерогенезу. (39) У цих експериментах 30 мг/кг BCP пригнічували високий рівень ШІ до ступеня, порівнянного з рівнем індукованого аторвастатином, і підвищував низький рівень HTR% у гіперхолестеринемічних щурів.
Цікаво, що BCP, здавалося, інгібував HMG-CoA-редуктазу, фермент, що обмежує швидкість, у біосинтетичному шляху холестерину, і це інгібування було порівнянним із інгібуванням, викликаним аторвастатином. Це спостереження вказує на те, що гіпохолестеринемічний ефект 30 мг/кг BCP обумовлений пригніченням ендогенного синтезу холестерину.
Печінка, як правило, розглядається як основний орган, відповідальний за підтримку гомеостазу холестерину. У поточному дослідженні гіперхолестеринемічні щури показали збільшену печінку з блідим забарвленням і тендітною текстурою порівняно з нормальними щурами. Гепатомегалію можна пояснити високим вмістом жиру. (40) Вважається, що високий рівень холестерину в сироватці крові пошкоджує гепатоцити, що призводить до порушення функціонування печінки через макро- та мікровезикулярний стеатоз. (41) Гістологічне дослідження гіперхолестеринемічної печінки щурів продемонструвало накопичення ліпідів (помірний макростеатоз), втрату цілісності гепатоцитів, збільшення та зміщення гепатоцитів.
З іншого боку, щури, яких годували HCFD, які отримували 30 мг/кг BCP, демонстрували менше збільшення печінки, що свідчить про менше відкладення ліпідів у гепатоцитах. Гістологічне дослідження показало, що накопичення ліпідів у клітинах печінки у тварин, які отримували 30 мг/кг BCP, зменшилося, що свідчить про те, що пероральне введення 30 mg/kg BCP може полегшити стрес печінки, спричинений гіперхолестеринемією, та послабити тяжкість жирової печінки. Дійсно, відсоток стеатозу печінки підтверджував ці спостереження, оскільки стеатоз був значно зменшений при обробці 30 мг/кг BCP. На підтвердження цього Каллеха та ін. (16) повідомили, що BCP знижує ступінь стеатозу та ступінь фіброзу печінки, викликаного тетрахлоридом вуглецю (CCl4) у щурів. Нещодавно Камікубо та його колеги також продемонстрували роль BCP у пригніченні накопичення ліпідів у гепатоцитах на молекулярному рівні. (24) Вони показали, що BCP стимулює активацію AMPK шляхом фосфорилювання, ефект, опосередкований залежним від рецептора CB2 сигнальним шляхом Ca 2+. Активований сигнальний шлях AMPK посилює окиснення жирних кислот і послаблює ліпогенез.
У цій роботі 30 мг/кг BCP ефективно знижували рівень АЛАТ і AST у сироватці крові, які, як відомо, є маркерами для пошкодження печінки, спостереження, яке вказує на те, що BCP захищає від пошкодження печінки, спричиненого HCFD, та покращує функції печінки. Про подібні спостереження повідомляють Calleja et al. (16) де BCP пригнічував підвищену активність ALT, AST, ALP та LDH у щурів, оброблених CCl4. В іншому дослідженні Шямала та його колеги виявили, що гвоздика може знижувати рівень АЛАТ і АСТ у сироватці крові у гіперліпідемічних щурів, ефект, який може бути частково обумовлений BCP як одним з основних біоактивних компонентів. (42)
Було показано, що гіперхолестеринемія мінімізує ефективність антиоксидантної захисної системи за рахунок зниження активності CAT і SOD у щурів. (5) Наші дані підтверджують це спостереження, і воно також показало, що 30 мг BCP скасували цей ефект, піднявши антиоксидантну ферментну активність СОД у сироватці крові (і CAT, хоча це не досягло статистичної значущості) до рівня, близького до того, який спостерігався у нормальних щурів, що свідчить про те, що BCP посилював антиоксидантну систему. Це спостереження узгоджується з недавнім дослідженням, яке показало, що пероральне введення BCP діабетичним щурам покращувало діяльність SOD та CAT. (31) Подібним чином Каллеха та ін. (16) повідомили, що BCP є ефективним інгібітором перекисного окислення ліпідів, ймовірно, завдяки активності, що поглинає вільні радикали проти гідроксильних радикалів, супероксидних аніонів та пероксидів ліпідів. Більше того, було встановлено, що гвоздика, рослина, багата BCP, може збільшити активність SOD та CAT у гіперліпідемічних щурів. (42) Антиоксидантна здатність BCP може бути пов'язана з його хімічною структурою, такою як наявність біциклічної системи з подвійними кільцями. (17)
На закінчення, BCP відіграє ефективну роль у зниженні рівня ТК та ЛПНЩ, підвищує рівень ЛПВЩ та зменшує накопичення печінкових ліпідів у гіперхолестеринемічних щурів при застосуванні у дозі 30 мг/кг. Основним механізмом зниження рівня холестерину є, швидше за все, знищення АФК, що призводить до дезактивації ГМГ-КоА-редуктази та інгібування синтезу ендогенного холестерину. Ці спостереження вказують на те, що BCP може бути додатково вивчений як корисний терапевтичний препарат для лікування гіперхолестеринемії та жирової хвороби печінки.
- Знижує рівень холестерину - 🎄 Трав'яний чай для схуднення - аюрведична зцілююча залежність від дієтичних таблеток
- Інструменти планування їжі та списки продуктів харчування з низьким рівнем холестерину
- Кето проти макросу, що є кращим планом дієти макросів для швидкого схуднення • IIFYM • Розрахуйте свої макроси
- Як схуднути природним шляхом за допомогою цих дієтичних змін - Z Living
- Кетогенна дієта - періодичне та водне голодування 2019 2 книги в 1 - Як подолати схуднення