Спокійний процес синтезу та оцінки напівгідрату α-сульфату кальцію для замінника кістки
Нхі Тао Нгок Ле
1 Інститут прикладних матеріалів, В'єтнамська академія науки і техніки, Хошимін 70000, В'єтнам; moc.liamg@ihncognoahtel (N.T.N.L.); moc.liamg@3112neyugnmota (Q.L.N.); moc.oohay@512reniknahirt (M.-T.N.-L.)
Нгок Туй Транг Ле
2 Інститут досліджень і розробок, Університет Дай Тан, Дананг 550000, В'єтнам; nv.ude.natyud@4gnartyuhtnel
Куанг Лам Нгуєн
1 Інститут прикладних матеріалів, В'єтнамська академія науки і техніки, Хошимін 70000, В'єтнам; moc.liamg@ihncognoahtel (N.T.N.L.); moc.liamg@3112neyugnmota (Q.L.N.); moc.oohay@512reniknahirt (M.-T.N.-L.)
Truc Le-Buu Pham
3 Біотехнологічний центр Хошиміна, Хошимін 70000, В'єтнам; nv.moc.hcetoibmch@curtuub
Мінь-Трі Нгуєн-Ле
1 Інститут прикладних матеріалів, В'єтнамська академія науки і техніки, Хошимін 70000, В'єтнам; moc.liamg@ihncognoahtel (N.T.N.L.); moc.liamg@3112neyugnmota (Q.L.N.); moc.oohay@512reniknahirt (M.-T.N.-L.)
Дай Хай Нгуєн
1 Інститут прикладних матеріалів, В'єтнамська академія науки і техніки, Хошимін 70000, В'єтнам; moc.liamg@ihncognoahtel (N.T.N.L.); moc.liamg@3112neyugnmota (Q.L.N.); moc.oohay@512reniknahirt (M.-T.N.-L.)
4 Випускник Університету науки і технологій, В'єтнамська академія науки і техніки, Ханой 100000, В'єтнам
Анотація
1. Вступ
З метою зменшення витрат та пов'язаних з цим клінічних ризиків при лікуванні кісток, це дослідження пропонує одноетапний синтетичний процес α-HH з дигідрату. Синтезований α-HH був отриманий на хірургічному рівні та мінімізував потенційні ризики від добавок. Для отримання додаткової інформації про біологічні властивості також була проведена попередня оцінка в імітованій рідині тіла (SBF). Для дослідження потенційних токсичних ефектів α-HH, зокрема у формі частинок сульфату кальцію, які можуть клінічно існувати у пацієнтів, використовували аналіз цитотоксичності.
2. Матеріали та методи
2.1. Процес дегідратації до напівгідрату на виробництві
Порошок сульфату кальцію дигідрату (98%; Acros Organics – Thermo Fisher Scientific Inc., Morris Plains, NJ, USA) був використаний як попередник у цьому дослідженні. Спочатку 5 г CaSO4 · 2H2O додавали в скляну лабораторну пляшку, що містить 200 мл дистильованої води, і перемішували зі швидкістю 600 об/хв протягом 15 хв. Потім його доводили до синтетичних умов при 140 ° С і тиску 2,7 МПа протягом 4 год в автоклаві. Після закінчення реакції суспензію негайно фільтрували і п'ять разів промивали киплячою дистильованою водою. Нарешті, для видалення води застосовували стадію промивання ацетоном з подальшою сушкою при 55 ° C протягом 16 годин для видалення ацетону. Синтезований порошок витримували в посудині з темного скла при кімнатній температурі для дослідження.
2.2. Процес гідратації в дигідрат у використанні
Синтезований порошок змішували з деіонізованою водою із співвідношенням рідини до порошку (L/P) 0,8 мл/г. Суміш перемішували, утворюючи однорідну пасту, потім вводили у полістирольні форми (діаметр 14 мм × 4 мм товщини) і зберігали при 65% вологості при 37 ° С протягом 24 годин. Сформовані дископодібні зразки, що відповідають корисній формі α-HH, також відомій як сульфатні цементи кальцію, були охарактеризовані та оцінені щодо їх біологічних властивостей.
2.3. Попереднє оцінювання in vitro в SBF
Імітована рідина для організму (SBF) - це неорганічний розчин з концентрацією іонів, подібною до плазми крові людини. На сьогодні розчин SBF був найкращим рішенням для перевірки біоактивності кісток in vitro за допомогою апатитоутворюючої здатності поверхонь імплантатів, призначених для безпосереднього контакту з кісткою [23,24]. Апатит за хімічним складом схожий на основний неорганічний компонент кісткової тканини ссавців. Це один з небагатьох матеріалів, який класифікується як біоактивний матеріал, тобто він підтримує вростання та остеоінтеграцію кісток при імплантації в живе тіло [25]. Підвищена біологічна активність призводить до утворення апатиту на поверхні матеріалу за коротший час.
Буферизований трис-HCl розчин SBF 27 мМ HCO 3− (а саме Tris-SBF-27), використаний у цьому дослідженні, був сформульований на основі специфікації Кукобо [24] із модифікаціями А. Cuneyt Tas та співавт. [26] для кращого збігу з концентрацією іонів у плазмі людини. Всі хімічні реагенти були аналітичними реагентами (AR) і використовувались безпосередньо без будь-якого очищення. Матеріали контролювали протягом різних періодів занурення у розчин (1, 3, 5, 7 та 10 днів). Співвідношення загальної площі поверхні до об'єму розчину Tris – SBF-27 становило 10 мм 2 мл -1 при рН 7,4 та 37 ° C для кожного зразка у формі диска. Розчин оновлювали кожні 24 год, щоб забезпечити постійний початковий хімічний склад [27]. Значення рН розчину вимірювали щодня для групи зразків без освіження. Після попередньо вибраного часу замочування зразки обережно промивали деіонізованою водою для видалення розчину SBF з подальшою сушкою на повітрі в ексикаторі. Потім суху масу зважували для розрахунку зміни до і після занурення в розчин SBF. Деградація була розрахована у відсотках за втратою ваги на початкову вагу.
2.4. Характеристика матеріалу
Морфологічні зображення зразків були зроблені за допомогою скануючої електронної мікроскопії (SEM) (S-4800; Hitachi Ltd., Токіо, Японія) і розмірені за допомогою програмного забезпечення ImageJ (ImageJ; версія 1.52a, Національний інститут охорони здоров’я, Бетесда, штат Меріленд, США ). Аналіз кристалічності та ідентифікацію фаз проводили за допомогою інфрачервоного спектру (FTIR) (Frontier FTIR/NIR-спектрометр; PerkinElmer Inc., Waltham, MA, USA) у діапазоні хвильових чисел 4000-400 см -1, використовуючи метод грануляції KBr, та X- дифракція променів (XRD) (рентгенівський дифрактометр D8 Advance-Bruker; Bruker AXS GmbH, Карлсруе, Німеччина) із випромінюванням Cu Kα (λ = 1,54178Å), зі швидкістю сканування 5 °/хв у діапазоні 2θ від 5 ° до 70 °. Термогравіметричний аналіз (TGA) проводили для визначення чистоти фаз за допомогою системи термічного аналізу (TGA-DSC 3+; Mettler Toledo Inc., Columbus, OH, USA) від 0–300 ° C при швидкості нагрівання 10 ° З/хв у повітрі.
2.5. Аналіз цитотоксичності лактатдегідрогенази (ЛДГ)
У цьому дослідженні аналіз цитотоксичності LDH проводили при безпосередньому контакті між клітинами та частинками CS для оцінки короткочасного впливу. Клітинна лінія клітин фібробластів миші (NIH 3T3; Біотехнологічний центр Хошиміна, Хошимін, В'єтнам) культивували в модифікованому середовищем Орла (DMEM) Дульбекко (Gibco – Thermo Fisher Scientific Inc., Waltham, MA, USA) . Синтезований порошок зважували по 10, 25, 50, 100 та 200 мг. Потім ці зразки стерилізували ультрафіолетовим випромінюванням протягом 2 годин. Стерилізовані зразки замочували в 1 мл середовища для живлення клітин протягом 1 год ультразвукової обробки для отримання розчинів зразків. Суспензії клітин NIH 3T3 з 1 × 105 клітин/лунку на 100 мкл висівали в кожну лунку та інкубували в умовах культури клітин протягом 24 годин, утворюючи напівконфлюентний моношар. Згодом середовища для культивування клітин замінювали 100 мкл розчинів зразків (n = 7). Цитотоксичність після інкубації протягом 24 год визначали за допомогою набору для аналізу цитотоксичності LDH-WST (Dojindo Molecular Technologies Inc., Кумамото, Японія) згідно з інструкціями виробника. Після інкубації протягом 4 год утворювались кристали формазану.
Цілісність мембрани була візуалізована на основі розщеплення солі тетразолію (WST) до червоного кольору формазану шляхом виділення внутрішньоклітинної лактатдегідрогенази (ЛДГ) у живих клітинах. Життєздатність клітин зросла пропорційно кількості утвореного формазану, який реєстрували за величиною оптичної щільності (OD) при 450 нм за допомогою зчитувача мікропланшетів (VersaMax ™ Microplate Reader; Molecular Devices LLC, Саннівейл, Каліфорнія, США). Відсоток життєздатності розраховували за значенням OD за допомогою наступного рівняння:
де OD - середнє значення виміряного OD для досліджуваних зразків; ODn - середнє значення виміряного OD негативних контрольних зразків; і ODb - середнє значення виміряного OD порожніх зразків. Вважається, що зразок має гострий цитотоксичний потенціал, коли значення життєздатності знижується менше ніж на 70%.
2.6. Статистичний аналіз
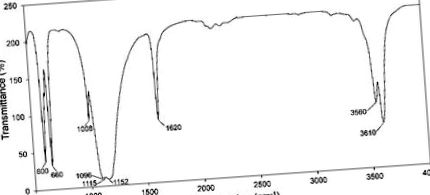
Набори даних обробляли за допомогою програмного забезпечення Microsoft Excel 2019 і виражали як середнє значення ± стандартне відхилення. Експериментальні середні значення порівнювали за допомогою одностороннього дисперсійного аналізу (ANOVA) за допомогою програмного забезпечення Minitab (Minitab ®; версія 16.0, Minitab LLC, Державний коледж, Пенсільванія, США) з тестом Тукі для порівняння між групами. У всіх оцінках, p Рисунок 1) показує поглинання кристалічних компонентів у синтезованому порошку. Основні піки, що відповідають напівгідрату, представлені при 660 см -1 для згинальних коливань іонів SO4 2−, 3560 та 3610 см -1 для валентності O – H (розтягування) та 1620 см -1 для коливальних коливань одного типу води за молекулярною структурою [28,29]. Інші піки позначали вібрації сульфат-іона, включаючи 600 см -1 (вигин), 1008 см -1 (розтягування), 1096 см -1 (розтягування), 1115 см -1 (розтягування) та 1152 см -1 (розтягування). У кристалах не було чужорідних функціональних груп, які показували б, що ацетон на етапі промивання ефективно видалявся.
Інфрачервона спектроскопія синтезованого порошку з перетворенням Фур'є (FTIR).
Діаграма XRD (рис. 2) додатково підтверджує утворення фаз сульфату кальцію за їх типовими піками. Більшість піків були проіндексовані, що відповідає стандарту HH (ICDD 41-0224). Три піки, що відповідають стандарту DH (ICDD 33-0311), також були виявлені при низькому рівні сигналу. Результати показали, що HH був чи не єдиним мінералом у синтезованому порошку, але все ще були сліди DH. XRD все ще не міг перевірити, чи належав гемігідрат до α-форми або β-форми. Тим не менше, Сураджіт М. та ін. із стандартних схем фаз CS вказав, що β-HH мав би широкі та низькі інтенсивні дифракційні піки [30]. Крім того, пік α-HH на площині (204) був би значно нижчим, ніж на площині (400). Сучасний синтез з використанням автоклаву привів до утворення висококристалічних кристалів на відміну від β-HH та кристалічних площин, сумісних з α-HH. Отже, синтезований напівгідрат сульфату кальцію мав бути у α-формі.
Рентгенографічна картина синтезованого порошку.
На малюнку 3 показані морфологічні зміни до та після лікування зневоднення. На мікрофотографіях попередник дигідрату з різною формою (рис. 3а) перетворений у напівгідратні кристали, які мають однорідну морфологію призматичної форми з гострими краями (рис. 3б). Широко прийнято, що кристали α-HH характеризуються добре сформованими прозорими ідіоморфними кристалами з гострими кристалічними краями, тоді як β-HH складається з лускатих частинок, утворених дрібними кристалами [10,15,31]. Отже, у поєднанні з результатами XRD на малюнку 2 можна зробити твердий висновок, що синтезований напівгідрат був віднесений до α-форми. Вимірювання розміру дало середню довжину кристала 20,96 ± 8,83 мкм і діаметр 1,30 ± 0,71 мкм.
Скануюча електронна мікроскопія (SEM) мікрофотографії (a) Попередник дигідрату (DH) та (b) синтезований порошок.
На малюнку 4 показано втрату ваги (%) синтезованого продукту, виміряну за допомогою TGA. Теоретично вміст кристалічної води в HH та DH становить 6,2% та 20,9% відповідно. Починаючи з температури навколишнього середовища, крива показувала, що порошок поступово втрачав невелику кількість маси через фізіосорбовану воду. Швидкі втрати маси через зневоднення (приблизно при 100 ° C) зразка були зафіксовані на рівні 6,4026%, що перевищує відсоток води за теорією HH [32,33]. Отже, фазовий аналіз у TGA був сумісний з результатами XRD на малюнку 2, вказуючи на те, що обидва HH та DH були включені. Обчислюючи зафіксовану втрату ваги, чистота α-HH, за оцінками, становила 98,62%. Отже, з мінімізацією хімічних речовин у виробництві, α-HH достатньо досяг хірургічного рівня за стандартом FDA, щоб чистота (CaSO4 ≥ 98 масових%) була застосована як кістковий матеріал [21].
Крива термогравіметрії синтезованого порошку.
- BETTERBROTH ™ Кістковий відвар Солона карамель від Прювіт
- Bi; SUB; 2; SUB; Te; SUB; 3; SUB; тонкий гексагональний нанотромбоцити Синтез та його характеристика
- Про інгредієнти пива та процес заварювання - Growler; Зябра
- Автоматизована система порошкового розвантаження прискорює процес змішування для виробника шоколаду
- Автоматизована система розвантаження порошку прискорює процес змішування на 25 відсотків у шоколаді Forbes