Специфічний для міофібробластів YY1 сприяє розвитку фіброзу печінки
Хуан Лю
Інститут серцево-судинних захворювань Aab, Медичний факультет, Університет Рочестера, Школа медицини та стоматології, Рочестер, Нью-Йорк, США
b Ключова лабораторія збереження та підтримки родючості Міністерства освіти, Департамент біохімії та молекулярної біології, Школа основних медичних наук, Медичний університет Нінся, Іньчуань, Китай
Шуя Чжан
Інститут серцево-судинних захворювань Aab, Медичний факультет, Університет Рочестера, Школа медицини та стоматології, Рочестер, Нью-Йорк, США
b Ключова лабораторія збереження та підтримки родючості Міністерства освіти, Департамент біохімії та молекулярної біології, Школа основних медичних наук, Медичний університет Нінся, Іньчуань, Китай
Суовен Сю
Інститут серцево-судинних захворювань Aab, Медичний факультет, Університет Рочестера, Школа медицини та стоматології, Рочестер, Нью-Йорк, США
Марина Корольова
Інститут серцево-судинних захворювань Aab, Медичний факультет, Університет Рочестера, Школа медицини та стоматології, Рочестер, Нью-Йорк, США
Ерік М. Малий
Інститут серцево-судинних захворювань Aab, Медичний факультет, Університет Рочестера, Школа медицини та стоматології, Рочестер, Нью-Йорк, США
Чжен генерал Цзінь
Інститут серцево-судинних захворювань Aab, Медичний факультет, Університет Рочестера, Школа медицини та стоматології, Рочестер, Нью-Йорк, США
HL, SZ та ZGJ написали рукопис з коментарями та внесками від усіх авторів. HL, SZ та MK проводили експерименти. SX виправив і переглянув рукопис. EMS надала ключові реагенти. ZGJ задумав дослідження. Усі автори схвалили остаточну версію рукопису.
Пов’язані дані
Анотація
Фіброз печінки є загальним наслідком різних хронічних гепатитів та травм печінки. Міофібробласти через накопичення білків позаклітинного матриксу (ECM) тісно пов’язані з прогресуванням фіброзу печінки. Однак молекулярні механізми, що лежать в основі транскрипційної регуляції фіброгенних генів та білків ECM у міофібробластах, залишаються в основному невідомими. Використовуючи індуковані тамоксифеном міофібробласт-специфічні Cre-експресуючі лінії мишей із селективною делецією фактора транскрипції Yin Yang 1 (YY1), ми показуємо, що делеція YY1 в міофібробластах пом'якшує індукований тетрахлоридом вуглецю фіброз печінки. Цей захисний ефект абляції YY1 на фіброз печінки супроводжувався зниженою експресією профіброгенних генів та білків ECM, включаючи TNF-α, TGF-β, PDGF, IL-6, α-SMA та Col1α1 в тканинах печінки від мишей-мутантів YY1. Більше того, використовуючи зоряну клітину печінкової клітини людини (HSC) лінії LX-2, ми виявили, що нокдаун YY1 в міофібробластах за допомогою обробки siRNA зменшує проліферацію міофібробластів, експресію α-SMA та відкладення колагену. У сукупності наші висновки виявляють специфічну роль YY1 у печінкових міофібробластах та пропонують нову терапевтичну стратегію при захворюваннях печінки, пов’язаних із фіброзом печінки.
1. Вступ
Фактор транскрипції Інь Ян 1 (YY1) відіграє вирішальну роль у різних біологічних процесах, включаючи клітинну проліферацію, диференціацію та розвиток [7]. Однак незрозуміло, чи сприяє YY1 активації міофібробластів та виробленню ECM під час розвитку фіброзу печінки. Використовуючи нещодавно сконструйовані миші, орієнтовані на ген генів рекомбінази Postn Cre (Postn MCM), для генетичної абляції YY1 у міофібробластах, ми повідомляємо, що специфічна для міофібробластів делеція YY1 інгібувала утворення міофібробластів та ослаблювала фіброз печінки у мишей, які страждали тетрахлоридом вуглецю CCL ).
2. Матеріали та методи
2.1. Миші та лікування
Для оцінки потенційного ефекту дефіциту YY1 в міофібробластах на моделі мишей, які отримували фіброз, оброблений CCL4, миші, дефіцитні міофібробластам YY1 (YY1 flox/flox, Postn MCM +), генерували шляхом схрещування мишей YY1 flox/flox [8] з мишами Postn MCM + [9]. Умовні нокаути мишей YY1 (YY1 флокс/флокс) [8] були придбані у лабораторії Джексона; Мишей Postn MCM + обдарував Джеффрі Д. Молкентін [9] (Дитяча лікарня Цинциннаті). Мишей флокс/флокс YY1 використовували в якості дитинчатого дикого типу (WT). 10-тижневий YY1 флокс/флокс; Мишей Postn MCM + годували тамоксифенною харчовою дієтою (Envigo, Cat. № TD.130857) протягом 8 тижнів CCL4 (Sigma, Cat. No 289116 2 мкл/г, розведене 1: 4 в оливковій олії (Sigma, Cat No. O1514), що вводиться один раз на день протягом п’яти днів (разом 12 разів). Через вісім тижнів мишей забивали під наркозом через 48 год після останньої дози CCL4. Усі дослідження на тваринах були схвалені Інституційним комітетом з догляду та використання тварин при Медичний центр Університету Рочестера.
2.2. Гістологія та імуногістохімія
2.3. Експерименти з культурою клітин
Лінія зоряних клітин печінки людини (HSC) LX-2 [10] (MilliporeSigma, Cat. No. SCC064). Клітини LX-2 культивували в DMEM з високою глюкозою (Millipore Cat. No. SLM-021-B), 2% FBS (Millipore Cat. No. ES009-B), 1% Pen/Strep (Millipore Cat. No. TMS- AB2-C) та 1% глютаміну (Millipore Cat. No. TMS-002-C). Клітини LX-2 пересівали трипсином (Millipore Cat. № SM-2003-C), а потім перед використанням їх пасували. Клітини LX-2 стимулювали TGF-β (10 мкг/мл; Sigma, Cat No SAB4502958) протягом 24 годин, щоб трансформуватися в міофібробласт.
2.4. трансфекція міРНК
Для трансфекції використовували міофібробласти при злитті більше 80% у 60-мм посуді. Коротше кажучи, трансфікуючий агент RNAiMax (6 мкл; Invitrogen; Кат. No 13-778-030) змішували з Opti-MEM (250 мкл; Invitrogen; Кат. № 11-058-021), а потім siRNA людини YY1 (25 нМ, Invitrogen; Cat. No АМ16708) або нецільову контрольну siРНК (25 нМ, Invitrogen; Cat. No. AM4065), розведену в 250 мкл Opti-MEM, додавали до розчину, обережно перемішували та інкубували при кімнатній температурі протягом 20 хв. . Загалом 0,5 мл цієї суміші додавали до MF в 1,5 мл Opti-MEM і інкубували протягом чотирьох годин. Потім носій замінювали повноцінним середовищем DMEM і клітини обробляли через 48 год після трансфекції [11].
2.5. Кількісна ПЛР в режимі реального часу
Після обробки загальну РНК екстрагували за допомогою набору QIAGEN RNeasy Mini (Qiagen, Cat № 74136) [11]. Концентрацію та чистоту РНК визначали за допомогою спектрофотометра Nanodrop2000 (Thermo Fischer Scientific). Для зворотної транскрипції 0,5—1 мкг загальної РНК спочатку перетворювали на ланцюг комплементарної ДНК (кДНК), використовуючи комплект для зворотної транскрипції кДНК високої ємності (Applied Biosystems, Cat № 4374966), дотримуючись інструкцій виробника. Потім проводили кількісну ПЛР в реальному часі за допомогою термоциклера ПЛР у реальному часі Bio-Rad iQ5, використовуючи iQ SYBR Green Supermix (Bio-Rad, Cat. № 1708886) для відносного визначення мРНК. Всі послідовності праймерів були перераховані в таблиці S1. Метод порівняльного порогу циклу (Ct) (2 – ΔΔCt) був використаний для визначення відносної експресії мРНК цільових генів після нормалізації до господарського гена GAPDH або β-актину.
2.6. Вестерн-блот-аналіз
Заморожені тканини печінки та загальні лізати клітин збирали у свіжоприготованому буфері для лізису (20 мМ Tris-HCl рН 7,5, 150 мМ NaCl, 1% Тритон Х-100, 1 мМ ЕДТА, 1 мМ ЕГТА, 2,5 мМ пірофосфату натрію, 1 мМ β-Гліцеролфосфат, 50 мМ NaF, 1 мМ Na3VO4 та 1% коктейль інгібітора протеази). Після освітлення при 4 ° C клітини відкручували при 12 000 г протягом 10 хв; загальний клітинний лізат збирали для аналізу гелю SDS-PAGE. Через 1,5 год перенесення при 250 мВ мембрани блокували в блокувальному буфері LI-COR, розведеному 1: 1 PBS при кімнатній температурі протягом однієї години. Потім ляпки інкубували з первинними антитілами (перерахованими в таблиці S2), розведеними у 3% BSA при 4 ° C протягом ночі або кімнатної температури протягом однієї години, після чого інкубували з козячим IgG козячого анти-миші LI-COR IRDye ® 680RD (H + L) або IRDye ® 800CW козячий анти-кролячий IgG (H + L) або IRDye ® 680RD осличий анти-козячий IgG (H + L) (розведення при 1: 10000) при кімнатній температурі протягом 30 хв. Зображення візуалізувались за допомогою системи інфрачервоного зображення Odyssey (LI-COR) [11]. Денситометрійний аналіз плям проводили за допомогою програмного забезпечення NIH Image J (http://imagej.nih.gov/ij/).
2.7. Статистичний аналіз
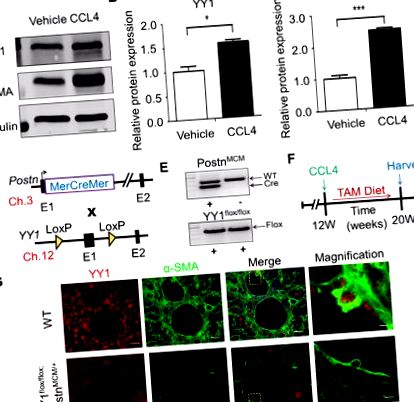
Дані представлені як середні значення ± SEM. Статистичний аналіз проводили за допомогою програми GraphPad Prism Software версії 5.02 (GraphPad Software, La Jolla, CA). Результати оцінювали за допомогою t-тесту або одно- або двостороннього дисперсійного аналізу (ANOVA), коли це доречно. Значення P Р Рис. 1A та andB, B, C). В). Щоб дослідити функцію похідного з міофібробластів YY1 in vivo, ми спеціально аблятували ген YY1 у мишачих міофібробластів шляхом генерування мишей-нокаутів YY1, специфічних для міофібробластів. Генетичний локус Postn був націлений на кДНК MerCreMer, індуковану тамоксифеном (MCM) (Postn MCM) [9], і цих мишей схрещували з цільовим штамом Yx1 flox/flox [8] (рис. 1D). Ми створили Postn MCM +; Миші YY1 флокс/флокс (Postn MCM +; YY1 флокс/флокс) та миші однолітка контролюють мишей флори/флокси дикого типу (WT) YY1 (рис. 1Е). Для встановлення мишачої моделі фіброзу печінки дорослим мутантам та мишам WT (8—10 тижнів) піддавали внутрішньочеревну ін’єкцію CCL4 протягом 8 тижнів та одночасно годували дієту, що містить тамоксифен (ТАМ), щоб білок Cre міг полегшити рекомбінацію в активованому фібробласти/міофібробласти для видалення гена YY1 (рис. 1F). Використовуючи подвійне імунофлуоресцентне фарбування YY1 та маркер міофібробластів α-SMA, ми спостерігали приблизно 80% делецію білка YY1 у міофібробластах під час фіброзу печінки (рис. 1G). Ці результати вказують на те, що алель Postn MCM ефективно видаляє ген YY1, націлений на loxP, у міофібробластах печінки мишей, підданих дії CCL4.
Породження мишей, дефіцитних для міофібробластів YY1. (A) Вестерн-блот-аналіз показав експресію білка YY1 та α-SMA у печінці мишей C57BL/6J з індукованим CCL4 фіброзом. (B) Відносна експресія білка YY1 у печінці від контрольних та CCL4-оброблених мишей. (C.) Відносна експресія білка α-SMA у печінці від контрольних та CCL4-оброблених мишей. (D) Схематична стратегія розведення різних ліній миші. Генетичний локус Postn, що містить регульовану тамоксифеном касету MCM кДНК, вставлену в екзон 1 (E1), схрещували з YY1 flox/flox, що містять лінії, націлені на ген. Показана хромосома миші, пов’язана з кожним алелем. (Е) Репрезентативне зображення для генотипування результатів ПЛР Postn MCM/+; YY1 флокс/флокс миші та YY1 флокс/флокс миші. (F) Експериментальна схема, коли мишам вводили CCL4 протягом 8 тижнів і годували тамоксифеном їжу за 48 год до ін’єкції CCL4, а потім підтримували дієту тамоксифену до збору врожаю. (G) Репрезентативне імунофлуоресцентне фарбування, що показує, що експресія YY1 на печінкових міофібробластах (α-SMA-позитивні клітини) в печінці від мишей WT та Postn MCM/+; YY1 флокс/флокс миші після 8 тижнів ін'єкції CCL4 (n = 4). Шкала шкали: 20 мкм.
3.2. Дефіцит YY1 в міофібробластах полегшує фіброз печінки у мишей
Ми встановили мишачу модель фіброзу печінки шляхом ін’єкції CCL4 дорослому Postn MCM/+; YY1 флокс/миші флокс та миші WT (YY1 флокс/флокс) протягом 8 тижнів у присутності тамоксифенної дієти, щоб білок MCM міг проміжною рекомбінацією в міофібробластах. Печінку мишей збирали, а рівень фіброзу печінки вперше аналізували за допомогою макроскопічних зображень цілої печінки (рис. 2А). Розмір печінки від Postn MCM/+; YY1 флокс/флокс миші були більшими, ніж у мишей WT. Менше вузликів на поверхні печінки Postn MCM/+; YY1 флокс/флокс миші були помітні порівняно з мишами WT (рис. 2А). Вага печінки була збільшена в MCM Postn/+; YY1 флокс/флокс печінка, ніж у печінці ВТ (рис. 2Б). Крім того, гістологічний аналіз фарбування H&E виявив менший некроз та утворення регенеративних вузликів та фіброзних перегородок у Postn MCM/+; YY1 миші флокс/флокс, тоді як групи WT виявляли важкий стеатоз та некроз (рис. 2С). Червоне фарбування Picro Sirius показало, що відкладення печінкового колагену помітно зменшилось у Postn MCM/+; YY1 флокс/флокс миші порівняно з мишами WT (рис. 2D). Ці результати вказують на те, що видалення YY1 з нещодавно активованого фібробласта (міофібробластів) значно зменшує фіброзну реакцію печінки та ефективно інгібує прогресування фіброзу печінки.
Специфічна для міофібробластів делеція YY1 зменшує фіброз печінки у мишей. (А) Репрезентативні макроскопічні зображення печінки від Postn MCM/+; YY миші флокс/флокс та миші WT (флокс/флокс) після восьми тижнів ін’єкції CCL4 та лікування тамоксифеном. (B) Порівняння маси печінки Postn MCM/+; YY флокс/флокс миші та миші WT. (C.) Репрезентативне фарбування H&E печінки від Postn MCM/+; YY флокс/флокс миші та миші WT. (D) Гістологічні фотографії фарбування Picro Sirius червоним кольором фіброзу печінки в MCN Postn/+; YY флокс/флокс миші та миші WT.
3.3. Специфічна для міофібробластів делеція YY1 пригнічує експресію фіброзних генів у печінці
Специфічна для міофібробластів делеція YY1 зменшує експресію генів ECM та профіброгенних факторів у печінці. (A) Кількісна ПЛР в режимі реального часу показала експресію генів, пов’язану з фіброзом, у печінці від WT та Postn MCM/+; YY флокс/флокс миші після 8 тижнів ін’єкції CCL4 та лікування тамоксифеном. Дані були представлені як середнє значення ± SEM для шести мишей. * p миші flox/flox WT. (B) Вестерн-блот-аналіз показав експресію білка α-SMA в печінці Postn MCM/+; YY флокс/флокс миші порівняно з мишами WT. (C.) Виявлена імунофлуоресценція експресія α-SMA в Postn MCM/+; yy флокс/флокс мишей печінки порівняно з мишами WT. Блакитний колір - ядра DAPI фарбування. Шкала шкали, 100 мкМ.
3.4. Виснаження YY1 сіРНК послаблює профіброгенні властивості міофібробластів людини
Міофібробласти продукують значну кількість α-SMA та колагену Iα, що сприяє фіброгенезу печінки [12]. Щоб визначити функціональну значимість YY1 у фіброгенезі, спричиненому міофібробластами, ми культивували клітини HSC людини (клітинна лінія LX-2) та обробляли клітини TGF-β протягом 24 годин, щоб викликати активацію/диференціювання HSC у міофібробласти, з подальшим лікуванням МіРНК YY1 протягом 24 год для нокдауну ендогенної експресії YY1. Послідовно аналіз qPCR (рис. 4A), вестерн-блот (рис. 4B) та імуноцитохімія (рис. 4C) показав, що спостерігається значне зменшення експресії α-SMA у міофібробластах, збіднених YY1, ніж у клітинах, оброблених шифрованою контрольною сиРНК . Ці результати вказують на те, що втрата YY1 послаблює експресію α-SMA міофібробластів, припускаючи, що виснаження YY1 може зупинити фенотипи міофібробластів і перешкодити цим клітинам секретувати білки ECM (рис. 4D).
Виснаження YY1 сіРНК послаблює профіброгенні властивості міофібробластів людини. (A). Кількісна ПЛР в режимі реального часу виявила рівень мРНК α-SMA та колагену Iα. Графіки показали кількісну оцінку експресії мРНК α-SMA в клітинах LX-2, які піддавались дії TGF-β протягом 24 годин, а потім обробляли міРНК YY1 (si-YY1) або контрольною сиРНК (si-Con) протягом 24 годин. Дані представляють середнє значення ± SEM для 3 незалежних експериментів. * p MCM мишей, ми генерували миофібробласт-специфічні миші-нокаути YY1, щоб окреслити роль YY1 у фіброзі печінки. Наші результати вказують на те, що алель Postn MCM ефективно стирає націлений на loxP ген YY1 з активованих фібробластів у печінці. Миші Postn MCM Cre нещодавно використовувались у кількох дослідженнях серцевого фіброзу і виявились дуже корисним інструментом для розтину сигнальних каскадів, що лежать в основі серцевого фіброзу та серцевої недостатності [14]. Використовуючи мишачу модель індукованого CCL4 фіброзу печінки, ми виявили, що генетична абляція YY1 в міофібробластах захищає від прогресування фіброзу печінки. Наші висновки показують, що специфічне інгібування YY1 у печінкових міофібробластах може обмежити прогресування фіброзу печінки in vivo.
Підводячи підсумок, це дослідження розкриває нову функцію специфічного для міофібробластів YY1 у сприянні фіброзу печінки. Отримані нами результати свідчать про те, що YY1 є новою терапевтичною метою для боротьби з прогресуванням фіброзу печінки.
Додатковий матеріал
Додатковий матеріал
Подяка
Це дослідження було підтримане грантами Національного інституту охорони здоров’я (NIH) [HL128363, HL130167 ZGJ] та Американською асоціацією серцевих асоціацій Grant-In-Aid [17GRNT33660671 ZGJ]. SX є лауреатом премії Американської кардіологічної асоціації за розвиток кар'єри (18CDA34110359). SZ також підтримали гранти Національного фонду природничих наук Китаю (81360094 та 31560290) та першокласних дисциплін Західного Китаю з основних медичних наук у Медичному університеті Нінся (NXYLXK20T7B07). Ми вдячні доктору Джеффрі Молкентіну з Медичного центру дитячої лікарні Цинциннаті за надання нам мишей Postn MCM.
Виноски
Додаток А. Додаткові дані
Додаткові дані до цієї статті можна знайти в Інтернеті за посиланням https://doi.org/10.1016/j.bbrc.2019.05.004.
Конфлікт інтересів
Автори заявляють, що у них немає конфлікту інтересів.
- Свиняча печінка - факти харчування
- Картопля з беконом та печінкою - Ситна кухня
- Фрукти граната - життєво важливі для здорової дієти печінки
- Органічне очищення від детоксикації, очищення товстої кишки, очищення печінки, очищення нирок, детоксикація крові, невиліковні речовини
- Попередньо реплікативні зміни, пов'язані з фазою холерезу, викликаного жовчними кислотами, у печінці регенеруючих щурів