Специфічне для тканин регулювання SIRT1 шляхом обмеження калорій
Даніка Чень
1 Департамент біології, Массачусетський технологічний інститут, Кембридж, штат Массачусетс 02139, США;
Джоан Бруно
1 Департамент біології, Массачусетський технологічний інститут, Кембридж, штат Массачусетс 02139, США;
Ерін Іслон
2 Секція мікробіології Каліфорнійського університету в Девісі, Девіс, Каліфорнія 95616, США;
Су-Джу Лінь
2 Секція мікробіології Каліфорнійського університету в Девісі, Девіс, Каліфорнія 95616, США;
Хвей-Лінг Ченг
3 Медичний інститут Говарда Хьюза, Дитяча лікарня, Інститут імунних захворювань та Департамент генетики, Гарвардська медична школа, Бостон, штат Массачусетс 02115, США
Фредерік В. Альт
3 Медичний інститут Говарда Хьюза, Дитяча лікарня, Інститут імунних захворювань та Департамент генетики, Гарвардська медична школа, Бостон, штат Массачусетс 02115, США
Леонард Гуаренте
1 Департамент біології, Массачусетський технологічний інститут, Кембридж, штат Массачусетс 02139, США;
Анотація
Повідомляється, що обмеження калорій (CR) підвищує рівень білка SIRT1 у мишей, щурів та людей, а підвищена активність ортологів SIRT1 продовжує тривалість життя дріжджів, глистів та мух. У цьому дослідженні ми кидаємо виклик парадигмі того, що CR індукує активність SIRT1 у всіх тканинах, показуючи, що активність цього сиртуїну в печінці насправді знижується за допомогою CR і активується висококалорійною дієтою. Ми демонструємо цю зміну, аналізуючи рівні SIRT1 та його регуляторів малих молекул, NAD та NADH, а також оцінюючи фенотипи печінково-специфічної миші-нокаута SIRT1 на різних дієтах. Наші висновки свідчать про те, що розробка CR-міметиків, спрямованих на SIRT1 для забезпечення однакових системних переваг, може бути більш складною, ніж уявляється на сьогодні.
Споживання калорій впливає на тривалість життя та частоту захворювань у тварин (Koubova and Guarente 2003). Надлишок їжі пояснює недавнє історичне збільшення обмінних порушень у людей. І навпаки, обмеження калорій (CR) сприяє метаболічній придатності, тривалому життю та захисту від захворювань на моделях гризунів (Weindruch 1988). Було виявлено кілька генетичних шляхів, які регулюють дієту, метаболізм і тривалість життя (Van Remmen et al. 2001; Koubova and Guarente 2003; Kenyon 2005; Sinclair 2005).
Гени, пов'язані з дріжджами SIR2, які називаються сиртуїнами, кодують NAD-залежні деацетилази та сприяють довголіттю дріжджів, глистів та мух (Chen and Guarente 2007). У модельних системах, починаючи від дріжджів і мишей, сиртуїни також були пов'язані з оздоровчим ефектом CR. Ортолог SIRT1 для ссавців націлений на численні регуляторні фактори, що впливають на управління стресом та метаболізм (Sinclair 2005; Chen and Guarente 2007). Як повідомляється, рівні SIRT1 зростають у тканинах гризунів та людини у відповідь на CR (Cohen et al. 2004; Nisoli et al. 2005; Civitarese et al. 2007), і це підвищення пропонується спричинити сприятливі зміни в обміні речовин та толерантність до стресу, спричинена цією дієтою. Також пропонується поліфенольний ресвератрол частково імітувати CR шляхом активації SIRT1, щоб викликати сприятливий вплив на здоров'я (Baur et al. 2006; Lagouge et al. 2006).
Результати і обговорення
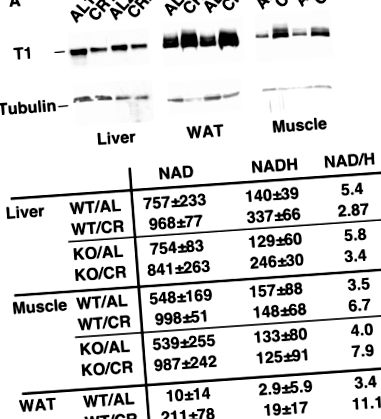
Диференціальна регуляція SIRT1 в тканинах мишей CR. (A) Експресія SIRT1 регулюється в м’язах та WAT, але знижується в печінці мишей CR. Експресія SIRT1 у печінці, м'язах та WAT мишей, яких годували дозвільно або з обмеженою калорійністю, визначали методом Вестерн-блот з антитілами проти SIRT1. Як контроль завантаження використовували тубулін. (B) Співвідношення NAD/NADH збільшується в м’язах і WAT, але зменшується в печінці мишей CR. Зверніть увагу, що рівні як NAD, так і NADH збільшуються в WAT на CR. Концентрації NAD та NADH у печінці, м’язах та WAT мишей дикого типу та нокауту SIRT1, що харчуються за свободою або з обмеженою калорійністю, виражаються як наномоль на грам тканини.
Миші-нокаути SIRT1, специфічні для печінки, не мають явного фенотипу при харчуванні чау-дієтою. (A) SIRT1 спеціально вибитий у печінці мишей SIRT1 LKO. Експресія SIRT1 у печінці, м'язах та WAT була виявлена за допомогою вестерн-блоттінгу антитілами проти SIRT1. Актин використовували як контроль навантаження. (B – F) Порівнювали масу тіла, масу печінки, рівень глюкози в крові та рівень інсуліну (годували та натощак) та толерантність до глюкози між мишами дикого типу та SIRT1 LKO на дієті чау-чау.
Далі ми протестували LKO-мишей на висококалорійній/жирній західній дієті проти дієти CR. Миші LKO показали надзвичайно значну різницю у західній дієті порівняно з диким типом (рис. 3). Збільшення ваги з часом, що є показником накопичення жиру в організмі, було зменшено у мишей LKO (рис. 3А), навіть незважаючи на те, що на споживання їжі це не впливало (дані не наведені). Відповідно накопичення жиру у ВАТ та печінці значно зменшилось у мишей LKO (рис. 3B – D). Крім того, миші LKO були захищені від фізіологічного спаду, викликаного західною дієтою у мишей дикого типу; вони були більш толерантними до глюкози і мали нижчий рівень глюкози в крові та інсуліну (рис. 3E – G). Ми прийшли до висновку, що миші LKO принаймні частково захищені від накопичення жиру та супроводжують дефіцит метаболізму на західній дієті. Миші KO SIRT1 для всього тіла на дієті з високим вмістом жиру також захищені від набору маси тіла та накопичення жиру в печінці (X. Li та L. Guarente, не опубліковано), що узгоджується з нашими висновками з використанням мишей LKO.
Той факт, що LKO мав фенотиповий ефект на мишей, які харчуються висококалорійною дієтою, але не на мишей, які харчуються звичайною дієтою чау, припускає, що активність печінки SIRT1 може бути прямо пропорційною калорійності, і передбачав, що цей сиртуїн може бути непрацездатним у печінці мишей дикого типу на CR. Відповідно до цієї ідеї, миші LKO демонстрували втрату ваги та зменшення жиру з часом на CR, який був паралельним дикому типу (рис. 4A, B). Зменшення розміру печінки, яке частково спричиняється апоптозом після накладення CR (Grasl-Kraupp et al. 1994; James et al. 1998), також спостерігалося у звичайних мишей LKO (рис. 4C). Далі, метаболічні параметри, які тестували (толерантність до глюкози в крові, інсуліну та глюкози), змінювались однаково у мишей LKO (рис. 4D – F). Нарешті, індукована CR-регуляція двох ключових глюконеогенних генів, PEPCK та глюкозо-6-фосфатази (G6P), а також їх транскрипційний коактиватор PGC-1α, у мишей LKO протікала нормально (рис. 4G).
Миші SIRT1 LKO нормально реагують на CR. (A – F) Вага тіла, вага WAT, маса печінки, рівень глюкози в крові, рівень інсуліну та толерантність до глюкози порівнювали між мишами дикого типу та LKO на дієті CR. (G) Експресію PGC-1α, PEPCK та G6P порівнювали між мишами дикого типу та LKO, які харчувались дієтою з високим вмістом жиру або дієтою CR за допомогою QRT – PCR.
Ми прийшли до висновку, що абляція SIRT1 в печінці не змінює часовий перебіг або рівні стійкого стану фізіологічних змін під час CR. Ця генетична знахідка, разом з демонстрацією того, що рівень білка SIRT1 та співвідношення NAD/NADH знижуються в печінці CR, вказує на те, що активність цього сиртуїну дійсно знижується в печінці під час CR. Нещодавнє спостереження, що ресвератрол індукує синтез глікогену в культивованих клітинах HepG2 (Sun et al. 2007), узгоджується з ідеєю, що висока активність SIRT1 в клітинах печінки сприяє накопиченню енергії.
Чому SIRT1 регулюється дієтою навпаки в печінці порівняно з іншими тканинами; наприклад, м'яз або ВАТ? CR підвищує метаболічну активність у м’язах та WAT, що, ймовірно, сприяє надходженню NADH в електронний транспорт і може пояснювати спостерігане нами збільшення співвідношення NAD/NADH. Однак печінка унікально виконує ключові біосинтетичні функції - синтез основної маси жиру та холестерину для організму (Canbay et al. 2007), який відбувається пропорційно до споживання калорій. Оскільки синтез жиру є високоредукційним процесом, тобто споживає відновлювальні еквіваленти, високонасичена печінка повинна мати окисно-відновний стан, який окислюється, а печінка CR - окисно-відновний стан. Цей окислювально-відновний ефект буде диктувати високий коефіцієнт NAD/NADH у печінці, що годується, і низький коефіцієнт у печінці CR, що підтверджується нашими висновками. Як ми також показали вище, зміни у співвідношенні NAD/NADH лежать вище за SIRT1, і тому обмежуватимуть активність цього сиртуїну високою у печінці, що годується, та низькою у печінці CR. Крім того, повідомляється, що рівні експресії SIRT1 координуються з окислювально-відновним станом у клітинах (Zhang et al. 2007), що може пояснити сильну позитивну кореляцію між рівнями білка SIRT1 та співвідношенням NAD/NADH у CR проти тканин AL.
Еволюція, можливо, пристосувала функцію SIRT1 в різних тканинах до метаболічних обмежень його активності, накладених CR. У м`язі активований CR-атом SIRT1 деацетилює PGC-1α для індукування мітохондрій та окислення жиру (Gerhart-Hines et al. 2007), а також запобігає апоптозу (Luo et al. 2001; Vaziri et al. 2001), перебуваючи у WAT це сприяє мобілізації жиру (Picard et al. 2004). У печінці пригнічення SIRT1 за допомогою CR також має фізіологічний сенс. По-перше, оскільки SIRT1 коактивує LXR, знижена активність цього сиртуїну в CR зменшить синтез жиру (Li et al. 2007). По-друге, знижена активність SIRT1 може активувати апоптоз печінки, який, як відомо, виникає у відповідь на CR (Grasl-Kraupp et al. 1994; James et al. 1998). По-третє, хоча деацетилювання PGC-1α за допомогою SIRT1 активізує біогенез мітохондрій у м’язах, деацетилювання цього коактиватора за допомогою SIRT1 не впливає на експресію мітохондріальних генів у печінці (Rodgers et al. 2005). Таким чином, не повинно бути витрат на виробництво енергії, пов’язаних із зменшенням активності SIRT1 в печінці під час CR.
Існує припущення, що деацетилювання PIR-1α в печінці за допомогою SIRT1 є важливим для індукції глюконеогенезу під час голодування (Rodgers et al. 2005; Rodgers and Puigserver 2007). Однак наші висновки вказують на те, що глюкоза та інсулін у крові не змінюються у мишей LKO, принаймні протягом довгого часу (24 години). Більше того, під час стійкого стану CR у мишей LKO зазвичай індукуються два ключові ферменти глюконеогенезу, PEPCK і G6P, а також сам PGC-1α. Очевидно, що підвищений рівень PGC-1α під час CR достатній для глюконеогенезу, навіть за відсутності коактивації SIRT1. Ці висновки узгоджуються з нещодавньою демонстрацією того, що ресвератрол та новіші класи активаторів SIRT1 не індукують глюконеогенез у дозованих тварин (Baur et al. 2006; Lagouge et al. 2006; Milne et al. 2007). Залишається можливим, що SIRT1 необхідний для глюконеогенезу протягом коротших періодів після голодування, але це потребуватиме подальших досліджень.
Отримані нами результати можуть мати важливе значення для розробки активаторів SIRT1 як CR-міметиків. Будь-який системний активатор SIRT1 може мати небажаний ефект, викликаючи або, принаймні, не запобігаючи синтезу жиру та холестерину в печінці. Ця можливість може пояснити, чому кілька категорій активаторів SIRT1 не зменшують масу тіла (Milne et al. 2007). Однак активація SIRT1 в метаболічних тканинах, таких як м'язи та адипоцити, може частково компенсувати негативні наслідки накопичення жиру. Наприклад, миші, що харчуються ресвератролом, на дієті з високим вмістом жиру не отримують жирної печінки, а насправді демонструють поліпшену фізіологію печінки та метаболічні функції (Baur et al. 2006; Lagouge et al. 2006). Отримані нами результати піднімають цікаву можливість того, що інгібітори SIRT1, спеціально орієнтовані на печінку, можуть бути корисними при лікуванні ожиріння. Такі інгібітори можуть також сприяти пом'якшенню небажаних побічних ефектів у печінці агоністів LXR, які були розроблені для збільшення зворотного транспорту холестерину та відтоку з периферичних тканин.
Підводячи підсумок, ми показуємо, що регуляція SIRT1 дієтою є більш складною, ніж спочатку уявлялося. Хоча припускали, що активність SIRT1 в цілому зростає під час CR, ми показуємо, що в печінці активність цього сиртуїну фактично знижується. Регуляція активності SIRT1 під час CR є не тільки специфічною для тканини, але і специфічною для регіону в неоднорідних тканинах, таких як мозок (D. Chen і L. Guarente, непублічна). Зниження активності SIRT1 в печінці CR корелює зі зниженою роллю цього органу в синтезі жиру. Таким чином, SIRT1 може зайняти важливе місце у перерозподілі ресурсів під час CR від росту, метаболізму та розмноження до підтримання та виживання.
Матеріали і методи
Миші-нокаути SIRT1 були описані раніше (McBurney et al. 2003). Миші-нокаути, специфічні для печінки SIRT1, генерували шляхом схрещування алелю SIRT1, що містить флоксований екзон 4 (Cheng et al. 2003), з мишами, що експресують Cre, що рухаються печінкоспецифічним промотором альбуміну. Усі миші були розміщені на 12: 12-годинному циклі світло: темно при контрольованій температурі (25 ± 1 ° C). Трьох-чотиримісячних тварин (n = 10) годували довільно або піддавали дієті з обмеженим вмістом калорій протягом 3 місяців, яку забезпечували щодня ввечері. Дані експериментів з КР були зібрані вранці. Західна дієта з високим вмістом жиру була надана компанією OpenSource Diets (D12079B). Всі процедури на тваринах відповідали Комітету з догляду за тваринами MIT.
Кров збирали з хвостових вен 10 мишей на групу і витримували на льоду до центрифугування (1500 г, 15 хв при 4 ° С). Плазму або використовували негайно для аналізів, або зберігали при -80 ° C до аналізу. Концентрацію глюкози визначали за допомогою глюкометра OneTouch Ultra (LifeScan). Рівні інсуліну вимірювали за допомогою ультрачутливого мишачого інсуліну EIA Kit (Alpco Diagnostics).
Для тесту на толерантність до глюкози мишам голодували протягом ночі і вводили внутрішньочеревно сольовий розчин глюкози при 1 г/кг маси тіла. Рівні глюкози в плазмі крові вимірювали до та через 20, 40, 60 та 120 хв після ін’єкції глюкози.
Приготування та аналіз РНК та білків
Загальну РНК екстрагували з тканин TRIZOL (Invitrogen) і додатково очищали міні-набором RNeasy (Qiagen). Для ПЛР-аналізу в реальному часі кДНК синтезували із загальної РНК за допомогою зворотної транскриптази SuperScript III (Invitrogen) із випадковими праймерами. кДНК піддавали ПЛР-аналізу з ген-специфічними праймерами у присутності CYBR green (Bio-Rad). Відносна кількість мРНК була отримана шляхом нормалізації до рівня циклофіліну.
Білки з тканин миші екстрагували в буфері RIPA (1% Triton X-100, 150 мМ NaCl, 5 мМ EDTA, 10 мМ Tris 7,0), що містить коктейль інгібітора протеази (Sigma). Білкові екстракти піддавали центрифугуванню при 14000 об/хв протягом 10 хв. Антитіло SIRT1 (розведення 1: 1000; Біотехнології Upstate). Антитіло SREBP1c (Біотехнології Санта-Крус).
Вимірювання NAD та NADH
Нуклеотиди NAD і NADH вимірювали, як описано (Lin et al. 2004). Близько 10 мг заморожених тканин гомогенізували в 300 мкл кислотного буфера для екстракції для отримання концентрації NAD або лужного буфера для отримання концентрації NADH. Двісті сорок мікролітрів супернатанту нейтралізували 120 мкл буфера. Концентрацію нуклеотидів вимірювали флуориметрично у ферментативній циклічній реакції із використанням 2–5 мкл зразка.
- Який вплив обмеження калорій впливає на мозковий терн
- Чому навіть худорляві люди можуть отримати користь від обмеження калорій
- Сонячні спалахи жовтих помідорів чері (5 штук) Інформація про калорії, жири, вуглеводи та білки в
- Як виглядають 500 калорій
- Чому кількість калорій у трекерах для фітнесу на всій карті WIRED