З’єднаний гетерозиготний BRAT1 мутації викликають сімейний синдром Отахари з гіпертонусом та мікроцефалією
Предмети
Анотація
Гомозиготне зрушення кадру BRAT1 мутації були виявлені у пацієнтів із летальною ригідністю новонароджених та синдромом мультифокальних нападів (MIM # 614498). Тут ми повідомляємо про двох братів і сестер із складеними гетерозиготними мутаціями в BRAT1. У них були нерозв'язні судоми з періоду новонародженості, дисморфічні риси та гіпертонус. Також спостерігалася прогресуюча мікроцефалія. Початкова електроенцефалограма показала характер придушення-спалаху, що призвело до діагностики синдрому Отахари. Вони обоє померли від пневмонії відповідно на 1 рік та 3 місяці. Секвенування всього екзома одного пацієнта виявило сполуку гетерозиготну BRAT1 мутації (c.176T> C (p.Leu59Pro) і c.962_963del (p.Leu321Profs * 81)). Ми не можемо отримати ДНК від іншого пацієнта. Мутація p.Leu59Pro відбулася в еволюційно збереженій амінокислоті в CIDE-N (N-кінці клітини, що викликає смерть клітини, DFF45-подібний ефектор), який відіграє роль регулятора в процесі фрагментації ДНК апоптозу. Наші результати надалі підтверджують мутації BRAT1 може призвести до епілептичної енцефалопатії.
BRAT1 при 7р22.3 кодує BRCA1-асоційований АТМ (мутантна атаксия телеангіектазія) активатор 1, який зв'язується як з пухлиною, що пригнічує білок BRCA1, так і з білком АТМ, і відіграє важливу роль у зондуванні пошкоджень ДНК. 1,2 Нещодавно гомозиготні мутації зміщення кадрів у BRAT1 повідомлялося, що у трьох пацієнтів з трьох окремих сібітських шлюбів амішів та іншого з близької мексиканської родини причиною летальної неонатальної ригідності та синдрому мультифокальних нападів (MIM # 614498) є. 3,4 Тут ми представляємо японських братів і сестер зі складеними гетерозиготними мутаціями в BRAT1.
Звіт про справу
Справа II-1
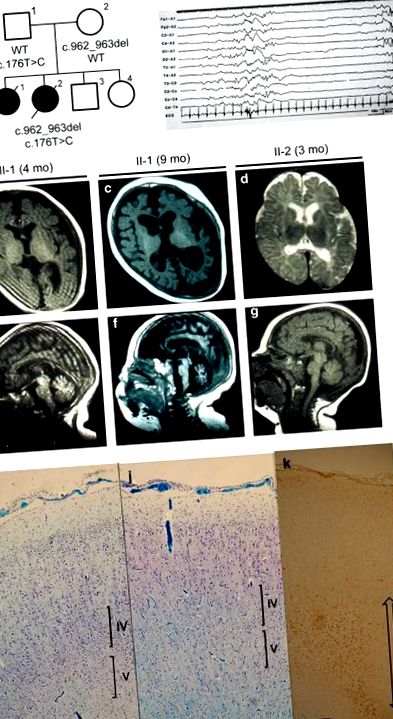
Вона народилася від неспоріднених батьків Японії як перша дитина без асфіксії після 40-тижневої вагітності (рис. 1а). Вага при народженні становила 2644 г (-1,15 стандартного відхилення (с. Д.)), А окружність голови (НС) 32,7 см (−0,55 с. Д.). Гіпертонус м’язів, мікрогнатія, коротка та перетинчаста шия та дисморфічне обличчя спостерігалися при народженні. Лабораторне обстеження не виявило жодних відхилень. Послідовні судоми її посмикування рук і ніг розпочались у віці 7 днів з подальшим генералізованим тонічним клонічним судом. Електроенцефалографія показала характер придушення-спалаху, що призвело до діагностики синдрому Отахари або ранньої міоклонічної енцефалопатії. Фенобарбітал та клоназепам не були ефективними. Напади апное з’явилися у віці 2 місяців. Зонісамід контролював напади апное та загальні тонічні судоми через 8 місяців, але міоклонічні напади кінцівок та обличчя були постійними. Її HC протягом 10 місяців становить 43,0 см (-2,3 с.д.). Магнітно-резонансна томографія головного мозку виявила прогресуючу атрофію головного мозку та мозочка (малюнки 1b, c, e та f), а фундускопічне дослідження виявило атрофію зорового нерва. Вона показала гіпертонус, гіперрефлексію та клонус стопи, але жодних етапів розвитку не було. Померла від пневмонії у віці 1 року 9 місяців.
Клінічні особливості сім'ї з синдромом Отахари. (a) Сімейний родовід і BRAT1 мутації. Т1-зважений (b, c) і Т2-зважений (d) осьові зображення через базальні ганглії та Т1-зважені (e-g) сагітальні зображення. Прогресивна атрофія мозку та мозочка спостерігалася у пацієнта II-1, а легка атрофія та уповільнена мієлінізація білої речовини у пацієнта II-2. (h) Електроенцефалографія (ЕЕГ) у віці 1 дня показала типовий характер придушення-спалаху у пацієнта II-2. Гістопатологічні особливості контрольної жінки (i) та пацієнт II-2 (j, k). Контрольна самка народилася після 30 тижнів вагітності без асфіксії і постраждала від раптової смерті вдома у віці 3 місяців. Розтин виявив лише перивентрикулярну лейкомаляцію. (j) Кора головного мозку лобових часток продемонструвала значну втрату нейронів у шарах IV та V кори порівняно з контрольним випадком (i). Коркові нейрони не виявили ні дисгенезу, ні аномального накопичення речовини всередині. Пляма Клувер-Баррери. (k) Біла мозкова речовина лобової частки показала гліоз (позначений двонаправленою стрілкою) і відсутність мієлінізації. Імуногістохімічне забарвлення гліального фібрилярного кислого білка. Кожна смужка вказує на 500 мкм.
Справа II-2
Вона народилася після 39 тижнів вагітності без асфіксії як молодша сестра у випадку II-1. Її вага при народженні становила 2540 г (-1,40 с.д.), зріст 45,5 см (-1,84 с. Д.) Та HC 32 см (-0,93 с. Д.). М'язовий гіпертонус, генералізовані міоклонічні напади та часткові клонічні судоми, погані довільні рухи та дисморфічні особливості, включаючи двобічний еквіноварус таліпес, кругле обличчя, тонку губу та великі вуха спостерігалися незабаром після народження. Також спостерігалися перебільшені глибоко-сухожильні рефлекси та рефлекс Бабінського. Дратівливість та міоклонія кінцівок легко викликалися стимуляцією. Хромосомний аналіз та лабораторне обстеження не виявили відхилень.
Під час її клінічного перебігу різні судоми складалися з міоклонічних, клонічних та тонічних нападів, які погіршувались фенітоїном. Напади апное збільшились на 53 день, які були купіровані зонісамидом. Магнітно-резонансна томографія головного мозку через 3 місяці показала легку церебральну та мозочкову атрофію та затримку мієлінізації мозкової білої речовини (малюнки 1d та g). Початкова електроенцефалографія на другий день народження показала характер придушення-спалаху (рисунок 1h). Атрофія зорового нерва була виявлена за допомогою фундускопії. Вона не отримала жодних етапів розвитку, навіть не проковтнувши власну слину, після чого померла від пневмонії у віці 3 місяців. Вага та HC складали 4884 г (-1,6 с.д.) та 35 см (-3,8 с.д.) відповідно. Було проведено розтин.
Невропатологічні знахідки випадку II-2
Вага мозку становила 321 г, набагато менше, ніж контрольний мозок, відповідний за віком (718 г). Мозочок був пропорційно невеликий. Кісткового дисгенезу не спостерігалося, проте нейрони кори були помірно виснажені. Залишилися нейрони не показали накопичення речовини всередині (малюнки 1і та j). Вся біла речовина головного мозку демонструвала помірний гліоз та відсутність мієлінізації у лобовій частці (рис. 1к). Помірне виснаження клітин Пуркіньє та деякі дендритні розширення спостерігалися в корковому шарі мозочка. Нейрони зубчастого ядра також виснажились. Не було виявлено кальцифікації в хвостатій та глобусовій палиді, але крихітний мікрогліальний вузлик у таламусі. Специфічних втрат нейронів в області гіпокампа не спостерігалося. Нейронні клітини стовбура мозку, включаючи ядра понтію та ядра оліварії, були збережені відносно. Мієлінізація стовбура мозку та спинного мозку була розвинена добре.
Результати і обговорення
Геномна ДНК тканин печінки випадку II-2 була захоплена за допомогою набору SureSelect Human All Exon v5 (Agilent Technologies, Санта-Клара, Каліфорнія, США) та секвентована на HiSeq2000 (Illumina, Сан-Дієго, Каліфорнія, США) зі 101 bp парне читання. Обробка даних Exome була виконана, як описано раніше. 5 Дані про покриття та фільтрація варіантів наведені в додатковій таблиці S1. Серед 19 генів, що мають два гетерозиготних варіанти (можливі складені гетерозиготні мутації) або гомозиготну мутацію на основі автосомно-рецесивної моделі, ми виявили дві мутації в BRAT1. Складова гетерозиготність двох мутацій була підтверджена секвенуванням Сангера: c.176T> C (p.Leu59Pro) та c.962_963del (p.Leu321Profs * 81) передані від її батька та матері, відповідно. Ці дві мутації не були знайдені в екзомах ESP6500 або в наших 575 контрольних екзомах. Мутацію p.Leu59Pro прогнозували як пошкоджувальну шляхом сортування нетерпимого від толерантного (SIFT), PolyPhen2 та MutationTaster (Додаткова таблиця S2). Всі експериментальні протоколи, що використовувались, були схвалені Інституційною комісією з медичного факультету університету міста Йокогама.
Схематичне зображення BRAT1 мутації. Білок BRAT1 складається з 821 амінокислотних залишків з одним CIDE-N (N-кінцем клітинної DFF45-подібної ефекторної ефекторної) домену та двома HEAT (Huntingtin, фактор подовження 3, субодиниця білкової фосфатази 2A та TOR1) повторити домени. 2 Leu59 знаходиться в межах домену CIDE-N і є відносно консервативним серед хребетних, оскільки в цьому положенні видно лише подібні хімічно амінокислоти. Багато амінокислотних послідовностей білків BRAT1/Brat1 вирівнювали за допомогою веб-сайту CLUSTALW. Дві раніше зареєстровані мутації показані над BRAT1, а дві мутації, виявлені в цьому дослідженні, нижче білка.
На закінчення ми опишемо двох японських дівчат із синдромом Отахари, які мають сполуку гетерозиготних BRAT1 мутації. Наш звіт пропонує, що регулювання апоптозу за допомогою BRAT1 може бути важливим для нормального розвитку мозку.
Список літератури
Aglipay J. A., Martin S. A., Tawara H., Lee S. W., Ouchi T. Активація ATM іонізуючим випромінюванням вимагає BACA1, пов’язаного з BRCA1. Дж. Біол. Хім. 281, 9710–9718 (2006).
Ouchi M., Ouchi T. Регулювання фосфорилювання ATM/DNA-PKcs за допомогою BRCA1-асоційованого BAAT1. Гени Рак 1, 1211–1214 (2010).
Сондерс К. Дж., Міллер Н. А., Соден С. Е., Дінвідді Д. Л., Нолл А., Алнаді Н. А. та ін. Швидке секвенування цілого геному для діагностики генетичних захворювань у відділеннях інтенсивної терапії новонароджених. Наук. Переклад Мед. 4, 154ra135 (2012).
Puffenberger E. G., Jinks R. N., Sougnez C., Cibulskis K., Willert R. A., Achilly N. P. та ін. Генетичне картографування та секвенування екзомів визначають варіанти, пов’язані з п’ятьма новими захворюваннями. PLOS ONE 7, e28936 (2012).
Сайцу Х., Нісімура Т., Мурамацу К., Кодера Х., Кумада С., Сугай К. та ін. Мутації De novo в гені аутофагії WDR45 викликають статичну енцефалопатію дитячого віку з нейродегенерацією в зрілому віці. Нат. Genet. 45, 445–449 (2013).
Луговської А. А., Чжоу П., Чоу Дж. Дж., Маккарті Дж. С., Лі П., Вагнер Г. Структура розчину домену CIDE-N CIDE-B та модель взаємодій CIDE-N/CIDE-N у шляху фрагментації ДНК апоптозу. Клітинка 99, 747–755 (1999).
Подяка
Ми хотіли б подякувати пацієнтці та її родині за участь у цьому дослідженні. Ми дякуємо Нобуко Ватанабе за технічну допомогу. Це дослідження підтримали: Міністерство охорони здоров'я, праці та соціального забезпечення Японії; Японське товариство сприяння науці (грант для наукових досліджень (B) (25293085, 25293235), грант для складних пошукових досліджень (26670505); грант для наукових досліджень (А) (13313587)); Науковий фонд "Такеда"; фонд для створення інноваційних центрів для програми передових міждисциплінарних досліджень у рамках проекту з розвитку інноваційних систем; Програма стратегічних досліджень наук про мозок (11105137); та грант на наукові дослідження в галузі інновацій (цикл транскрипції) від Міністерства освіти, культури, спорту, науки та технологій Японії (12024421).
Інформація про автора
Приналежності
Кафедра генетики людини, Вища школа медицини міського університету Йокогами, Йокогама, Японія
Хіротомо Сайцу, Йосінорі Цурусакі, Міцуко Накашіма, Норіко Міяке та Наомічі Мацумото
Неврологічний відділ дитячого медичного центру Канагава, Йокогама, Японія
Кафедра патології дитячого медичного центру Канагава, Йокогама, Японія
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Автори-кореспонденти
Декларації про етику
Конкуруючі інтереси
Автори не заявляють конфлікту інтересів.
Додаткова інформація
Додаткова інформація супроводжує статтю на веб-сайті Journal of Human Genetics
Додаткова інформація
Додаткові таблиці (DOC 42 кб)
Права та дозволи
Про цю статтю
Цитуйте цю статтю
Сайцу, Х., Ямасіта, С., Танака, Ю. та ін. З’єднаний гетерозиготний BRAT1 мутації викликають сімейний синдром Отахари з гіпертонусом та мікроцефалією. J Hum Genet 59, 687–690 (2014). https://doi.org/10.1038/jhg.2014.91
Отримано: 28 серпня 2014 року
Переглянуто: 13 вересня 2014 року
Прийнято: 17 вересня 2014 року
Опубліковано: 16 жовтня 2014 року
Дата випуску: грудень 2014 року
Подальше читання
Втрата неканонічних функцій KCC 2 сприяє апоптозу розвитку нейронів проекції кори
- Мартіна Маврович
- , Павло Уваров
- , Ерік Дельпір
- , Ласло Вуцькіц
- , Кай Кайла
- & Мартін Пускарйов
Звіти EMBO (2020)
Новий патогенний варіант гена BRAT1 викликає ригідність та мультифокальний синдром судом, летальний для новонароджених
- Азам Пурахмадіян
- , Мортеза Хайдарі
- , Хоссейн Шояалдіні Ардакані
- , Шахаб Нуріан
- & Шахрам Савад
Міжнародний журнал неврології (2020)
Енцефалопатія BRAT 1: рецесивна причина епілепсії грудного віку з мігруючими вогнищевими нападами
- Інгрід Е С Шеффер
- , Катя Е Бойсен
- , Емі Л. Шнайдер
- , Кендіс Т Майерс
- , Мікеле Д Мехаффі
- , Анна М Рохтус
- , Юет-Пінг Юен
- , Габріель М Ронен
- , Вай Км Чак
- , Діпак Гілл
- , Аннапурна Подурі
- & Хізер С Меффорд
Медицина розвитку та дитяча неврологія (2020)
Епілепсія грудного віку з мігруючими вогнищевими нападами або ригідністю та мультифокальним синдромом нападів, летальний неонатальний? Різні акценти на важкому фенотипі
Медицина розвитку та дитяча неврологія (2020)
- Чи викликає норваск випадання волосся; Центр клінічної генетики та геноміки
- Фітосома Greenselect для прикордонного метаболічного синдрому
- Чи викликає соєве молоко збільшення ваги або допомагає схуднути?
- Чи важка атлетика спричиняє форму розширення вен
- Чи викликає Золофт (сертралін) збільшення ваги