Синдром Кушинга в педіатрії
Костянтин А. Стратакіс
розділ з ендокринології та генетики, Програма розвитку ендокринології та генетики, Юніс Кеннеді Шрайвер, Національний інститут здоров'я дитини та розвитку людини, Національний інститут охорони здоров'я, Бетесда, MD 20892–1862, США
b Програма навчальної програми з дитячої ендокринології, Національний інститут охорони здоров’я дитини та розвитку людини, Національний інститут охорони здоров’я, корпус 10, CRC, кімната 1–3330 East Laboratories, 10 Center Drive, Бетесда, MD 20892, США
Анотація
Кортикотропін (АКТГ) -вивільняючий гормон (CRH) синтезується в гіпоталамусі і переноситься до передньої частини гіпофіза в портальній системі. CRH стимулює вивільнення АКТГ з передньої частини гіпофіза, що, в свою чергу, стимулює кору надниркових залоз виділяти кортизол (вісь гіпоталамус-гіпофіз-наднирники або HPA). 1–4 Кортизол пригнічує синтез і секрецію як CRH, так і ACTH у системі регуляції негативного зворотного зв’язку. При синдромі Кушинга вісь HPA втратила здатність до саморегуляції через надмірну секрецію АКТГ або кортизолу та втрату функції негативного зворотного зв'язку. Діагностичні тести, навпаки, використовують перевагу жорсткої регуляції осі HPA в нормальному стані та її порушення при синдромі Кушинга для спрямування терапії на основну причину цього розладу.
Епідеміологія та етіологія
Клінічна презентація
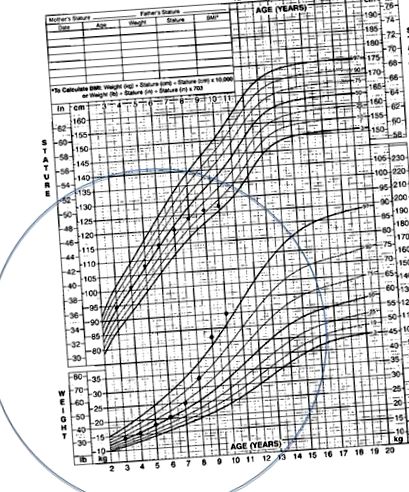
У більшості дітей початок синдрому Кушинга підступний. 1,3,4,14 Найбільш поширеним симптомом є збільшення ваги; у дитячому віці відсутність збільшення зросту, що відповідає збільшенню ваги, є найпоширенішим явищем синдрому Кушинга. Типова діаграма росту для дитини з синдромом Кушинга показана на рис. 1. Інші поширені проблеми, про які повідомляють діти, включають повноцінність обличчя, головні болі, гіпертонію, гірсутизм, аменорею та затримку статевого розвитку. У дітей статевого дозрівання може спостерігатися вірилізація. Шкірні прояви, включаючи вугрі, фіолетові стрії, синці та акантоз нігріканс, також є частими явищами. 2 Порівняно з дорослими пацієнтами із синдромом Кушинга, симптоми, які рідше спостерігаються у дітей, включають порушення сну, м’язову слабкість та проблеми з пам’яттю.
Типова діаграма зростання для пацієнта з синдромом Кушинга.
Діагностичні вказівки
Відповідні терапевтичні втручання при синдромі Кушинга залежать від точного діагнозу та класифікації захворювання. Історія хвороби та клінічна оцінка, включаючи огляд даних про зростання, важливі для постановки початкового діагнозу синдрому Кушинга. При підозрі на синдром Кушинга необхідні лабораторні та візуалізаційні підтвердження. Алгоритм діагностичного процесу представлений на рис. 2 .
Діагностичний алгоритм при синдромі Кушинга.
Першим кроком у діагностиці синдрому Кушинга є документування гіперкортицизму, 15,16, який зазвичай робиться в амбулаторних умовах. Через циркадну природу кортизолу та АКТГ, вимірювання ізольованого кортизолу та АКТГ не мають великого значення для діагностики. Одним чудовим скринінговим тестом на гіперкортицизм є цілодобова екскреція вільного кортизолу (UFC) із сечею (з поправкою на площу поверхні тіла). Однак часто важко надійно отримати цілодобовий збір сечі в амбулаторних умовах, особливо у педіатричної популяції. Помилково високий UFC може бути отриманий через фізичний та емоційний стрес, хронічне та важке ожиріння, вагітність, хронічні фізичні навантаження, депресію, поганий контроль діабету, алкоголізм, анорексію, наркотичну абстиненцію, тривогу, недоїдання та велике споживання води. Ці умови можуть спричинити досить високі UFC, щоб викликати так званий синдром псевдо-Кушинга. З іншого боку, хибно низький коефіцієнт UFC може бути отриманий здебільшого за неналежного збору.
Лікування
Вибір методу лікування доброякісних пухлин надниркових залоз - хірургічна резекція. Цю процедуру можна зробити як за допомогою очеревинного, так і заочеревинного підходів. Крім того, лапароскопічна адреналектомія також доступна у багатьох закладах. Карциноми надниркових залоз також можуть бути резековані хірургічним шляхом, якщо не на пізніх стадіях. Поодинокі метастази слід видалити, якщо це можливо. 26 Терапія мітотаном, який є адреноцитолітичним агентом, може застосовуватися як допоміжна терапія або у випадку неоперабельної пухлини. Інші хіміотерапевтичні варіанти включають цисплатин, 5-флоурурацил, сурамін, доксорубіцин та етопозид. Іноді для корекції гіперкортицизму необхідні антагоністи глюкокортикоїдів та інгібітори синтезу стероїдів. Радіотерапія також може застосовуватися у випадку метастазів. Прогноз карциноми надниркових залоз поганий, але зазвичай у дітей прогноз кращий, ніж у дорослих.
Двостороння тотальна адреналектомія, як правило, є методом лікування при двосторонніх мікронодулярних або макронудулярних захворюваннях надниркових залоз, таких як PPNAD та MMAD. Крім того, адреналектомія може розглядатися як лікування пацієнтів із хворобою Кушинга або позаматковим АКТГ-залежним синдромом Кушинга, яким або не вдалося виконати операцію або променеву терапію, або пухлина не була локалізована відповідно. Синдром Нельсона, який включає підвищену пігментацію, підвищений рівень АКТГ та зростаючу пухлину гіпофіза, що продукує АКТГ, може розвинутися у приблизно 15% пацієнтів із хворобою Кушинга, які лікуються двосторонньою адреналектомією. Можливо, діти з нелікованою хворобою Кушинга особливо вразливі до синдрому Нельсона після двобічної адреналектомії.
Фармакотерапія є варіантом у випадку невдалої операції при хворобі Кушинга або при позаматкової секреції АКТГ, коли джерело неможливо визначити. Мітотан пригнічує біосинтез кортикостероїдів, блокуючи дію ферментів розщеплення бічного ланцюга 11-β-гідроксилази та холестерину. Він також діє, руйнуючи адренокортикальні клітини, які виділяють кортизол. Інші інгібітори ферментів надниркових залоз, такі як аміноглютетимід, метирапон, трилостан та кетоконазол, також можуть застосовуватися окремо або в комбінаціях для контролю гіперкортицизму. Аміноглутетимід блокує перетворення холестерину в прегненолон у корі надниркових залоз, інгібуючи синтез кортизолу, альдостерону та андрогенів. Метирапон діє, запобігаючи перетворенню 11-дезоксикортизолу в кортизол. Це також може спричинити гіпертонію, вторинну внаслідок накопичення 11-дезоксикортикостерону. Трилостан пригнічує перетворення прегненолона в прогестерон. Кетоконазол є агентом, який впливає на багато етапів шляху та чудово блокує стероїдогенез надниркових залоз.
При позаматковій продукції АКТГ, якщо можна визначити джерело секреції АКТГ, то вибором лікування є хірургічна резекція пухлини. Якщо хірургічна резекція неможлива або якщо джерело АКТГ неможливо визначити, тоді фармакотерапія вказується, як було обговорено раніше. Якщо пухлина не може бути локалізована, повторні пошуки пухлини слід проводити принаймні щороку. Двостороння адреналектомія повинна виконуватися у випадку невдалого проведення фармакотерапії або неможливості локалізації пухлини через багато років.
Заміна глюкокортикоїдів
Після завершення успішного TSS при хворобі Кушинга або висічення автономно функціонуючої аденоми надниркових залоз настане період недостатності надниркових залоз, поки вісь надниркових залоз гіпоталамусу гіпофіза відновлюється. Протягом цього періоду глюкокортикоїди слід замінювати у запропонованій фізіологічній дозі заміщення (12–15 мг/м 2/день 2 або 3 рази на день), як ми нещодавно публікували. 27 У найближчий післяопераційний період слід розпочати введення стресових доз кортизолу. Їх слід відлучити порівняно швидко до фізіологічної замісної дози; слід спостерігати за пацієнтом кожні кілька місяців, а функцію надниркових залоз періодично оцінювати за допомогою 1-годинного тесту АКТГ (нормальна відповідь - рівень кортизолу понад 18 мкг/дл через 30 або 60 хвилин після стимуляції АКТГ).
Пацієнти після односторонньої адреналектомії для однієї адренокортикальної пухлини потребують такої ж заміни та режиму, як і пацієнти з хворобою Кушинга після ТСС. Після двосторонньої адреналектомії пацієнти потребують довічної заміни як глюкокортикоїдами (як описано раніше), так і мінералокортикоїдами (флудрокортизон 0,1–0,3 мг на добу). Цим пацієнтам також потрібні стресові дози глюкокортикоїдів відразу після операції; їх відносно швидко відлучають від фізіологічного заміщення. Крім того, дозування стресу при гострих захворюваннях, травмах або хірургічних втручаннях необхідне як для тимчасової, так і для постійної недостатності надниркових залоз.
Психосоціальні наслідки
Синдром Кушинга асоціюється з численними психічними та психологічними розладами, найчастіше емоційною лабільністю, депресією та/або тривогою. Інші відхилення включали манію, панічний розлад, суїцидальні наміри, шизофренію, нав'язливо-компульсивну симптоматику, психоз, порушення самооцінки та спотворений образ тіла. Значна психопатологія може залишатися навіть після ремісії гіперкортицизму і навіть після відновлення осі HPA. До 70% пацієнтів матимуть суттєві поліпшення психічних симптомів поступово після корекції гіперкортицизму. Автор та його колеги нещодавно повідомили, що у дітей із синдромом Кушинга через 1 рік після хірургічного лікування може спостерігатися зниження когнітивних та шкільних показників без будь-якої пов'язаної психопатології. 28 Нещодавно ми повідомляли, що активний синдром Кушинга, особливо у дітей молодшого віку, був пов'язаний з низькими фізичними та психосоціальними показниками, і що, незважаючи на покращення від раніше до 1 року після лікування, залишкові порушення залишаються у фізичній функції та оцінці рольово-емоційного впливу. Хоча більшість симптомів синдрому Кушинга, про які повідомляли самі, демонстрували покращення, забудькуватість, незрозумілість мислення та зменшення тривалості уваги після лікування не покращувались. 29
Ключові моменти
Синдром Кушинга в дитячому віці в основному обумовлений екзогенним введенням глюкокортикоїдів; ендогенний синдром Кушинга - рідкісне захворювання.
Бар'єрами для оптимального догляду за дитячим пацієнтом із синдромом Кушинга є: неправильне дотримання належної послідовності тестування для діагностики цього захворювання, що походить від нерозуміння патофізіології осі гіпоталамус-гіпофіз-наднирники; відсутність доступу до належного (тобто досвідченого, найсучаснішого) хірургічного лікування; та недоступність добре переносимих та ефективних ліків для контролю гіперкортизолемії.
Подяка
Ця робота була завершена за підтримки Внутрішньої програми Національного інституту здоров'я дітей та розвитку людини Юніс Кеннеді Шрайвер, Національний інститут охорони здоров'я, Бетесда, MD 20892-1862.
- Кушинг; s синдром
- Ендогенний синдром Кушинга із скоростиглим статевим дозріванням у 8-річного хлопчика через великий
- Синдром Кушинга у дітей Кедри-Сінай
- СИНДРОМ ФРЕГОЛІ PharmaTutor
- Дієтичні зміни вирішують багато симптомів синдрому Аспергера WebWire