Серотонін активізує загальне харчування шляхом активації двох окремих нервових шляхів у Caenorhabditis elegans
Пісня Бо-мі
1 Відділ молекулярної біології Південно-західного медичного центру Техаського університету, Даллас, Техас 75390-9148, та
Леон Евері
2 Кафедра фізіології та біофізики Університету Співдружності штату Вірджинія, Річмонд, Вірджинія 23298-0551
Вклад автора: Б.-м.С. розроблені дослідження; Б.-м.С. виконані дослідження; L.A. внесли неопубліковані реагенти/аналітичні інструменти; Б.-м.С. та Л.А. проаналізували дані; Б.-м.С. і Л.А. написав роботу.
Анотація
Вступ
Зростаюча епідемія ожиріння та розладів харчування вимагає вивчення регуляторних механізмів прийому їжі. Споживання їжі регулюється різними екологічними та внутрішніми показниками, такими як сенсорні фактори, стан харчування, переробка емоцій, прийняття рішень та навчання (Berthoud, 2004; Zheng and Berthoud, 2008). Вивчення мутантів, споживання їжі яких змінюється за різних умов, значно покращило наше розуміння регуляторних механізмів (Barsh and Schwartz, 2002).
Caenorhabditis elegans, бактеріоїдний аскарида, є привабливим модельним організмом для вивчення регулювання споживання їжі. Генетична маніпуляція проста, а анатомія проста (Шафер, 2005). Поведінка годування у C. elegans була добре охарактеризована і піддається кількісному аналізу. Більше того, молекули, які контролюють споживання їжі, також принаймні частково зберігаються у C. elegans (Douglas et al., 2005; You et al., 2008; Kaun and Sokolowski, 2009).
Зів, нервово-м’язова трубка, є органом живлення C. elegans. Глотка складається з восьми м’язів і 20 нейронів 14 типів. П'ять великих глоткових м'язів з'єднані щілинними з'єднаннями і складають три функціональні частини глотки, корпус, перешийк і кінцеву цибулину, які розташовані спереду назад (див. Рис. 5) (Albertson and Thomson, 1976) . Тіло приймає їжу з навколишнього середовища і накопичує їжу в передньому перешийку шляхом її скорочення та подальшого розслаблення. Накопичена їжа транспортується до кінцевої цибулини перистальтичним рухом заднього перешийка. Подрібнювач в кінцевій колбі подрібнює їжу для всмоктування поживних речовин у кишечнику. М’язи глотки демонструють два рухи годування, накачування та перистальтику перешийка (ІП). Накачування - це синхронізоване скорочення та подальше розслаблення тіла, переднього перешийка та кінцевої цибулини (див. Рис. 5 А). Перистальтика перешийка - це перистальтичний рух заднього перешийка (див. Рис. 5 Б).
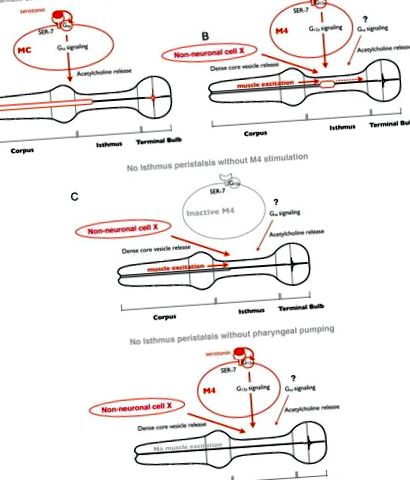
Модель регуляції годування серотоніном. A, У відповідь на серотонін SER-7 у клітині MC автономно активує свій сигнальний шлях Gsα, що згодом стимулює нагнітання глотки, активуючи холінергічну передачу від MC до м’язів глотки. B, У відповідь на серотонін SER-7 в M4 (і, можливо, в M2) активує свої подальші шляхи G12α в клітинному режимі, що згодом активує M4. Стимул від активного M4, поряд з вивільненням щільних серцевинних ядер, керованих невстановленим шляхом, активує перистальтику перешийка. Сигнальний шлях Gsα та холінергічна передача вниз за течією також сприяють активації перистальтики перешийка, але місця їх дії не охарактеризовані. З огляду на те, що експресія SER-7 у M4 повністю відновленої швидкості перистальтики перешийка у нульовому мутанті ser-7, цілком ймовірно, що вивільнення щільних ядерних пухирців з неідентифікованих клітин є конститутивно активним, а не ініційованим серотоніном. C., Стимули активного нейрону М4 та передньої частини глотки, збуджені насосом, необхідні для активації перистальтики перешийка. За відсутності будь-якого стимулу перистальтика перешийка не виникає.
Як і інші тварини, C. elegans активізує прийом їжі, активізуючи рухи годування у відповідь на їжу (бактерії) (Croll, 1978). Серед 14 типів глоткових нейронів лише МС та М4 є важливими для нормальної швидкої перекачки та для перистальтики перешийка відповідно (Avery та Horvitz, 1987, 1989). Однак механізми, за допомогою яких нейрони глотки активізують живлення у відповідь на бактерії, невідомі. Тут ми спробували зрозуміти механізми, вивчаючи процес, за допомогою якого серотонін активує годування, з наступних причин: По-перше, серотонін - це передбачуваний харчовий сигнал, який контролює годування у C. elegans. Серотонін імітує вплив їжі при контролі множинної поведінки, включаючи активацію нагнітання глотки (PP) (Horvitz et al., 1982). Серотонін збільшує нагнітання глотки у відповідь на бактерії (Sze et al., 2000). По-друге, серотонін активує накачування через 5-HT тип 7 рецептора SER-7, який експресується в безлічі глоткових нейронів, включаючи MC і M4 (Hobson et al., 2006). Насправді для активації накачування серотоніну потрібна холінергічна передача від МС до м’язів глотки (Raizen et al., 1995). Крім того, експресія SER-7 у M4 підвищує ймовірність того, що серотонін також активує перистальтику перешийка.
Матеріали і методи
Загальні методи та штами
За винятком випадків, коли зазначено інше, C. elegans культивували при 19 ° C, як описано Brenner (1974). Усі використані черв’яки були гермафродітами. Тільки в основному тексті показано назву гена. Були використані наступні мутантні алелі.
Нульові мутації.
Нульові мутації були такими: mod-1 (ok103) V, ser-4 (ok512) I, ser-1 (ok512) III, ser-7 (tm1325) X, eat-2 (ad465) II, gsa-1 ( pk75) I, acy-1 (pk1279) III, gpa-12 (pk322) X, dgk-1 (sy428) X, pkc-1 (nj3) V, unc-13 (s69), unc-31 (e928), tph-1 (мг280).
Гіпоморфні мутації.
Гіпоморфні мутації були такими: kin-2 (ce179) X, cha-1 (p1152) IV.
Мутації посилення функції.
Мутації посилення функції були такими: gsa-1 (ce81gf) I, acy-1 (ce2gf) III, HS: gsa-1 (Q227L), punc-17: gpa-12 (Q205L), punc- 17: rho-1 (G14V), punc-17: pkc-1B (A160E).
Аналіз медикаментозного лікування та годування
Аналіз годівлі бактерій
Молекулярна біологія та побудова трансгенних штамів
Відеоаналіз та статистичне тестування
Тестування впливу на перистальтику перешийка ускладнюється тим фактом, що більшість методів лікування, що впливають на перистальтику перешийка, також впливають на накачування, а перистальтика перешийка нелінійно залежить від накачування. Отже, для порівняння показників перистальтики перешийка в двох наборах даних ми вимагали, щоб швидкості перекачування в цих наборах даних перекривались, а потім запитали, чи відрізняється перистальтика перешийка між наборами даних з однаковою швидкістю накачування. На друге запитання відповіли шляхом підбору парабол до даних. Обидва набори даних одночасно відповідали такій моделі:
xi та yi - швидкість накачування та перистальтики перешийка для хробака i, Di - індикаторна (фіктивна) змінна, яка дорівнює 0, якщо черв'як i є в наборі даних 1 та 1, якщо черв'як i є в наборі даних 2, а a, b, c та d - параметри підгонки. Якщо перистальтика перешийка відрізняється між двома наборами даних, (c, d) буде відрізнятися від (0, 0). Це було перевірено шляхом обчислення статистики F наступним чином:
де c, d - оцінки найменших квадратів c і d; σc, σd і ρ - оцінки SE з c, SE з d і кореляції між c і d від лінійної регресії; і n1, n2 - кількість точок у наборах даних 1 і 2.
Рівень значущості - це імовірність верхнього хвоста стандартного розподілу F з 2 і n1 + n2 - 2 df. [Оскільки c та d мають квадрат в обчисленні F, будь-яке відхилення від (0, 0) дає позитивне F, тому це однобічний тест.]
Презентація даних
Результати
Перистальтика перешийка з'єднана з попереднім глотковим насосом
Серотоніновий рецептор SER-7 окремо активує два рухи харчування, головним чином, активуючи нейрони глотки MC і M4
Ми запитали, який рецептор опосередковує серотоніновий ефект, досліджуючи норми подачі нульових мутантів рецепторів серотоніну у відповідь на серотонін. Серед п'яти нульових мутантів рецепторів серотоніну лише мутант ser-7 не зміг швидко прокачатись у присутності серотоніну (рис. 1 G; дані не показані; t (197) = 8,4, p рис. 1 G) та інших мутантів рецепторів серотоніну мала незначну або зовсім не змінювала швидкість перистальтики перешийка у відповідь на серотонін (дані не наведені). Щоб дізнатись, чи впливає SER-7 на перешийок перешийка, ми порівняли gsa-1 (gf) та gsa-1 (gf); мутантні тварини сер-7. gsa-1 кодує Gsα. Мутації посилення функції gsa-1 було достатньо для активації накачування, навіть за відсутності SER-7 (рис. 1 H, 2 2 B). Хоча gsa-1 (gf) і gsa-1 (gf); ser-7 відкачували з однаковою швидкістю у присутності серотоніну, швидкість перистальтики перешийка була нижчою при gsa-1 (gf); ser-7, ніж у gsa-1 (gf) (рис. 1 H; F (2,49) = 10,7, p = 0,0001). Ці результати дозволяють припустити, що передача сигналу серотоніну через SER-7 активує обидва рухи харчування, а серотонін активує перистальтику перешийка окремо від нагнітання глотки.
Клітина SER-7 автономно активує нагнітання глотки за допомогою сигналів Gsα
SER-7 є рецептором серотоніну типу 7 (5-HT7). Рецептор 5-HT7 - це рецептор, пов'язаний з G-білком, який, як вважають, пов'язаний з Gsα та G12α (Kvachnina et al., 2005). На користь гіпотези про те, що передача сигналів Gsα знаходиться нижче за SER-7, гетерологічна експресія кДНК ser-7 підвищувала внутрішньоклітинний рівень cAMP (Hobson et al., 2003), що свідчить про активну передачу сигналів Gsα. Таким чином, ми припустили, що активний SER-7 в MC і M4 збільшує швидкість подачі, активуючи сигнальні шляхи Gsα та G12α.
Потім ми перевірили, чи активізує передача сигналу G12α перистальтику перешийка за раніше повідомленим шляхом (рис. 3 А). Хайлі та співавт. (2006) та McMullan et al. (2006) повідомили, що одна роль RHO-1 полягає в активації нейромедіації нижче за течією G12α шляхом безпосереднього зв'язування та інгібування DGK-1 у C. elegans (Hiley et al., 2006; McMullan et al., 2006). Ми перевірили, чи збільшує RHO-1 перистальтику перешийка за тим же механізмом, перевіряючи, чи F25N, мутація RHO-1, яка порушує домен, необхідний для інгібування DGK-1, блокує збільшення перистальтики перешийка, спричинене G14V ставка. Дійсно, punc-17: RHO-1 (G14VF25N) не зміг збільшити перистальтику перешийка (рис. 3 С). Крім того, нульова мутація dgk-1 відновила швидкість перистальтики перешийка у трансгенних, що експресують punc-17: RHO-1 (G14VF25N), до швидкості трансгенних, що експресують punc-17: RHO-1 (G14V) (рис. 3 G; швидкість перистальтики перешийка у трансгенних тварин [punc-17: RHO-1 (G14V)] та dgk-1; [punc-17: RHO-1 (G14VF25N)] становила 37,8 ± 2,0 та 41,4 ± 3,5, відповідно), припускаючи, що RHO-1 активує перистальтику перешийка, інгібуючи DGK-1.
Нарешті, ми перевірили, чи SER-7 у М4 активує перистальтику перешийка, активуючи передачу сигналів G12α автономно для клітин. Для цього ми запитали, чи експресія конститутивно активного GPA-12 або RHO-1 у М4 відновлює перистальтику перешийоку, стимульовану серотоніном, у gsa-1 (gf); мутантні тварини ser-7 (tm1325). На підтвердження нашої гіпотези, експресія трансгенів принаймні частково відновила показники перистальтики перешийка (рис. 3 H; F (2,21) = 6,3, p = 0,007) (рис. 3 I; F (2,27) = 8,7, p = 0,001) (порівняння показників перистальтики перешийка між gsa-1 (gf); контроль ser-7 та gsa-1 (gf); ser-7; [pser-7b: rho-1 (G14V)] мутантні хробаки). Разом ці дані підтверджують гіпотезу про те, що SER-7 у M4 активує швидкість перистальтики перешийка, активуючи сигнальний шлях G12α в клітинному режимі.
Сигнальний шлях Gsα активує накачування через холінергічну передачу від МС до м’язів глотки
Обговорення
Наше відкриття, що серотонін активує MC і M4 за допомогою механізмів, що включають сигнальні шляхи Gsα та G12α, разом із попередніми дослідженнями (Reynolds et al., 2005; McMullan et al., 2006), свідчить про те, що механізм, за допомогою якого сигнальні шляхи G-білка збільшують нейронні активність широко зберігається у всій нервовій системі у C. elegans.
Ми також виявили, що, незважаючи на їх окрему нейрональну регуляцію, перистальтика перешийка була приєднана до попередньої помпи. Як пов'язані два рухи годування? Попереднє дослідження візуалізації кальцію повідомляло, що передня-задня кальцієва хвиля переміщається в задньому перешийку вибірково під час перистальтики перешийка (Shimozono et al., 2004), вказуючи на те, що хвиля кальцію диктує скорочення м'язів. Коли відбувається насос, електричний сигнал, який збуджує глоткові м’язи, викликаючи накачування, рухається від тіла до кінцевої цибулини (Raizen and Avery, 1994; Shimozono et al., 2004). Спостереження, що вбивство M4 призводить до відмови перистальтики перешийка (Avery і Horvitz, 1987), і що перистальтика вимагає накачування, свідчать про те, що індукція хвилі кальцію, що викликає перистальтику, вимагає як збудження м'язів під час накачування, так і стимуляції M4 (рис. ). Ця модель пояснює, як рухи подачі можна регулювати окремо, але поєднувати.
Можливо, глотка еволюціонувала для регулювання рухів годування таким чином, щоб підтримувати ефективне годування. Окреме регулювання двох швидкостей годування дозволяє глистам регулювати співвідношення перистальтику перешийка до нагнітання глотки (відношення ІР до РР) відповідно до щільності їжі. Коли їжі бракує, співвідношення ІР/РР зменшиться, оскільки глисти повинні приймати їжу якомога активніше, але їм не потрібно часто ковтати. Однак, коли їжі достатньо, це співвідношення збільшиться, оскільки глистам не потрібно так сильно працювати, щоб приймати їжу, але їм потрібно часто ковтати, щоб передня глотка не заповнилася. Насправді ми спостерігали, що середнє відношення ІР до РР має тенденцію бути вищим, коли глотка накачує повільно (рис. 1 D). Крім того, знайдені нами регулятори годівлі можна класифікувати на дві групи: Перша група, така як компоненти сигнальних шляхів Gsα або dgk-1, збільшує обидві швидкості годування при активації або гальмуванні. Друга група, така як gpa-12 (рис. 3 E, F), pkc-1 (дані не показані) та unc-31 (рис. 4 F), зменшила перистальтику перешийка, але збільшила нагнітання глотки при придушенні. Щоб відкоригувати співвідношення ІР до РР відповідно до щільності їжі, активність другої групи може бути вибірково придушена, коли їжі бракує.
З'єднання двох рухів годування також підтримує ефективне годування шляхом їх координації. Накопичена їжею їжа транспортується від переднього перешийка до м’ясорубки в кінцевій цибулині за допомогою перистальтики перешийка. Таким чином, перистальтика перешийка була б марною за відсутності перекачування, а зв’язування перистальтики перешийка з попереднім насосом може служити запобіганням таким марним рухам живлення.
Залишається відповісти на кілька цікавих питань. Наприклад, за допомогою яких механізмів визначається частота та час початку рухів подачі? Як один м’яз перешийоку демонструє два різні рухи годування? Подальші дослідження для відповіді на ці питання можуть допомогти нам зрозуміти, як нервова система та м’язи взаємодіють для складної регуляції м’язових рухів.
- Харчові добавки для поліпшення загального стану здоров'я та аеробних показників
- Виховання дітей-близнюків, які годують, сплять та багато іншого
- Швидке збільшення ваги та практика годування в перші 6 місяців життя пов’язані з дисбіозом
- Картки витрат на рецепти тримають окремі витрати на харчування та харчування
- Новий посібник з виживання котів Поради щодо годування PetCoach