Послідовність цілого геному визначає роман ABCB7 генна мутація Х-зчепленої вродженої мозочкової атаксії у великій родині монгольських предків
Предмети
Анотація
Вступ
Х-зчеплені вроджені мозочкові атаксії
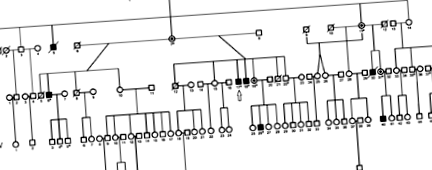
Генеалогія родини Бурят. Секвенування цілого геному проводили для пацієнта, позначеного стрілкою; суцільні символи позначають постраждалих людей; пунктирні кола - облігатні гетерозиготні самки-носії; відкриті символи - непостраждалі особи; нарізані символи - померлі предмети; зірочки - особини, яких використовували для генотипування. 6
Клінічний опис
Магнітно-резонансна томографія (МРТ) виявила гіпоплазію півкуль мозочка та вермісів у уражених чоловіків із бурятського родоводу. Загальними неврологічними симптомами для всіх постраждалих членів сім'ї були затримка розвитку, труднощі в мовленні та координації, атаксія кінцівок та тулуба та дизартрія (Додаткова таблиця 1). Обстежені пацієнти не мали можливості сидіти без опори будь-коли до 15-місячного віку або самостійно ходити до 7-річного віку та вимовляти свої перші слова до 4-річного віку. У більшості пацієнтів спостерігався ністагм, офтальмоплегія та посилення сухожильних рефлексів. У всіх пацієнтів з цього родоводу не було ознак пам’яті чи когнітивних порушень. 6
Особливостей сидеробластичної анемії або розладу міді не виявлено. Гематологічні дослідження, проведені для пацієнта (III-18) із Х-зчепленою атаксією з бурятського родоводу, не показали відхилень еритропоетичних клітин або скупчення гранул заліза. Значення гемоглобіну в середньому становили 149 г/л (нормальний діапазон - 130–180 г/л), кольоровий показник - в середньому 1,0 (нормальний діапазон - 0,80–1,05), тест седиментації еритроцитів становив у середньому 3 мм/год (діапазон норм - 0–15 мм/h) і кількість лейкоцитів в цілому була нормальною. Усі біохімічні тести були нормальними, за винятком дещо підвищеного рівня білірубіну, 14,5 мг/л (нормальний діапазон, 5–12 мг/л), а аналіз сечі був нічим не примітним. 6
Матеріали і методи
Зразки крові всіх випробовуваних збирали раніше за відповідної поінформованої згоди, і ці дані вже повідомлялись. 6 У родоводі не виявлено спорідненості (рис. 1). Геномна бібліотека була виготовлена із зразка ДНК 2 мкг пацієнта III-17 відповідно до протоколу для парного набору зразків ДНК (Illumina, San Diego, CA, USA). Високопродуктивне секвенування геному проводили на платформі Illumina HiSeq 2000 з мінімум 14-кратною глибиною охоплення геному GRCh37. Аналіз геному проводився за допомогою програмного забезпечення 'ngs-pipeline', розробленого нашою групою http://rogaevlab.ru/ngs-pipeline. Виявлені рідкісні варіанти були надіслані до NCBI ClinVar і доступні за адресою www.ncbi.nlm.nih.gov/clinvar/?LinkName=orgtrack_clinvar&from_uid=505407.
Батьківство визначали методом STR (короткий тандемний повтор) з використанням саморобних маркерів STR та системи PowerPlex 16 (Promega, Madison, WI, USA).
Результати
Послідовність цілого геному
Визначення варіантів в ABCB7 і ATP7A гени. Представлення геномної області, що містить мутації, за допомогою інструментів IGV (Integrative Genomics Viewer): (a) екзон 16 з ABCB7 ген (hg19 chrX: g.742734204C> T), (b) 41,4 кб видаленої області ATP7A ген (hg19 chrX: g.77190006_77231471del), включаючи екзон 2; вертикальні стрілки в (a) та (b) вказували хромосомні локуси для ABCB7 і ATP7A гени. (c) Перевірка послідовності мутацій кандидата в екзоні 16 з ABCB7 ген. (d) Схема праймерів для перевірки видалення в ATP7A ген. (e) Перевірка послідовності шляхом послідовності видалення Сангера у ATP7A ген у пацієнтів. (f) ПЛР-продукти з ATP7A область, видалена геном: М, ДНК сходи; R, вгору по течії "праворуч", фланкуючий область видалення; В, внутрішнє видалення регіону; L, нижче за течією лівий фланг із зоною делеції (R, In, L - продукти присутні, якщо делеція відсутня; Del - продукт присутній, якщо делеція є у зразку ДНК).
ABCB7 ген
Несинонімний варіант помилки hg19 chrX: g.74273420C> T в екзоні 16 (AF241887) з ABCB7 ген (Ідентифікатор гена: 22) призводить до заміщення гліцину на серин у положенні 682 білка-члена 7, що зв'язує АТФ, касети 7 (NP_001258625, UniProt O75027) (Фігури 2a та c). Оскільки ідентифікований варіант локалізований поблизу ділянки акцепторного сплайсингу в межах першого кодуючого триплета екзону 16, ми дослідили, чи може заміна призвести до утворення нового сильного місця сплайсингу. Біоінформаційні інструменти для тестування передбачуваних місць сплайсингу на основі частот нуклеотидів у кожному положенні ділянки (від -20 до +3) для конститутивних, касетних, внутрішніх акцепторів та зовнішніх акцепторів не передбачали змін сплайсингу для мутантного алелю 18, 19 (Додаткова таблиця 5).
Відомо кілька стенограм ABCB7 ген, що кодує ізоформи білка, і ідентифікований варіант впливає на всі передбачувані ізоформи білка. Структура та функція доменів білка ABCB7 до кінця не вивчені. Мутація розташована в нуклеотидно-зв'язуючому домені (NBD) білка ABCB7 (NP_001258625, UniProt O75027), і порушення цієї області в ортолозі дріжджів ATM1 призводить до втрати функції білка та накопичення заліза всередині мітохондрії (додатковий малюнок 3A) . 20 Ми вивчали структурні зміни в мутантному сериновому варіанті білка ABCB7, використовуючи програму біоінформатики Phyre2. 21 Порівняльний аналіз
1000 паралогічних та ортологічних амінокислотних послідовностей білків-транспортерів ABC надсімейства демонструє висококонсервований варіант гліцину в положенні 682 (рис. 3). Заміна серину призводить до обертання в нерухомому білковому боці. Були проведені додаткові біоінформаційні прогнози щодо цієї мутації. Мутантний варіант у ABCB7 ген оцінювали як шкідливий за допомогою SIFT 22 і, ймовірно, пошкоджуючий (0,996) за допомогою PolyPhen. 23 На сьогоднішній день в. Було виявлено ще чотири мутації ABCB7 ген, асоційований із сидеробластичною анемією та мозочковою атаксією (додатковий малюнок 3А).
Еволюційний аналіз області мутації. Мутація місенсу в ABCB7 та видалення в ATP7A гени змінюють амінокислотні послідовності, які високо зберігаються у хребетних. Рівень еволюційного збереження амінокислот ілюструється затіненням від білого для неконсервованого до темно-сірого для висококонсервативного. Вирівнювання були отримані з браузера UCSC Genome (Multiz Alignments of 100 позвоночних), 48 ClustalW. 49
АТФаза, Cu 2+ транспортуючий, альфа-поліпептид (ATP7A) ген
Мутації в ATP7A ген пов'язаний з дефіцитом міді/хворобою Менкеса (MD; OMIM: 309400), що характеризується важкою розумовою відсталістю, судомами, затримкою росту, переохолодженням, химерними або сталевими волоссям, в'ялістю шкіри та суглобів та смертю серед раннього віку. Більш легкий синдром потиличного рогу (OHS) також пов'язаний з мутаціями в ATP7A ген (OMIM: 304150). Проте жодна з клінічних особливостей цих захворювань не була виявлена у хворих Бурата, у яких відсутній другий екзон ATP7A ген. Ми припустили, що делеція може мати відносно помірний, якщо такий є, вплив на клінічний фенотип у цих пацієнтів, що не пов'язано з раніше описаними клінічними симптомами, пов'язаними з мутаціями в ATP7A ген.
PGAM4 ген
Генетична неоднорідність
Ми знайшли мутацію/видалення в ABCB7 і ATP7A гени у всіх чотирьох обстежених постраждалих родичів чоловічої статі цієї бурятської сім'ї з однаковим діагнозом та у чотирьох безсимптомних родичів самок із ураженими синами (Додаткова таблиця 6). Мутація/делеція була у гемізиготному стані у всіх обстежених уражених чоловіків, і у кожної жінки-носія вона була гетерозиготною. Всі четверо обстежених здорових чоловіків з одного походження мали гемізиготну форму на алелі дикого типу.
Далі ми протестували чотири непов’язані сім’ї пацієнтів з дуже подібними клінічними проявами та з діагнозом вроджена непрогресуюча атаксія, що спостерігається виключно у чоловіків (Додаткова таблиця 7). Аналіз усіх екзонів ABCB7 ген за допомогою прямого секвенування (додаткова таблиця 8) не виявив жодних відмінностей у порівнянні з людськими еталонними послідовностями генома. Подібним чином ми не виявили видалення екзону 2 з ATP7A ген і ретроген PGAM4 у постраждалих чоловіків у цих сім’ях. Генотипування цих сімейств для мутації NM_001001344.2: c.3321G> A (p.Gly1107Asp) у ATP2B3 ген, який раніше був описаний у випадках атаксії мозочка, 4 також не виявив різниці від референтного алелю дикого типу.
Обговорення
Спільною рисою непрогресивних атаксій є помітна затримка раннього рухового розвитку та порушення моторної координації протягом життя в результаті гіпоплазії/атрофії мозочка. Тут ми повідомляємо про нову мутацію в ABCB7 що є причинним фактором гіпоплазії/атрофії мозочка та непрогресуючої атаксії, таким чином ще більше розширюючи перелік мутацій у цьому гені, пов'язаних з атаксією мозочка. Раніше у. Було виявлено чотири різні мутації ABCB7 були пов’язані з патологією мозочка з сидеробластичною анемією. При сидеробластичній анемії залізо не включається в гемоглобін, оскільки воно необхідне для вироблення здорових еритроцитів у кістковому мозку. Однак чудовою особливістю нашого випадку є те, що у пацієнтів спостерігається непрогресуюча атаксія без класичних симптомів сидеробластичної анемії. Спокусливо припустити, що це пов’язано з унікальним розташуванням мутації в ABCB7. В якості альтернативи делеція N-кінцевої частини ATP7A може потенційно відігравати роль у модифікації генетичного фактора.
Білок ABCB7 складається з шести трансмембранних доменів та двох інтрамітохондріальних областей, що утворюють NBD (додатковий малюнок 3А). Він локалізується у внутрішній мембрані мітохондрій, а також на цитоплазматичній мембрані та в цитоплазмі. 30 ABCB7 відіграє важливу роль у дозріванні цитозольних та мітохондріальних кластерних білків Fe-S, впливаючи на функцію цитохрому c, NADH-дегідрогеназа (нікотинамід-аденин-динуклеотид, відновлена форма) та сукцинат-дегідрогеназа. Він бере участь у відновленні ДНК та відсіченні нуклеотидів, у відновленні окисних пошкоджень ДНК, у біогенезі рибосом та тіомодифікації тРНК. 31 Мутація білка ABCB7 у наших пацієнтів розташована в області, що звернена до внутрішнього мітохондріального простору. Усі інші мутації, описані на сьогоднішній день, викликаючи рефрактерну анемію та атаксію, локалізуються поблизу або в трансмембранних доменах. 20, 32, 33, 34, 35, 36 Як така, ця мутація може впливати на її активність або зв'язування з іншими ко-факторами, оскільки ABCB7 контролює транспорт мітохондріального заліза та зв'язування протопорфірину під час синтезу гемоглобіну. 20,32,33,36
Психічні та неврологічні симптоми різноманітні у пацієнтів з описаними мутаціями в ABCB7 ген. Депресія, зниження когнітивних функцій або інтелектуальні вади та навіть шизофренія були описані для деяких пацієнтів (Додаткова таблиця 9). Неврологічні прояви у постраждалих членів родини Бурят демонструють деякі спільні риси з ABCB7 мутація - пов'язані симптоми в інших випадках, таких як мозочкова атаксія, відсутність м'язової слабкості та дефіцит відчуттів (Додаткова таблиця 9). Як показала МРТ у справі сім’ї Бурят, атрофія мозку в основному була локалізована в півкулях мозочка та у вермі. Однак нам не вдалося виявити відхилення в інших регіонах, включаючи пон та мозковий мозок, показані в інших випадках. 34
15% хворих на МД. 39 Таким чином, спокусливо припустити, що у чоловіків, які несуть ATP7A видалення першого MBD, решта п'ять доменів, що зв'язують мідь, ефективно використовуються для збереження функції ATP7A.
Ми не можемо виключити, що дисфункція в ABCB7 і помірно модифікована активність ATP7A можуть взаємно вплинути на гомеостаз в деяких клітинах тканин, оскільки порушення ABCB7 може спричинити накопичення іонів заліза в мітохондріях, тоді як мутація транспортера ATP7A може вплинути на рівень іонів міді в клітинна цитоплазма. Дефіцит заліза збільшує експресію ATP7A 40 у кишківнику та рівень міді в мозку. 41 Відомо, що мідь регулює використання заліза в кістковому мозку та синтез гемоглобіну. 42, 43, 44, 45 Що важливо, обидва ABCB7 і ATP7A гени експресуються в кістковому мозку 26, 46 та у різних тканинах (Illumina Map of Body Body 2.0), 26, 46, 47 (додатковий малюнок 5). Враховуючи взаємний регуляторний вплив на поглинання міді та заліза, клінічний фенотип, описаний у пацієнтів з Бурят, може залежати від передбачуваної взаємодії генетичних дефектів у двох генах для MBP у деяких клітинах тканин, цікавий випадок синдрому, успадкованого як Х-зчеплений моногенна риса. Однак ми стверджуємо, що основна причина гіпоплазії мозочка та клінічний фенотип атаксії у цих пацієнтів зумовлена цією новою мутацією в ABCB7 ген.
- The; Жировий ген; Міф та що потрібно знати - Бізнес-новини Близький Схід BLME
- Сприйняття смаку гіркої їжі залежить від генів
- Ген, який може принести користь гігантам сумо The Japan Times
- ВІДЕО Цілий фермерський підхід до включення органічної птиці, вирощеної на пасовищах, та нових злаків
- Використання мережевих наукових інструментів для виявлення нових режимів харчування при неврології продромальної деменції