Розвантаження скелета пригнічує проліферацію in vitro і диференціювання остеопрогеніторних клітин щурів
Медичний центр управління ветеранів, Медичний факультет, Каліфорнійський університет, Сан-Франциско 94121; і
Медичний центр управління ветеранів, Медичний факультет, Каліфорнійський університет, Сан-Франциско 94121; і
Національний центр управління аеронавтики та космосу - Еймс, Моффетт-Філд, Каліфорнія 94035
Національний центр управління аеронавтики та космосу - Еймс, Моффетт-Філд, Каліфорнія 94035
Медичний центр управління ветеранів, Медичний факультет, Каліфорнійський університет, Сан-Франциско 94121; і
Анотація
мікрогравітація, пов'язана з космічними польотами, призводить до дефіциту кісткової маси у людей та тварин (15, 18). У щурів остеопенічна реакція на мікрогравітацію пов'язана зі зменшенням кількості остеобластів, зменшенням формування кісток та затримкою дозрівання кісток (4, 15). Подібні зміни можуть бути викликані на задніх кінцівках щурів підняттям задніх кінцівок (3, 4, 6, 7, 27). Хоча остеобласт, як видається, є головним посередником остеопенії в цих моделях, основний механізм пригнічення остеобластів незрозумілий. Розвантаження скелета може зменшити кількість остеопрогеніторних клітин або інгібувати їх проліферацію, як передбачається зменшенням кількості остеобластів у ненавантаженій кістці (7) та зменшенням проліферації культивованих остеобластів, виділених із нерозвантажених кісток (12, 27). Диференціація остеобластів також може бути пригнічена, як це передбачається пригніченням мінералізації та дозрівання ненавантаженої кістки (3, 6) та зміненою експресією генів, пов'язаних з диференціацією остеобластів у ненавантаженій кістці (4).
Протоколи тварин та обробка тканин.
Окремий експеримент був проведений для вивчення ефектів підняття задніх кінцівок на проліферацію BMSC та активність АР. Щури були підняті на задні кінцівки протягом 0 або 5 днів (n = 12/групу), а їх клітини великогомілкового мозку видаляли та об'єднували, утворюючи чотири незалежні пули клітин на групу, кожна з яких включала лівий та правий клітини великогомілкового мозку від трьох тварин. Клітини культивували в шестилункових планшетах, як описано нижче, протягом 28 днів для вивчення часового курсу проліферації та активності ферменту AP.
Методи клітинної культури.
Ізоляція РНК.
Через 10, 15, 20 і 28 днів культури загальну РНК виділяли з кожного пулу великогомілкової клітини за допомогою набору РНК Stat-60 (TelTest, Friendswood, TX). РНК розводили у воді, обробленій діетилпірокарбонатом, і концентрацію та чистоту оцінювали за допомогою спектрофотометра Uvikon (Research Instruments International, Сан-Дієго, Каліфорнія). РНК електрофорезували на 1% агарозному гелі SeaKem (FMC Bioproducts, Rockland, ME), що містить бромід етидію, і візуалізували під ультрафіолетовим (УФ) світлом для підтвердження її цілісності. Двадцять мікрограмів загальної РНК з кожного пулу були зворотно транскрибовані в кДНК за допомогою праймерів оліго (dT) та набору зворотної транскрипції GIBCO Superscript II (GIBCO).
Клонування шаблонів кДНК-конкурентів для QC-PCR.
QC-PCR.
Ген GAPDH використовували для контролю потенційних коливань ефективності зворотної транскрипції між різними пулами кДНК. Рівні GAPDH визначали в трьох примірниках для всіх пулів кДНК, а дані для c-fos, Потім експресія AP та гена остеокальцину нормалізувались до рівня GAPDH та виражали як нанограми на мікрограми GAPDH. Перед зворотною транскрипцією аликвоти РНК піддавали аналізу Норт-блот з використанням зонда GAPDH (дані не наведені). Цей аналіз продемонстрував, що на експресію гена GAPDH не впливали ні підняття задніх кінцівок, ні тривалість у культурі, і тому він був дійсним геном ведення домашнього господарства для контролю потенційних коливань ефективності зворотної транскрипції між 36 незалежними пулами кДНК.
Аналізи клітинної проліферації та активності АР.
Мінералізація in vitro.
Після 28-денного посіву 10-сантиметрові посуди, що містять стегнові BMSC, промивали сольовим розчином, забуференним фосфатом, і фіксували на 1 год 10% формаліном. Після промивання закріплених культур дистильованою водою їх фарбували протягом 5 хв 1% червоним алізарином у 2% етанолі, щоб виявити мінерал. Потім культури п’ять разів промивали дистильованою водою для видалення слабо зв’язаних плям. Отримані забарвлені бульбочки були занадто численні, щоб точно визначити кількісні показники, тому пляма солюбілізували протягом 30 хв при кімнатній температурі з 0,5 N HCl-5% додецилсульфатом натрію (SDS). Розчинену пляму видаляли з пластин, а поглинання вимірювали на спектрофотометрі при 415 нм. Для кожної тварини аналізували та усереднювали п’ять повторюваних 10-сантиметрових блюд, а середні значення для шести тварин усереднювали для кожної групи. Попередні експерименти продемонстрували, що поглинання лінійно пов'язане з кількістю елюйованого червоного азазарину в межах діапазону, виміряного в цих експериментах.
Статистичний аналіз.
Відмінності між піднятими на задні кінцівки та нормально навантаженими тваринами визначали за допомогою двостороннього дисперсійного аналізу (ANOVA) за допомогою SigmaStat (Jandel Scientific Software, Сан-Рафаель, Каліфорнія).
П'ять днів підняття задніх кінцівок призвели до значного зменшення маси жиру стегнової кістки (P
Таблиця 1. Вплив підняття задніх кінцівок на масу тіла, масу безжирової кістки та концентрацію іонізованого кальцію в сироватці крові
Значення є середніми ± SE. HLE, підняття задніх кінцівок.
* Значно менше, ніж контроль (0 днів HLE) і 2 дні HLE,P † Значно більше, ніж контроль, P 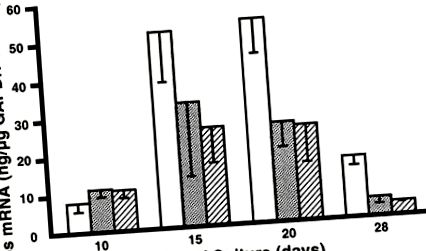
Рис. 1.Вираз с-fos мРНК культивованими стромальними клітинами кісткового мозку (BMSC). Кількісна конкурентна ланцюгова реакція полімерази (QC-PCR) була використана для кількісного визначення c-fos Рівні мРНК у трьох примірниках для кожного пулу кДНК і стандартизовані до рівнів гліцеральдегідфосфатдегідрогенази (GAPDH) в тому ж пулі. Відкриті бари, елементи керування [0 днів підняття задніх кінцівок (HLE)]; сірі смуги, 2 дні HLE; і штрихувані бруски, 5 днів HLE. П'ятиденна група HLE значно менше, ніж 0-денна група HLE [двосторонній дисперсійний аналіз (ANOVA),P
Експресія мРНК AP була значно підвищена в остеопрогеніторних клітинах, виділених у 5-денних щурів, піднятих на задні кінцівки, порівняно з контролем (рис.2). Більша частина цього підвищеного вираження проявлялась у ранні періоди часу в культурі (10 та 15 днів), а загальний приріст протягом періоду культури становив 61% порівняно з контролем (P
Рис.2.Експресія мРНК лужної фосфатази (AP) за допомогою культивованих BMSC. QC-PCR використовували для кількісної оцінки рівнів мРНК AP у трьох примірниках для кожного пулу кДНК та стандартизували до рівнів GAPDH в тому ж пулі. Відкриті бари, елементи управління (0 днів HLE); сірі смуги, 2 дні HLE; і штрихувані бруски, 5 днів HLE. П'ятиденна група HLE значно перевищує 0-денну групу HLE (двостороння ANOVA, P
Рис.3.Експресія мРНК остеокальцину культивованими BMSC. QC-PCR використовували для кількісної оцінки рівнів мРНК остеокальцину в трьох примірниках для кожного пулу кДНК і стандартизували до рівнів GAPDH в тому ж пулі. Відкриті бари, елементи управління (0 днів HLE); сірі смуги, 2 дні HLE; і штрихувані бруски, 5 днів HLE. П'ятиденна група HLE значно менше, ніж 0-денна група HLE (двостороння ANOVA, P
Рис.4.Вплив скелетного розвантаження на мінералізацію in vitro. BMSC стегнової кістки культивували протягом 28 днів у середовищах, що містять аскорбінову кислоту (50 мкг/мл) та β-гліцерофосфат (10 мМ). Культури фіксували і фарбували алізариновим червоним, який розчиняли 0,5 N HCl-5% SDS. Поглинання розчиненого плями вимірювали при 415 нм. * П'ятиденна група HLE була значно меншою, ніж контрольна група (0 днів HLE, P
П’яти днів підняття задніх кінцівок було достатньо, щоб спричинити значні зміни в диференціації та мінералізації культивованих остеопрогеніторних клітин. Тому ми вивчили вплив 5-денного підняття задніх кінцівок на проліферацію та активність АР цих клітин. Кількість клітин визначали шляхом фарбування кришталево-фіолетовим кольором та початкової щільності покриття різних груп (придні 3, 4, і 5 культури) було продемонстровано однакове в обох групах (див. рис. 5,вставка). Автордень 7спостерігалося невелике, але постійне зменшення кількості клітин у культурах щурів, піднятих на задні кінцівки, порівняно з контролем, і ця різниця, як правило, збільшувалася з часом. Культури щурів, піднятих на задні кінцівки, досягли спокою додень 21, про що свідчить плато кривої росту, тоді як у контрольних культурах кількість клітин все ще зростало при день 28. Зниження кількості клітин у культурах щурів, піднятих на задні кінцівки, було значним (P
Рис.5.Проліферація культур BMSC, виділених із контрольної (•) та 5-денної гомілок, піднятих на задні кінцівки (▴). Культури фіксували і фарбували кришталево-фіолетовим, поглинання якого вимірювали спектрофотометрично при 590 нм.Врізка показує розширений масштаб ранніх часових точок у культурі. Кількість клітин у культурах щурів, піднятих на задні кінцівки, була значно меншою, ніж у контрольних культур (за допомогою двосторонньої ANOVA,P
Рис.6.Абсолютний (A) і відносні (B) рівні активності АР у BMSC, виділених із контрольних (•) та 5-денних піднятих задніх кінцівок (▴) гомілок.A: середню активність AP визначали спектрофотометрично на 6-лункових планшетах і виражали як поглинання при 410 нм/мл. B: середню активність АР на клітину обчислювали діленням поглинання при 410 нм на поглинання при 590 нм, що використовується для визначення кількості клітин. Активність АР була значно знижена в культурах щурів, піднятих на задні кінцівки, як в абсолютних, так і у відносних показниках за допомогою двосторонньої ANOVA (P
Сила тяжіння викликає механічне навантаження на важкі кістки, що необхідно для тривалого підтримання нормальної скелетної архітектури. Природа біологічного сигналу, який опосередковує механотрансдукцію в кістці, недостатньо вивчена, але очевидно, що скелетне розвантаження суттєво змінює кістковий метаболізм. Розвантаження скелета зменшує кількість остеобластів, швидкість формування кісток, кісткову масу, дозрівання кісток та механічну міцність (3, 6, 7, 15, 22, 25, 26). Клітини лінії остеобластів відповідають за формування кісток і, як відомо, реагують на механічне навантаження (8, 14). Ці клітини, які включають остеопрогеніторні клітини, остеобласти та остеоцити, є найбільш помітними кандидатами для опосередкування реакції скелета на розвантаження. Важливо з’ясувати біологічну реакцію цих клітин на розвантаження скелета, перш ніж можна зрозуміти природу механічних сигналів, на які вони реагують.
Зниження проліферації остеопрогеніторних клітин, виділених з ненавантаженої кістки, узгоджується із спостережуваним зниженням експресії c-fos, ген, який пов'язаний з проліферацією остеобластів (11, 17). Індуковане розвантаженням зменшення с-fosвисловлювання свідчить про те, що знижена проліферативна активність BMSC відбувається протягом усього шляху їх диференціації і не обмежується найранішими стадіями рекрутування остеопрогеніторів. Зниження c на 80%-fos вираз при день 28 у культурах 5-денних щурів, піднятих на задні кінцівки, є додатковим доказом того, що ці клітини можуть мати знижений проліферативний потенціал і можуть досягти спокою раніше, ніж контролі.
Незрілі остеобласти синтезують органічний кістковий матрикс, який потім мінералізується в міру прогресування диференціації. Незрілі остеобласти характеризуються високим рівнем продукування колагену I типу та високою експресією гена і білка AP (1, 13, 17, 24). Пригнічення диференціації остеобластів може проявлятися відносним збільшенням популяції цих незрілих клітин. Показано, що невагомість гальмує диференціювання остеобластів in vivo (20, 21), і це гальмування може пояснити зміни, що відбуваються на цілому рівні кістки після розвантаження скелета. Ці зміни включають підвищення концентрації колагену (16), зниження мінералізації (6, 15, 25), зниження співвідношення кальцію до гідроксипроліну (6, 23) та збільшення рівня мРНК AP в ненавантаженій кістці (4). У цьому дослідженні ми продемонстрували специфічне збільшення рівня експресії мРНК AP у культивованих BMSC, виділених із гомілок, які були розвантажені протягом 5 днів. Цей результат узгоджується з підвищеним рівнем мРНК AP, що спостерігається у цілих гомілок щурів, розвантажених космічним польотом та підняттям задніх кінцівок (4).
Активність ферменту AP знижувалась підняттям задніх кінцівок як на рівні всієї культури, так і на основі клітин. Раніше повідомлялося, що активність АР знижується в клітинах, ізольованих від стегнових кісток, які були розвантажені за допомогою сідничної невректомії (9). У цьому дослідженні очевидна розбіжність між експресією мРНК AP та активністю ферменту AP має кілька потенційних пояснень. Підвищена мРНК AP, індукована розвантаженням, може не бути кількісно перетворена в білок, або каталітична активність AP білка може бути пригнічена після розвантаження. Крім того, раніше було показано, що на рівні мРНК AP впливає індуцибельний фактор стабілізації мРНК (10), що вказує на складну систему посттрансципційної регуляції AP. Спокусливо припустити, що регуляція активності ферменту AP може сприяти реакції остеобластів на розвантаження.
Здатність утворювати мінералізований матрикс у культурі є чи не найважливішим показником добре диференційованих остеобластів. Підвищена експресія мРНК AP і знижена експресія мРНК остеокальцину в ненавантажених кістках свідчить про те, що більша частка остеобластів залишається на ранній стадії синтезу матриксу і затримується у своєму нормальному прогресуванні до активної мінералізації. Ми вирішили це питання, забарвивши 28-денні культури стегнової кістки BMSC азариновим червоним, який виявляє мінералізовані бульбочки кісткових клітин. BMSC, виділені з 5-денних розвантажених стегнових кісток, утворювали на 40% менше мінеральних речовин порівняно з контролем, що вказує на те, що розвантаження скелета in vivo призводить до порушення мінералізації in vitro. Цей результат узгоджується з даними in vivo, які демонструють, що розвантаження скелета спричиняє знижену мінералізацію та збільшення співвідношення кальцію до гідроксипроліну (6, 23, 25). Ці дані підтверджують гіпотезу про те, що розвантаження скелета зменшує диференціацію остеобластів і демонструють корисність цієї моделі для вивчення впливу невагомості на диференціацію остеобластів.
Ці дані контрастують з даними, отриманими Machwate et al. (12), який повідомив, що 14 днів підняття задніх кінцівок не змінили фенотип остеобластів in vitro. У нашому дослідженні тварини піднімали задні кінцівки протягом 2 або 5 днів. Попередні дослідження вказують на те, що вплив скелетного розвантаження на формування кісток у зростаючого щура є тимчасовим. Через 5 днів підняття задніх кінцівок знижується формування кісток, накопичення кальцію в кістці та концентрація 1,25 (OH) 2D3 у сироватці крові. Однак усі ці параметри повертаються до нормальних рівнів через 12–14 днів безперервного підняття задніх кінцівок, що свідчить про відновлення формування кісток, незважаючи на тривале розвантаження у цих молодих тварин (6, 7). Тому остеобласти, виділені з гомілок, через 14 днів підйому задніх кінцівок не можна було очікувати істотних відмінностей від контрольних клітин.
На закінчення ми продемонстрували, що остеопрогеніторні клітини, виділені з гомілок щурів, які були підняті задніми кінцівками протягом 5 днів, виражали значно менше-fosмРНК, більше AP мРНК і менше мРНК остеокальцину, ніж клітини нормально навантажених гомілок. Зміни експресії генів при 5-денному розвантаженні також супроводжувались зменшенням проліферації, активності АР та мінералізації порівняно з контрольними культурами. Зміни в експресії гена остеобластів і фенотипі після розвантаження узгоджуються із переходом у бік менш зрілої популяції остеобластів, що свідчить про пригнічення диференціації остеопрогеніторних клітин із скелетним розвантаженням. Ці дані також демонструють, що культивовані остеопрогеніторні клітини зберігають "пам'ять" про свою історію попереднього завантаження in vivo, вказуючи на те, що ця модель є цінною для вивчення ефекту скелетного розвантаження на функцію остеобластів in vitro.
Це дослідження було підтримане Національним грантом аеронавтики та космічного управління NAGW-4460.
ЛІТЕРАТУРА
ПРИМІТКИ АВТОРА
Адреса для запитів на передрук: Д. Д. Бікле, Медичний центр управління ветеранами (111N), 4150 Clement St., Сан-Франциско, Каліфорнія 94121.
- Раман-зондування ліпідів, білків та мітохондрій у скелетних міоцитах - приклад дослідження ожиріння -
- Клуб Сем розвантажує ці товари для дому лише тиждень!
- Рекомендації щодо розвантаження - ELITETRACK
- PLOS ONE Трансляційна сигналізація, атрогенна та міогенна експресія генів під час розвантаження та
- Тільки дні розвантажувача вантажних автомобілів (2-4) - робота 276254