Кембридж MedChem Консалтинг
Ресурси для виявлення наркотиків
- Додому
- Про CMC
- Новини
- Категорії новин
- Звичайно
- Публікації
- Ресурси щодо виявлення наркотиків
- Визначення етапу
- Перевірка цілей
- Ідентифікація звернення
- Ідентифікація свинцю
- Оптимізація свинцю
- Властивості ADME
- Поглинання та біодоступність
- Розподіл та зв’язування з білками плазми крові
- Півжиття
- Транспортери
- ABCB1
- Транспортери_взаємодії
- Проникнення мозку
- Обмін речовин
- CYP_interactions
- Інгібування CYP3A4
- Інгібування CYP2D6
- Інгібування CYP2C19
- Інгібування CYP2C9
- Альдегід-оксидаза
- Формулювання
- Доклінічна токсичність
- Різне
- Доклінічний контрольний список
- Зв'язок
- Журнали журналів
Розподіл лікарського засобу часто вимірюється як об'єм розподілу (Vdss) і є мірою об'єму рідини, який був би необхідний для утримання кількості лікарського засобу, що знаходиться в організмі, при тій же концентрації, що і у плазмі. Важливо зазначити, що виміряні обсяги не є фактичними фізичними обсягами, а є очевидними обсягами на основі розведення препарату в плазмі. Однак обсяги рідини в різних відділеннях можуть поставити спостережувані обсяги розподілу в контекст.
Об'єм розподілу (L) = кількість препарату в організмі (мг)/плазмова концентрація препарату (мг/л)
Часто це нормується до ваги тіла в кг, в цьому випадку одиницями є L/Kg.
Типові обсяги рідини для чоловіка 70 кг складають (% та L)
| 60%, | 42 л |
| 40%, | 28л |
| 20%, | 14л |
| 4%, | 3л |
| 8%, | 5,5 л |
Препарат з високим вмістом Vd має схильність виходити з плазми та потрапляти в позасудинні відділи організму, що означає, що для досягнення заданої концентрації в плазмі необхідна більша доза препарату. (Високий Vd призводить до розподілу руди в інших тканинах). І навпаки, препарат із низьким вмістом Vd має схильність залишатися в плазмі, тобто для досягнення заданої концентрації в плазмі необхідна менша доза препарату. (Низький Vd означає менший розподіл в інших тканинах).
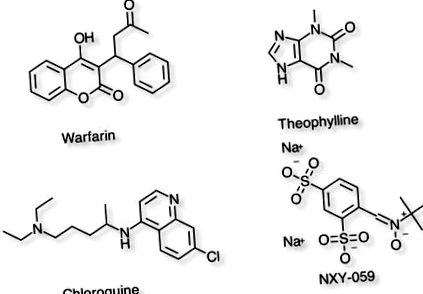
Приклади сполук з різним обсягом розподілу
| Варфарин | 8л | Відображає високий ступінь зв’язування з білками плазми. | PPB = 99%, T1/2 = 37-89год |
| Теофілін | 30л | Представляє розподіл у загальній кількості води в організмі. | PPB = 40%, T1/2 = 8 год |
| Хлорохін | 15000л | Високоліпофільні молекули, які поділяються на жир | PPB = 55%, T1/2 = 1-2 місяці |
| NXY-059 | 8л | Високозаряджена гідрофільна молекула. | PPB = 30%, T1/2 = 2-4 год |
Розподіл препарату з плазми в тканинах-мішенях може здійснюватися за допомогою ряду факторів, таких як висока молекулярна вага, але, мабуть, найважливішим є зв’язування з білками плазми крові (PPB). З'єднання, які в значній мірі пов'язані з білками плазми, матимуть низький об'єм розподілу (Vdss), можуть мати тривалий період напіввиведення з плазми (T1/2) і мати низький кліренс (Cl) як печінкою (печінкою), так і нирками (нирками) маршрути. Високе зв’язування з білками плазми крові може також впливати на ефективність, оскільки, як правило, вільна фракція препарату відповідає за фармакологічну дію.
Період напіввиведення може бути пов'язаний з обсягом розподілу за допомогою наступного рівняння
Період напіввиведення (години) = 0,693 х (об'єм розподілу (л)/кліренс (л/год)
Більша частина кліренсу ліків відбувається через печінку та нирки, тому ліки з великим обсягом розподілу будуть мати більшість ліків у тканинах поза плазмою і тим самим захищають від кліренсу.
Вимірювання зв’язування з білками плазми
Швидкий спосіб зрозуміти, чи може проблема зв’язування з білками плазми - це додати сироватку до екрану in vitro, якщо очевидна спорідненість падає, це часто є доказом того, що ліганди зв’язуються з білками плазми, ви також можете додати очищені компоненти (наприклад, людський сироватковий альбумін), щоб отримати уявлення про те, які білки можуть бути задіяні.
Діаліз рівноваги є найбільш широко прийнятим методом оцінки зв'язування з білками плазми, оскільки неспецифічні зв'язувальні ефекти мінімізовані в порівнянні з іншими методами, такими як ультрафільтрація, але є відносно повільним процесом, починаючи з 4-24 годин при 37 С. може бути важко виміряти концентрацію незв'язаного препарату, у цих випадках може бути краще використовувати 10% плазму в буфері. Дуже погано розчинні сполуки можуть також давати аномальні результати, як і сполуки, нестійкі в плазмі.
Ультрафільтрація підходить для швидкого скринінгу і вимагає дуже мало суміші. З'єднання інкубують у плазмі протягом 1 години, потім центрифугують при 2700 об/хв 10 хв. Потім супернатант аналізують на концентрацію лікарського засобу. Цей метод може бути сприйнятливим до неспецифічного зв'язування.
Публікація з Університету Вашингтона DOI описує недорогий пристрій мікродіалізу для вимірювання зв’язування ліків і білків (DIYM).
Пристрій засновано на стандартному рівноважному методі діалізу для вимірювання частки низькомолекулярної сполуки, зв’язаної з білками. Він побудований із стандартної поліпропіленової 96-лункової пластини, діалізної трубки та епоксидної смоли з низькою в’язкістю. Пристрій можна легко підготувати за невелику частку вартості комерційного, багатокамерного, мікродіалізного пристрою.
Отримані результати сприятливо узгоджуються з літературними цінностями.
| Декстрометорфан | 66,8 | 65 |
| Диклофенак | 98,0 | 99,5 |
| Мефлохін | 98,9 | > 98 |
| Метотрексат | 54,0 | 50.4 |
| Паклітаксел | 94.2 | 95 |
| Прогестерон | 97,0 | 98 |
| Пропранолол | 82,5 | 82 |
| Тестостерон | 93.3 | 98 |
Використовуються внутрішні стандарти, такі як Варфарин, Пропаналол, Дигоксин або Диклофенак. Також може використовуватися плазма від різних видів.
Результати зазвичай виражаються як фракція незв'язаної (fu), де [D] - концентрація вільного лікарського засобу, а [DP] - концентрація лікарського білкового комплексу.
або як% зв’язування з білками
Поки зв’язок препарату не перевищує 90%, проблем зазвичай не виникає, як тільки ви досягнете зв’язку> 99%, зв’язування з білками плазми крові, ймовірно, матиме значний вплив.
Стратегії зменшення зв’язування з білками плазми крові
Я складав базу даних виміряних даних про зв'язування білків плазми для малих молекул, взятих з літератури, як видно з наведеного нижче графіку, ясно, що більшість малих молекул зв'язуються з білками плазми, причому багато з них виявляються> 90% зв'язаний.
У різних класів сполук частіше виникають проблеми з PPB, кислоти, як правило, виявляють найвищу спорідненість до білків плазми, як показано на графіку нижче (взято з виступу Руперта Остіна в школі RSC MedChem). На графіку показано графік журналу (% зв'язаних /% вільних) порівняно з LogD. Взагалі, більш ліпофільні сполуки демонструють більше зв’язування з білками плазми, у випадку кислот сполуки з LogD> 0 майже всі зв’язуються> 99%. Нейтральні та основні молекули зазвичай потребують LogD більше> 4, перш ніж зв’язування з білками плазми стає проблемою. Було описано декілька моделей silico, де DOI, в яких ліпофільність та молекулярна маса мають критичний та незалежний вплив на зв'язування з білками плазми крові.
Основними білками плазми, які можуть взаємодіяти з ліками, є:
- Альбумін
- Альфа-1-кислотний глікопротеїн
- Ліпопротеїди
Загалом, кислі та нейтральні препарати в основному зв’язуються з альбуміном, а основні - з кислим альфа-1 кислотним глікопротеїном або ліпопротеїнами.
Альбумін
(MWt 66 KDa), (HSA) є найпоширенішим білком у плазмі крові людини при вмісті від 3,5 до 5,0 г/дл. Він виробляється в печінці. Альбумін містить приблизно половину білка сироватки крові (від 30 до 50 г/л). У Базі даних білків PDB є майже 100 кристалічних структур альбуміну, 58 із зв’язаними лігандами. Прикладом є 2vdb, в якому зв’язаний S-напроксен. Показано, що мутації білка альбуміну впливають на зв'язування лікарських засобів DOI90466-V). Сироватковий альбумін людини має кілька потенційних сайтів зв'язування, і це добре проілюстровано на рентгенівській структурі HSA, комплексованій з дифунісалом (зеленим), показаним нижче. DOI.
Альфа-1-кислотний глікопротеїн
(MWt 44 KDa), (AAG, AGP, Orosomucoid, ORM) має нормальну концентрацію в плазмі від 0,04-0,1 г/дл (1-3% білка плазми). Він негативно заряджається при фізіологічному pH і взаємодіє переважно з основними препаратами, включаючи блокатори бета-адренергічних рецепторів, антидепресанти, нейролептики та місцеві анестетики. У PDB 3BX6 є кристалічна структура, розгалужена, частково гідрофобна та частково кисла порожнина, а також, мабуть, гнучка петля 1 та дві бічні ланцюги цукру біля її входу, пояснює різноманітний лігандний спектр AGP, який, як відомо, змінюється зі змінами в схемі глікозилювання. Кристалічна структура варіанта A альфа1-кислотного глікопротеїну людини та амітриптилінового комплексу 3APV нещодавно була розкрита [PDB і висвітлює, що взаємодії пі-стакінгу важливі для зв’язування лігандів.
Таблиця основних білків плазми
| 69 | 3,5-5,0 | Кислотний | підтримує колоїдний осмотичний тиск і транспортує нерозчинні молекули |
| 44 | 0,04-0,1 | Основні | реактивний білок гострої фази |
| 200-3400 | Змінюється | Основні | Транспорт жирних кислот |
| 140 | 2,0-2,5 | Брати участь в імунній системі | |
| 53 | 0,003-0,007 | Стероїди | |
| 400 | 0,2-0,4 | Згортання крові |
Приклади конкретних білків крові
Преальбумін, альфа 1 антитрипсин, альфа 1 кислотний глікопротеїн, альфа 1 фетопротеїн, альфа2-макроглобулін, гамма-глобуліни, бета-2 мікроглобулін, гаптоглобін, церулоплазмін, компонент комплементу 3, компонент комплементу 4, ліпопротеїни, С-реактивний білок (СРБ), ліпопротеїни ( хіломікрони, ЛПНЩ, ЛПНЩ, ЛПВЩ), амілоїд P-компонента сироватки (SAP), трансферин, транстиретин (TTR), протромбін, MBL або MBP,
Альбумін
Цефтріаксон (A), кліндаміцин (A), клофібрат (A), дексаметазон (N), діазепам (N), діазоксид (A), диклоксацилін (N), дигітоксин (N), етопозид (N), ібупрофен (A), Індометацин (A), Нафцилін (A), Напроксен (A), Оксацилін (A), Фенілбутазон (A), Фенітоїн (A), Пробенецид (A), Саліцилова добавка (A), Сульфізоксаол (A), Теніпозид (N), Тіопентал (A), Толбутамід (A), Вальпроєва кислота (A), Варфарин (A).
Альбумін та AAG
Альпренолол (B), карбамазепін (N), дизопірамід (B), еритроміцин (B), лідокаїн (B), меперидин (B), метадон (B), верапаміл (B).
Альбумін та ліпопротеїди
Циклоспорин (N), пробукол (N).
Амітриптилін (B), бупівакаїн (B), хлорпромазин (B), дилтіазем (B), лміпрамін (B), нортриптилін (B), перазин (B), пропанолол (B), хінідин (B).
A = кислота; B = основа; N = нейтральний.
Наслідки зв’язування з білками плазми
Ефективність препаратів може бути порушена завдяки високому зв’язуванню з білками плазми крові, оскільки для зв’язування з молекулярною мішенню доступна лише незв’язана фракція.
На кліренс препарату може впливати зв’язування з білками плазми крові, як правило, лише незв’язаний препарат підлягає печінковому кліренсу. Подібним чином знижується нирковий кліренс для сполук з високим зв’язуванням з білками плазми крові. На об'єм розподілу в рівноважному стані також впливатиме зв'язування з білками і, отже, кінцевий період напіввиведення.
Наркотики можуть конкурувати за один і той же сайт зв'язування, і, отже, існує потенціал для взаємодії лікарських засобів, що буде особливо занепокоєним для препаратів з високим вмістом білка, що мають низький терапевтичний індекс, таких як варфарин.
Хоча білки плазми виконують подібні функції і мають однакові концентрації у різних видів, невеликі відмінності в послідовності білків можуть впливати на ступінь зв’язування з білками, тому доцільна оцінка in vitro у багатьох видів.
Оновлено 6 грудня 2019 року
- Керівництво лікарів з водних дієт Відгуки про схуднення Сироватковий протеїн Втрата ваги для жінок
- Чи потрібен вам білок, якщо вам; Повторна спроба тонізувати здорове харчування SF Gate
- Трав’яний яловичий білковий ізолят 1 фунт - потужний порошок з яловичини
- Лікарі Втрата ваги - Тропічна бананова дієта, протеїновий коктейль або пудинг (7Box) - NutriWise
- Чи захищає білок від набору ваги