Роль нейтрального амінокислотного транспортера B 0 AT1 (SLC6A19) у розладі Хартнупа та харчуванні білками
Школа біології, Медичний коледж, Австралійський національний університет, Канберра, територія столиці Австралії, Австралія
Тел .: + 61‐2‐6125‐2540. Факс: + 61‐2‐6125‐0313.
Школа біології, Коледж медицини, біології та навколишнього середовища, Австралійський національний університет Шукайте більше статей цього автора
Школа біології, Медичний коледж, Австралійський національний університет, Канберра, територія столиці Австралії, Австралія
Тел .: + 61‐2‐6125‐2540. Факс: + 61‐2‐6125‐0313.
Школа біології, Коледж медицини, біології та навколишнього середовища, Австралійський національний університет Шукайте більше статей цього автора
Анотація
ПОРУШЕННЯ ХАРТНУПУ, ФІЗІОЛОГІЧНІ ТА КЛІНІЧНІ АСПЕКТИ
Розлад Хартнупа (OMIM 234500) - це аутосомно-рецесивний розлад, який у європейських популяціях зустрічається з частотою близько 1: 30 000 (1, 2). Вперше розлад було описано в 1956 р. Baron et al. (3) і заголовок публікації описує основні клінічні особливості розладу найбільш стисло: “Спадкова пелаграподібна шкірна висипка з тимчасовою мозочковою атаксією, постійною нирковою аміноацидурією та іншими химерними біохімічними особливостями.” Розлад Хартнупа отримав свою назву з першої описаної справи Едді Хартнуп (Едді Х. в оригінальній публікації).
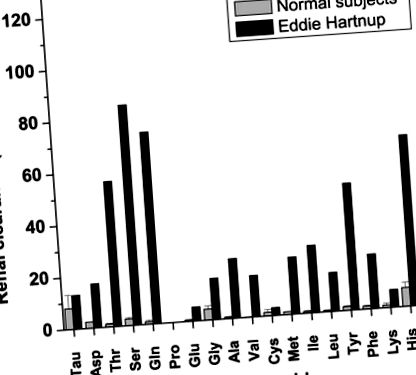
Ниркова аміноацидурія є ознакою розладу через мінливість інших симптомів, і більшості, якщо не у всіх пацієнтів, діагностували аналіз сечі. Типовим прикладом є аналіз сечі самого Едді Хартнупа, як повідомляють Касворт і Дент (10) (рис. 1). Аміноацидурія обмежена нейтральними амінокислотами, хоча часто також виявляються незначно підвищені кількості глутамату. Особливо актуальними є збільшені кількості триптофану (не показано на рис. 1), що вказує на відсутність реабсорбції триптофану. Аміноацидурія та клінічні симптоми спричинені дефектом основного ниркового та кишкового транспортера нейтральних амінокислот, який отримав назву B 0 (Позначає транспортер нейтральних амінокислот (0) із широкою специфічністю; верхній регістр використовується для позначення Na + -залежність) (11, 12) або нейтральна межа щітки (NBB) (13).
Нирковий кліренс амінокислот у контрольних суб’єктів та Едді Хартнупа, як повідомляють Касворт та Дент (10) (змінено з дозволу). Нирковий кліренс 120 вказує на речовину, яка ні реабсорбується, ні виводиться канальцями нирок.
Атаксія також може бути пов'язана з метаболізмом триптофану та його перетворенням на серотонін (5-гідрокситриптамін). Серотонін відіграє важливу роль як нейромедіатор у модуляції гніву, агресії, температури тіла, настрою, сну, сексуальності, апетиту та метаболізму. Незважаючи на те, що в мозку виявляються низькі рівні B 0 AT1, основним місцем його експресії є межа кисті епітеліальних клітин нирок та кишечника. Однак рівень серотоніну в мозку відповідає рівню триптофану в крові, оскільки Км триптофану гідроксилази, що обмежує швидкість біосинтезу серотоніну, вища, ніж концентрація триптофану в мозку або циркуляції (14). Як результат, триптофан має антидепресивні властивості, а його метаболіт 5-гідрокситриптофан викликає регрес різних форм мозочкової атаксії (16). Мало відомо, чи можуть змінені рівні в плазмі інших амінокислот-попередників нейромедіаторів, таких як тирозин або гістидин, сприяти неврологічним симптомам. Було відзначено, що клінічні симптоми частіше виникають у осіб з низьким рівнем амінокислот у плазмі (6).
В якості альтернативи було запропоновано, що можуть бути задіяні токсичні продукти розпаду бактерій триптофану (17). Продукти бактеріального розкладу триптофану, такі як сполуки індолу (індоксилсульфат, індол оцтова кислота, індолілацетилглютамін) та інші амінокислоти, були виявлені в сечі людей із розладом Хартнупа, демонструючи, що вони всмоктуються в кишечнику та розподіляються по тілу. . Виникнення цих продуктів розпаду бактерій справді було першим свідченням того, що транспорт амінокислот порушується в кишечнику (18). Участь сполук індолу у появі атаксії, однак, представляється малоймовірною з огляду на асимптотичні випадки розладу Хартнупа, при яких продукти розкладання триптофану все ще будуть вироблятися.
Є ГАРЕНТИЧНИМ ПОРУШЕННЯМ ГЕНЕТИЧНО КОМПЛЕКСНИМ ТА ПРОСТИМ
ІДЕНТИФІКАЦІЯ ГЕНУ/БІЛКА
МУТАЦІЇ
Ідентифікація B 0 AT1 (SLC6A19) як гена розладу Хартнупа ініціювала спроби секвенування у кількох сім'ях з розладом Хартнупа. Вони виявили мутації у SLC6A19, котрий косегрегував із хворобою та інактивованою транспортною функцією (4, 5). Хоча спочатку існували певні припущення щодо додаткових генів розладу Хартнупа, повторна оцінка сімей, виявлених до цього часу, та послідовність нових сімей виявила мутації в SLC6A19 у всіх випадках (38). На сьогоднішній день виявлено 21 різну мутацію у понад 20 сім'ях (табл. 1 та рис. 2). Зразки оригінального випадку Хартнупа призвели до ідентифікації мутації сплайсингу в інтервенційній послідовності 8 (4).
Огляд мутацій, пов'язаних з розладом Хартнупа, в топологічній моделі людського SLC6A19. Розташування спіралей відображає консенсусну модель сімейства SLC6, засновану на структурі транспортера лейцину LeuT від Aquifex aeolicus (40). Завдяки такому розташуванню скелет графічно переривається між спіралями 5 і 6. Субстрат та залишки, що беруть участь у зв'язуванні субстрату, відображаються зеленим кольором. Іон Na + позначений червоним кольором, а залишки, пов'язані з зв'язуванням Na +, прикрашені червоним кільцем. Мутанти, асоційовані з розладом Хартнупа, маркуються і відображаються помаранчевим кольором синім кільцем. Залишки, які, як вважають, утворюють два затвори транспортера, з'єднані штриховою лінією та пофарбовані в синій (основні залишки) або жовтий (кислий).
| Нерозуміння | |||
| 169C> T | R57C | п. р. | (4) |
| 196G> A | G66R | 37) | |
| 205G> A | A69T | п. р. | (48) |
| 277G> A | G93R | 37) | |
| 517G> A | D173N | 0,004–0,007 | (5) |
| 532С> Т | R178X | 37) | |
| 719G> A | R240Q | 5) | |
| 725T> С | L242P | п. р. | (5) |
| 794C> Т | P265L | п. р. | (48) |
| 850G> A | G284R | 37) | |
| 982C> T | R328C | 37) | |
| 1213G> A | E405K | 37) | |
| 1501G> A | E501K | п. р. | (5) |
| 1550А> Г. | D517G | 37) | |
| 1735C> Т. | P579L | п. р. | (48) |
| Нісенітниця | |||
| 682‐683AC> TA | T228X | п. р. | (4) |
| 718C> T | R240X | 0,001 | (5) |
| Видалення | |||
| 340дельС | L114fsX114 | п. р. | (4) |
| c884_885delTG | V295fsX351 | п. р. | (4) |
| Сайт зрощення | |||
| IVS8 + 2G | Абераційне зрощення | 5) | |
| IVS11 + 1A | Абераційне зрощення | п. р. | (5) |
Подібність послідовностей з LeuT дозволила створити моделі гомологій, які допомогли пояснити втрату функції деяких мутацій (42). Наприклад, G284 знаходиться в спіралі 6 транспортера (рис. 2 і 3). Разом із спіраллю 1 він вистилає шлях транслокації субстрату і пропонується рухатися під час транспортного циклу в режимі коромислового перемикача (40). В центрі мембрани обидві спіралі частково розмотані, що дозволяє залишковим кісткам контактувати з котранспортованим іоном Na +. Завдяки гнучкості, яку надає відсутність бічного ланцюга, залишок G284 дозволяє розмотувати спіраль у цій області. Мутація R57, розташована в спіралі 1, порушує запропоновані позаклітинні ворота транспортера (рис. 2). Цей затвор є важливим для транспортного механізму, що закриває пори, взаємодіючи з D486 (рис. 4). Мутація R57 до нейтрального залишку скасовує цю взаємодію. Зовсім інший спосіб дії був запропонований для мутації R240Q за допомогою моделі гомології. Залишок знаходиться на верхівці білка, що виступає назовні (37). В результаті малоймовірно, що це вплине на сам транспортер, а навпаки, вказує на ділянку взаємодії з допоміжними білками.
Розташування мутації G284, пов’язаної з розладом Хартнупа. Модель гомології B 0 AT1 (SLC6A19) була створена на основі структури LeuT від Aquifex aeolicus. Спіраль 1 показана жовтим кольором, а спіраль 6 - синім кольором. Мультфільм вказує на негелікову частину обох спіралей поблизу місця зв'язування субстрату. Інші спіралі зображені червоним кольором. Два іони Na + зображено аналогічно будові бактерій. Експериментальні дані свідчать про те, що Na транспортується у B 0 AT1. Наявність і функція Na є умоглядними. G284 розташований у центрі спіралі 6, де спіральна структура перервана. Цифра була сформована за допомогою Pymol (DeLano Scientific).
Розташування мутації R57, пов’язаної з розладом Хартнупа. Модель гомології B 0 AT1 (SLC6A19) була створена на основі структури LeuT від Aquifex aeolicus. Спіраль 1 показана жовтим кольором, а спіраль 6 - синім кольором. Інші спіралі зображені червоним кольором. Вказано положення субстрату лейцин та гіпотетичний Na. Залишок R57 знаходиться в тісному контакті з D486 і утворює іонний зв’язок, який закриває транслокаційну пору до позаклітинного простору. Цифра була сформована за допомогою Pymol (DeLano Scientific).
АСОЦІЙОВАНІ БІЛКИ
Огляд взаємодіючих білків SLC6A19. Білок-білкові взаємодії зображені повними стрілками. Регулювання транскрипції позначено пунктирними стрілками. Фізіологічні реакції наведені в дужках.
Взаємодія B 0 AT1 з колерином також пояснює аміноацидурію у випадках MODY3, яка спричинена мутаціями фактора транскрипції HNF1α (печінковий ядерний фактор 1 альфа) (52). HNF1α є одним з основних факторів транскрипції, що контролює експресію колектирину в нирках. Інактивація HNF1α спричинить недостатню експресію колектирину, що, в свою чергу, спричинить знижену експресію B 0 AT1 та транспортера проліну IMINO (рис. 5). Інактивація HNF1α у мишей призводить до дисфункції печінки, фенілкетонурії та ниркового синдрому Фанконі. Таким чином, аміноацидурія, що спостерігається при синдромі Фанконі, може бути пов'язана із втратою колектирину або зниженою регуляцією експресії HNF1α. Згідно з цим уявленням, також було показано, що HNF1α контролює експресію апікального транспортера глюкози SGLT1 (53) і, можливо, катіонного амінокислотного транспортера rbAT/b 0, + AT (54). Аміноацидурія, що спостерігається при цукровому діабеті або вагітності, залишається незрозумілою, але також може спричиняти зниження рівня колерину.
Як зазначалося вище, пептидний транспорт, ймовірно, компенсує виснаження амінокислот при розладі Хартнупа. Дотепер у пептидному транспортері PepT1 були виявлені синонімічні однонуклеотидні поліморфізми (SNP) (55). Виявлено лише одну мутацію (F28Y), яка знижує транспортну активність. Не досліджено, чи можуть SNPs в промоторних або інтронічних областях змінювати експресію транспортера і, отже, можуть модулювати фенотип розладу Хартнупа. Також не досліджено, чи останні випадки класичного розладу Хартнупа можуть мати мутацію F28Y в PepT1, тим самим посилюючи симптоми.
ПАТРІАРХ НОВОЇ РОДИНИ
Як зазначено вище, B 0 AT1 є членом сімейства транспортерів нейромедіаторів SLC6. Коли цю сім’ю було виявлено, клонування гомологій виявило підсімейство споріднених транспортерів, функцію яких не вдалося визначити. Ці транспортери були названі XT1 (псевдонім NTT4) (56, 57), XT2 (псевдонім ROSIT) (31, 32), XT3 (58), NTT5 (59) та v7-3 (60). Цю гілку родини SLC6 відтак називали гілкою сироти-транспортера. Відкриття B 0 AT1 помістило його до гілки транспортера-сироти, припустивши, що „сироти” насправді можуть бути транспортерами амінокислот (61) (Таблиця 2). Згодом це було підтверджено для XT3, показавши, що це апікальна система IMINO-транспортер (66, 67), транспортер, специфічний для проліну, гідроксипроліну, бетаїну та MeAIB. Далі v7-3 був визначений як B 0 AT2 - транспортер із подібними властивостями, як B 0 AT1, але з більш вузькою специфічністю субстрату, віддаючи перевагу амінокислотам з розгалуженим ланцюгом та метіоніну (62, 63). Нещодавно було показано, що NTT4 є нейтральним транспортером амінокислот (64, 65), який залежить від Na + або H + і був відповідним чином названий B 0 AT3. Здається, XT2 надає перевагу гліцину та аланіну (рукопис, що готується). Таким чином, сироти-транспортери утворюють велике сімейство Na + -залежних транспортерів нейтральних амінокислот.
| SLC6A15 | B 0 AT2 | V7‐3, NTT7‐3, SBAT1 | Leu, Ile, Val, Met, Pro (62, 63) |
| SLC6A16 | NTT5 | Невідомо | |
| SLC6A17 | B 0 AT3 | NTT4, RXT1 | Ала, Про, Глі, Леу (64) |
| Leu, Met, Pro, Cys, Ala, Gln, Ser, His, Gly (65) | |||
| SLC6A18 | XT2, | XTRP2, ROSIT | Ала, Глі> інші нейтральні АА |
| SLC6A19 | B 0 AT1 | Подібно до XT2 | Усі нейтральні (34, 35) |
| SLC6A20 | ІМІНО | SIT1, XT3 | Pro, OH-Pro (66, 67) |
ВИСНОВОК
Хоча спочатку це було описано як простий аутосомно-рецесивний розлад, молекулярна ідентифікація основного гена SLC6A19 виявляє складні взаємодії між транспортером та пов’язаними з ним білками колектирином та АСЕ2. Взаємодія SLC6A19 (рис. 5), можливо, пов'язує його зі складними розладами, такими як діабет, дисфункція регуляції артеріального тиску та склероз клубочків.
1 Абревіатура B 0 AT1 відноситься до Na + -залежної транспортної активності нейтральних (0) амінокислот із широкою (B) специфічністю. У геномах ссавців його називають розчиненим носієм сімейства 6 член 19 (SLC6A19).
- Тіоредоксин та ліпоєва кислота каталізують денітрозацію низької молекулярної маси та білка
- Переваги амінокислот від Super Amino 23 - Нове харчування
- Огляди 17 найкращих амінокислотних добавок 2020
- Роль генів, які беруть участь у ліполізі в програмі схуднення у осіб із надмірною вагою та ожирінням
- Роль терапії прогестероном у зменшенні ваги та PRT