Огляд рибних алергенів: змінна алергенність парвалбумінів, основних рибних алергенів
Аннет Кюн
1 Лабораторія імуногенетики та алергології, Публічний дослідницький центр охорони здоров'я (CRP-Santé), Люксембург, Люксембург
Інес Свобода
2 Секція молекулярних біотехнологій, Університет прикладних наук, Відень, Австрія
Картік Арумугам
1 Лабораторія імуногенетики та алергології, Публічний дослідницький центр охорони здоров'я (CRP-Santé), Люксембург, Люксембург
Крістіан Хілгер
1 Лабораторія імуногенетики та алергології, Публічний дослідницький центр охорони здоров'я (CRP-Santé), Люксембург, Люксембург
Франсуа Хенгес
1 Лабораторія імуногенетики та алергології, Публічний дослідницький центр охорони здоров'я (CRP-Santé), Люксембург, Люксембург
3 підрозділ імунології та алергології, Центр госпітальє Люксембургу, Люксембург, Люксембург
Анотація
Алергія на рибу
Поширеність
У раціоні людини риба є цінним джерелом незамінних амінокислот, поліненасичених жирних кислот та розчинних у ліпідах вітамінів. Хоча споживання риби в європейських країнах є досить стабільним, глобальний попит на рибу та рибні продукти все ще стабільно зростає (1). Хоча багато літературних джерел вказують на те, що алергія на рибу зростає, фактична поширеність цього захворювання недостатньо встановлена, оскільки більшість досліджень ґрунтуються на харчових алергіях, про які повідомили самі (2). За оцінками, до 0,2% загальної популяції страждає на алергію на рибу (3, 4). Однак вплив риби є важливим фактором, що визначає поширеність зареєстрованої алергії на рибу. Тому поширеність алергії на рибу більша в країнах з високим рівнем споживання риби та переробної промисловості (5).
Клінічні особливості
Діагностика та догляд за хворими
Процедура діагностики базується на чотирьох основних опорах: клінічний анамнез пацієнта, in vivo аналіз реактивності шкіри, in vitro кількісне визначення специфічного сироваткового IgE та, в окремих випадках, усні провокаційні проблеми. Широке різноманіття риб споживається у всьому світі, але лише обмежена кількість комерційних екстрактів доступна для шкірного тестування. Тому для аналізу in vivo зазвичай використовують свіжу або оброблену рибу. Однак прогнозована цінність шкірних тестів низька (28). Для аналізу in vitro специфічних рівнів IgE система ImmunoCAP (ThermoSciaching) пропонує широку панель рибних екстрактів. Тим часом для цього діагностичного аналізу доступні два рекомбінантних парвальбуміни коропа та тріски. Прогностична цінність вимірювань IgE, специфічних для екстракту риби, недостатньо встановлена, але повідомлялося, що високий титр специфічного IgE (20 кУа/л) передбачає алергію на тріску з ймовірністю 95% (29).
Інші побічні реакції можуть бути неправильно діагностовані як алергія на рибу (30). Симптоми, подібні до алергії, виникають при попаданні в організм забрудненої гістаміном зіпсованої риби («отруєння рибою скомброїдом») (31). Також споживання риби, зараженої паразитом Anisakis simplex (оселедцевий черв’як), провокує гострі алергічні прояви, спричинені IgE-опосередкованою сенсибілізацією до алергенів Anisakis (27, 32).
Щоб уникнути важких реакцій, лікування алергії на рибу покладається на виключення кожного рибного продукту з раціону сенсибілізованого пацієнта. У деяких випадках повідомляється, що пацієнти можуть втратити чутливість після відмови від дієти (33, 34). Про терапевтичну десенсибілізацію риб повідомлялося лише в одному випадку (35). Розробка специфічних імунотерапевтичних засобів, заснованих на гіпоалергенних варіантах парвальбумінів, основних рибних алергенів, є основною темою поточних досліджень (36, 37). Дослідження первинної стратегії профілактики алергії на рибу дуже обмежені. Сучасні рекомендації Американської академії алергії, астми та імунології також не пропонують загального, відстроченого введення риби в раціон дітей (38).
Рибні алергени
Харчові алергени
Кілька продуктів, які відповідають за більшість алергічних реакцій, - це молоко, яйця, арахіс, горіхи, риба, молюски, соя та пшениця. Вони містять сильнодіючі харчові алергени (39). Їх алергенна ефективність пов’язана з певними особливостями білка. Цих алергенів дуже багато в харчових джерелах, і крім того, вони мають високу стійкість до переробки їжі та травлення (40). Структурна стабільність була розподілена на різні характеристики білка, такі як внутрішнє зв'язування ліганду та внутрішньомолекулярні дисульфідні зв'язки (41). Деякі харчові алергени утворюють білкові агрегати високої стабільності. Хоча деякі харчові алергени чутливі до шлункового та кишкового травлення, фрагменти деградації все ще розпізнаються за допомогою специфічних антитіл IgE (42). Харчові алергени тваринного походження в основному згруповані в три білкові надродини, такі як казеїни, тропоміозини та білки EF-рука (43).
Рибний парвальбумін
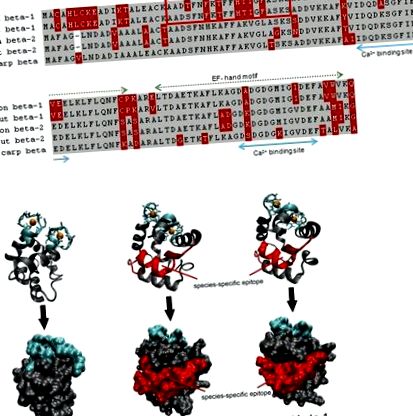
Парвальбуміни належать до сімейства білків EF-рук. Як такі, вони містять специфічні мотиви EF-рук, що складаються з 12 залишків довгих петель, які беруть участь у зв'язуванні іонів двовалентного металу. N-кінцевий вузол EF-руки є нефункціональним доменом, тоді як два інших мотиви EF-руки зв'язують іони кальцію та магнію (56). Фізіологічна роль м'язових парвальбумінів пов'язана з регуляцією внутрішньоклітинної концентрації кальцію під час розслаблення м'язів (57). Після зв’язування іонів та вивільнення іонів структура бета-парвальбуміну піддається глобальній перебудові, що вказує на загальну гнучкість доменів EF-рук (58). Апо-білок, який є виснаженим кальцієм парвальбуміном, має знижену здатність зв’язувати антитіла IgE з пацієнтами з алергією на рибу (59). Отже, ці ділянки, що зв’язують кальцій, були віднесені до конформаційних епітопів В-клітин (60).
На сьогодні офіційна база даних алергенів містить 21 парвальбумін з 12 видів риб 1 (Таблиця (Таблиця1) 1) (61). В базі даних Allergome перелічено набагато більше 100 записів щодо рибних парвальбумінів та їх ізоформ/ізоалергенів 2 (62). Це набагато більша кількість виникає завдяки компіляції гомологічних, потенційно алергенних молекул, крім білків із доведеною алергенністю. Парвальбумін визначено головним рибним алергеном, оскільки у більшості хворих на алергію на рибу антитіла IgE реагують на цей м’язовий білок (63–65). Однак поширеність парвальбумін-специфічних антитіл IgE, схоже, різниться у різних груп пацієнтів. Наприклад, пацієнти з алергією на рибу із сенсибілізацією до тропічних риб реагують здебільшого на інші алергени, крім парвальбумінів (66, 67). Як правило, висока клінічна перехресна реактивність серед риб пояснюється перехресно реагуючими антитілами IgE, що розпізнають парвальбуміни деяких видів (68). Нещодавно клінічна моночутливість до лососевих риб була пов'язана зі специфічними IgE антитілами до парвальбуміну лосося, що свідчить про те, що перехресна реактивність серед парвалбумінів риб може бути обмежена цими близькими рибами (23, 25).
Таблиця 1
Записи офіційних алергенів до риб за допомогою бази даних Підкомітету з алергенних номенклатур Міжнародного союзу імунологічних товариств (www.allergen.org).
| Clupeiformes | Clupea harengus (оселедець атлантичний) | Clu h 1,0101 | Парвальбумін |
| Clu h 1.0201 | |||
| Clu h 1.0301 | |||
| Сага Сардинопс (Тихоокеанський сарделька) | Сар 1,0101 | Парвальбумін | |
| Cypriniformes | Cyprinus carpio (звичайний короп) | Кіп c 1.0101 | Парвальбумін |
| Кіп c 1.0201 | |||
| Gadiformes | Каларії Gadus (балтійська тріска) | Gad c 1.0101 | Парвальбумін |
| Gad m 1.0101 | Парвальбумін | ||
| Gad m 1.0102 | |||
| Gad m 1.0201 | |||
| Gadus morhua (атлантична тріска) | Gad m 1.0202 | ||
| Gad m 2.0101 | Енолаза | ||
| Gad m 3.0101 | Альдолаза | ||
| Перциформи | Пізній калькаріфер (баррамунді) | Ширина c 1,0101 | Парвальбумін |
| Ширина c 1,0201 | |||
| Oreochromis mossambicus (тилапія) | Руда м 4.0101 | Тропоміозин | |
| Thunnus albacares (тунець жовтоперий) | Чт 1.0101 | Парвальбумін | |
| Чт 2.0101 | Енолаза | ||
| Чт 3.0101 | Альдолаза | ||
| Xiphias gladius (риба-меч) | Xip g 1.0101 | Парвальбумін | |
| Pleuronectiformes | Lepidorhombus whiffiagonis (мегрим) | Леп з 1,0101 | Парвальбумін |
| Лососеподібні | Oncorhynchus keta (тихоокеанський лосось) | Onc k 5.0101 | Вітеллогенін |
| Oncorhynchus mykiss (райдужна форель) | Onc m 1.0101Onc m 1.0201 | Парвальбумін | |
| Salmo salar (атлантичний лосось) | Саль 1,0101 | Парвальбумін | |
| Sal s 2.0101 | Енолаза | ||
| Саль 3.0101 | Альдолаза | ||
| Скорпаноподібні | Sebastes marinus (краснопірка) | Себ м 1.0101 | Парвальбумін |
| Себ м 1.0201 |
Рибні енолази та альдолази
Спочатку реакція IgE на рибу бета-енолазу та альдолазу була описана у одиночних риб (69–71). У 2013 р. 50 кДа енолази та 40 кДа альдолаз були визначені як важливі рибні алергени у трісці, лососі та тунці (таблиця (табл. 1) 1) (72). Обидва ферменти містяться в м’язах риб, оскільки вони беруть участь в метаболічному гліколізі, деградації цукру під час фізіологічного виробництва енергії.
У недавньому дослідженні зв’язування IgE з енолазами та альдолазами було виявлено у великої кількості хворих на алергію на рибу (72). У більшості пацієнтів, позитивних до енолази/альдолази, також були антитіла IgE до парвальбуміну. Обидва алергени були позитивними в аналізі вивільнення медіатора з використанням клітин базофільного лейкозу щурів, що експресують високоафінні людські рецептори IgE, пасивно сенсибілізовані сироватками пацієнта. Було виявлено, що вони чутливі до термічної обробки. Їх важливість як харчових алергенів досі недостатньо добре зрозуміла, особливо у пацієнтів з негативним парвальбуміном.
Рибний желатин
Актуальність рибного желатину як харчового алергену суперечливо обговорюється протягом багатьох років (4). Рибний желатин зазвичай використовують у харчових та фармацевтичних продуктах, замінюючи желатини ссавців (73).
Спочатку зв'язування IgE з рибним колагеном було показано у пацієнтів з алергією на рибу (74, 75). Пізніше поширеність алергії на рибний желатин була розглянута в одиничних клінічних дослідженнях (76, 77). В одному дослідженні шкірні тести на укол були позитивними у 3 з 30 хворих на алергію на тріску, тоді як харчові проблеми були позитивними у одного з трьох випробуваних пацієнтів. Також його ефективність як харчового алергену була продемонстрована у повідомленні про тяжку анафілаксію при прийомі солодощів, що містять кілька грамів рибного желатину (78). На сьогоднішній день не повідомляється про перехресну реактивність желатину ссавців та риб. Іншим фактором ризику рибного желатину є потенційне забруднення рибним парвальбуміном, оскільки він виробляється з риби як природного джерела. Насправді сліди парвальбуміну були виявлені в isinglass, харчовій добавці на основі рибного колагену (79).
Інші IgE-реактивні рибні білки
В останні десятиліття в численних дослідженнях повідомлялося про алергени, відмінні від парвалбуміну, які визначали за своєю молекулярною масою або визначали іншими методами. Хоча більшість досліджень показали реактивність IgE щодо цих білків, актуальність цих потенційних алергенів не розглядалася. Кілька алергенів (білок 63 кДа, додаткові IgE-реактивні білки) були описані для тріски, тоді як деякі були визначені як олігомери парвалбуміну (80). Крім того, алергени були ідентифіковані у риб-меч (25 кДа), вугра/вугрів (40 кДа), окуня (35–90 кДа), тунця/марліну (94–105 кДа), пухирців (46–50 кДа), тропічних риб (29 –54 кДа) та пангасіус/тилапія (18–45 кДа) (20–22, 64, 66, 81, 82). Потенційні алергени з відомою ідентичністю були виявлені в трісці (альдегідфосфат-ізомераза), лососі (триоза-фосфат-ізомераза, фруктоза-біс-фосфат-ізомераза, сироватковий альбумін) та тунці (креатин-кіназа, бета-енолаза) (70, 83, 84).
Два інших рибних алергени були зареєстровані в базі даних IUIS-алергенів (Таблиця (Таблиця1). 1). Наразі харчова алергія на ікру риби розглядалась у кількох дослідженнях. Вітеллогенін, білок жовтка риби, був визначений харчовим алергеном в ікрі різних риб (85, 86). У 2013 році тропоміозин, ниткоподібний м’язовий білок, був очищений, клонований та ідентифікований як рибний алерген у пацієнтів, чутливих до тилапії (87). Цей алерген тилапії виявив високу гомологію (88%) до гомолога людини. Було припущено, що він може брати участь в аутоімунній реакції запального захворювання кишечника, оскільки значна частина пацієнтів з IgE до тропоміозину страждала цим аутоімунним захворюванням.
Алергенність парвальбумінів
Протягом останніх десятиліть парвалбуміни, енолази, альдолази та рибний желатин були визначені як алергенні рибні білки. Поширені харчові алергени приписують специфічні властивості, такі як стійкість до станів шлунково-кишкового тракту та вплив умов переробки їжі (88). Наразі лише алергенність парвальбумінів характеризується більш докладно щодо їх алергенності, тоді як для інших алергенів ще потрібно зробити консолідовані висновки.
Парвальбуміни альфа- та бета-лінії
Порівняння лосося (> X97824,> X97825), форелі (> FN544258,> FN544259) та коропа (> P02618; 4cpv) парвалбумінів. (A) Обидві послідовності бета-1 лососевих парвалбумінів відрізняються від своїх гомологів N-кінцевою третиною білка, який не бере участі у зв’язуванні кальцію. Алергенний пептид специфічно розпізнається IgE у пацієнта, моносенсибілізованого до лососевих риб. Сірий, однакові залишки; червоний, змінні залишки. (B) Як стрічкові, так і поверхневі моделі показують, що алергенний пептид локалізований на поверхні парвалбумінів лосося та форелі бета-1. Сині, зв’язуючі кальцій ділянки; червоний, IgE епітоп.
Висновок
Протягом останніх десятиліть для рибної алергії було отримано важливе уявлення про клінічні та алергенні особливості: виявлено змінну алергенність серед парвалбумінів лосося (бета-1, бета-2), а також важливі нові рибні алергени (енолаза, альдолаза, риба желатин) були ідентифіковані. Ці результати допоможуть розробити нові імунотерапевтичні стратегії, але вони також показали, що клінічна картина алергії на рибу є більш складною, ніж передбачалося. Нові молекули повинні бути впроваджені в рутинні тести на основі IgE, щоб просунути діагноз та поради пацієнта.
Внески автора
Усі автори внесли свій внесок у розробку, розробку та розробку статті.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
Подяка
Декларація про всі джерела фінансування: ця робота була надана Міністерством досліджень, Люксембург.
- Вплив добавок до олії риби та криля на толерантність до глюкози у кроликів експериментально
- Кінцевий посібник з догляду за рибками «Дискус» Король акваріумного світу
- Повна стаття Фізіологія смаку у потенційних наслідків для риб для стимулювання годівлі та кишечника
- Чукчі - вступ, місце розташування, мова, фольклор, релігія, великі свята, обряди
- Обговорення звичок їжі риби Тварини