Регулятори моторики кишечника, виявлені за допомогою гнотобіотичної моделі взаємодії дієти та мікробіома, пов’язаної з подорожами
Нееленду Дей
1 Центр наук про геном та системну біологію, Медичний факультет Університету Вашингтона, Сент-Луїс, Міссурі, 63108, США
2 Центр мікробіомів та досліджень харчування кишечника, Медичний факультет університету Вашингтона, Сент-Луїс, MO 63108, США
3 Медичний факультет, Медична школа Вашингтонського університету, Сент-Луїс, Міссісісі 63108, США
Вітас Е. Вагнер
1 Центр наук про геном та системну біологію, Медичний факультет Університету Вашингтона, Сент-Луїс, Міссісісі 63108, США
2 Центр мікробіомів та досліджень харчування кишечника, Медичний факультет університету Вашингтона, Сент-Луїс, MO 63108, США
Лора В. Блантон
1 Центр наук про геном та системну біологію, Медичний факультет Університету Вашингтона, Сент-Луїс, Міссісісі 63108, США
2 Центр мікробіомів та досліджень харчування кишечника, Медичний факультет університету Вашингтона, Сент-Луїс, MO 63108, США
Джиє Ченг
1 Центр наук про геном та системну біологію, Медичний факультет Університету Вашингтона, Сент-Луїс, Міссісісі 63108, США
2 Центр мікробіомів та досліджень харчування кишечника, Медичний факультет університету Вашингтона, Сент-Луїс, MO 63108, США
Луїджі Фонтана
3 Медичний факультет, Медична школа Вашингтонського університету, Сент-Луїс, Міссісісі 63108, США
Рашидул Хаке
4 Центр харчування та продовольчої безпеки, Міжнародний центр досліджень діарейних захворювань, Дакка 1212, Бангладеш
Тахмед Ахмед
4 Центр харчування та продовольчої безпеки, Міжнародний центр досліджень діарейних захворювань, Дакка 1212, Бангладеш
Джеффрі Гордон
1 Центр наук про геном та системну біологію, Медичний факультет Університету Вашингтона, Сент-Луїс, Міссісісі 63108, США
2 Центр мікробіомів та досліджень харчування кишечника, Медичний факультет університету Вашингтона, Сент-Луїс, MO 63108, США
Пов’язані дані
РЕЗЮМЕ
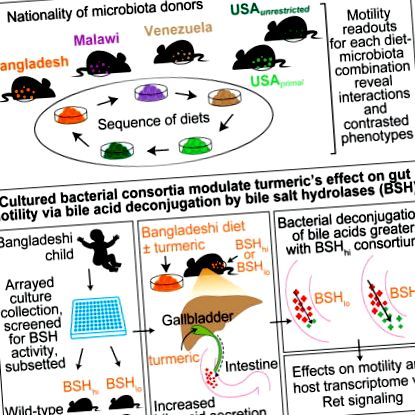
Щоб зрозуміти, як різні дієти, мікробіота кишечника споживачів та кишково-кишкова нервова система (ENS) взаємодіють для регулювання моторики кишечника, ми розробили модель гнотобіотичної миші, яка імітує короткочасні зміни в харчуванні, які трапляються, коли люди їдуть у місця з різними кулінарними традиціями . Вивчаючи тварин, яким трансплантували мікробіоти людям, що представляють кожну кухню, і годували послідовність дієт, що представляють дієти всіх донорів, ми виявили, що кореляція між чисельністю видів бактерій та часом транзиту залежить від дієти. Однак рівні некон'югованих жовчних кислот, що відображають активність мікробної солі жовчної гідролази, корелюють із швидшим транзитом через дієти, включаючи дієту Бангладеш. Миші, що містять консорціум послідовних бактеріальних штамів з мікробіоти донора Бангладеш і харчуються бангладешською дієтою, виявили, що часто використовувана пряність куркума уповільнює час транзиту. Куркума впливає на рухливість кишечника через бактеріальну декон'югацію жовчної кислоти та модуляцію сигналів Ret в ЕНС. Ці результати демонструють, як один харчовий інгредієнт взаємодіє з функціональною ознакою мікробіоти для регулювання фізіології господаря.
Графічний реферат
ВСТУП
На рухливість кишечника, ключовий фізіологічний параметр, що регулює травлення та засвоєння поживних речовин, впливає дієта (Cummings et al., 1976, 1978), мікроби кишечника (Husebye et al., 1994, 2001; Wichmann et al., 2013), кишкової нервової системи (ENS) (Edery et al., 1994; Romeo et al., 1994) та генетики господаря (Levy et al., 2000; Whorwell et al., 1986). В даний час ми не маємо детального розуміння складних та динамічних взаємозв’язків між цими факторами, особливо у глобальному контексті різноманітних культурних традицій, що стосуються харчових продуктів, їх методів приготування та різноманітної мікробіоти людської кишки, яка склалася в цих дієтичних умовах. Час кишкового транзиту, виміряний у> 1000 здорових осіб, що представляють різноманітні популяції у всьому світі, різнився в межах груп та між групами, що, ймовірно, відображає кульмінацію цих факторів (Burkitt et al., 1972). Поява незалежних від культури методів характеристики структури та виражених функцій мікробіоти кишечника створює можливість виявити нові підходи до розуміння моторики кишечника та оптимізації харчових переваг, отриманих з різних дієтичних практик.
РЕЗУЛЬТАТИ
Моделювання змін дієти та моторики, пов’язаних із глобальними подорожами людини у гнотобіотичних мишей
На першому плані хмари слів передають конкретні використовувані інгредієнти: розміри шрифтів зображують пропорційні зображення інгредієнтів на основі ваги в межах кожної дієти. Кругові діаграми на задньому плані представляють високомолекулярні композиції. Див. Також таблицю S1.
Об'єднання даних усіх тварин у всі часові моменти цього 6-фазного експерименту подорожей виявило нормальний розподіл часу транзиту (рис. 2С). Середня дисперсія між мишами протягом експерименту становила 27,7 хвилин, тоді як середня дисперсія між мишами в даний момент часу становила 29,3 хвилини. Повторні заходи ANOVA, в яких час транзиту був залежною змінною, продемонстрували, що дієта (p = 5,6 × 10 −5), мікробіота донора (p = 2,3 × 10 −3) та взаємодія дієти та мікробіоти (p = 2,6 × 10 −3) - усі суттєві фактори (таблиця S3A). Найбільш протилежний вплив дієти на мікробіоти на час транзиту був задокументований у мишей, колонізованих у Бангладеш, порівняно з необмеженою мікробіотою США, коли вони споживали бангладешські та первинні дієти (Рисунок 2D). Зокрема, миші, колонізовані з необмеженою мікробіотою США, мали значно швидшу рухливість (тобто менший час транзиту) при споживанні бангладешської дієти порівняно з первинною дієтою (p −5, F = 19,8, ANCOVA), хоча розмір ефекту та статистична значимість відмінностей у час транзиту варіюється від окремого донора мікробіоти (рис. S1B, таблиця S2B).
Співвідношення між відносною кількістю штамів бактерій кишечника та часом транзиту залежить від дієти
Щоб визначити взаємозв'язок між конкретними бактеріальними таксонами, дієтою та фенотипами часу транзиту, ми секвенували амплікони ПЛР, генеровані з області V4 бактеріальних генів 16S рРНК, присутніх у мікрофенолах калу, зібраних протягом 6-фазних та 3-фазних експериментів подорожей (984 зразки калу; 22 470 ± 630 зчитувань на зразок [середнє значення ± сем]; таблиця S4). Зчитування 16S рРНК було згруповано в оперативні таксономічні одиниці залежно від того, чи поділяють вони ≥97% ідентичності послідовності нуклеотидів (97% ID OTU). Аналіз основних координат (PCoA) на основі незваженої UniFrac, філогенетичної метрики, яка обчислює схожість між будь-якими двома мікробіоти на основі ступеня, в якому їх компоненти OTU ділять довжину гілок на бактеріальному дереві (Lozupone and Knight, 2005), показав, що збори громади були швидкий і високовідтворюваний у даній групі мишей, які отримували однакову донорську мікробіоту як в 6-фазному, так і в 3-фазному експериментах (рис. S2A, C).
Донор мікробіоти був переважаючим фактором, що пояснює дисперсію незважених відстаней UniFrac між зразками з різних експериментальних груп (p Рисунок 3; Таблиця S5). Ми вирішили застосувати алгоритм, що базується на дереві рішень, для вибору ознак (тобто, в даному випадку, найбільш дискримінаційних OTU), щоб нам не потрібно було робити будь-які припущення щодо розподілу щодо нашого набору даних про пропорційну кількість OTU. Модель, отримана із випадкових лісів, передбачала, яку дієту споживають у наступному експерименті з 3-фазними подорожами, із середньою точністю 83% ± 0,02% (діапазон 79% –86%; 10000 повторень), значно кращою за нульовий розподіл (p -16). Ці 87 OTU, що дискримінують дієту, не суттєво корелювали з часом транзиту в жодному з експериментів. В аналізі всіх 416 97% ID OTU з відносною чисельністю понад межу виявлення (0,01%) у зразках калу миші, зібраних протягом обох експериментів, лише один OTU, Parabacteroides gordonii (OTU ID 240), значно корелював після Корекція Бонферроні для багаторазових порівнянь, з часом транзиту в дуже контрастних комбінаціях дієти та мікробіоти (rho = 0,3, p = 0,02). Не повідомлялося, що цей організм пов’язаний зі зміною перистальтики кишечника у людей.
(A) Оцінені показники помилок поза мішками в моделі Random Forests для прогнозування дієти, стратифікованої донорською мікробіотою, як функція кількості дієтичних OTU. Для кожної мікробіоти було достатньо 40 ОТУ для дискримінації дієти, що дало загалом 87 унікальних ОТУ для шести донорів мікробіоти з п’яти культурних/дієтичних традицій у 6-фазному експерименті подорожей. (B) Докази стійкості дієтично-дискримінаційних ОТУ до донорської мікробіоти та фенотипу моторики. На цій тепловій карті представлені показники важливості 87 ОДТ, що дискримінують дієту, в кожному контексті дієти та мікробіоти. Розріджена модель випадкових лісів, побудована з використанням цих дискримінаційних OTU, що точно передбачають дієту в 3-фазному експерименті подорожей. Див. Також таблицю S5.
На відміну від цього, 27 ОТУ, присутні як в необмеженій США, так і в мікробіоті Бангладеш, мали значні кореляційні залежності від дієти з часом транзиту, задокументованим у контексті або бангладешської, або первинної дієти, але не обох (таблиця S3B). Взаємозв'язок бактерій із часом транзиту був специфічним для штаму: два штами Eubacterium desmolans (OTU ID 170124 та 158946) мали протилежні відносини з часом транзиту в межах споживання первинної дієти. Одиночна ОТУ, E. desmolans (OTU ID 158946), суттєво корелювала з часом транзиту в обох дієтах, але дивно, що кореляція була протилежною в контексті Бангладешського та первинного раціону (р -6, F = 9,6, взаємодія Е з тестуванням ANCOVA достаток десмоланів з дієтою). У необмеженому контексті дієти США ще одна OTU в США та в бангладешській мікробіоті (Clostridiales, OTU ID 261590) співвідносилася з часом транзиту (rho = -0,57, p = 0,04). Отже, гіпотетичний пробіотичний штам наступного покоління, призначений впливати на моторику, швидше за все, потребуватиме одночасного вживання певної дієти або дієтичного інгредієнта для здійснення його ефекту, подібно до того, як було продемонстровано, що мікроби, що надають худорлявість, передають свій фенотип залежно від дієти ( Рідаура та ін., 2013).
Профілювання метаболіту жовчної кислоти та аналіз 16S рРНК проводили на зразках фекалій, відібраних у мишей в експерименті з 3-фазної подорожі (рис. Кореляції рангу Спірмена розраховували між концентраціями жовчних кислот та відносною кількістю 97% ID OTU. Застосовано ієрархічну кластеризацію без нагляду. Значні асоціації (p −6, p −7 та p −5 для фаз дієти 1, 2 та 3 відповідно, двосторонній t-тест Стьюдента; таблиця S2C). Споживання куркуми було пов'язане із значним уповільненням моторики (тобто, більшим часом транзиту) (таблиця S2C). UPLC-MS зразків калу, зібраних у безмікробних мишей в кінці кожної фази дієти, показав, що прийом цієї холекінетичної прянощі був пов'язаний зі значно підвищеним рівнем таурогіодезоксихолевої кислоти (р = 0,003, однобічний t-тест Стьюдента) і тауро -сульфат морської кислоти (р = 0,03, однобічний t-тест Стьюдента) порівняно з періодом споживання дієти без доповнення (таблиця S6A). Як і слід було очікувати, жодної некон'югованої жовчної кислоти в групі, що не містить мікробів, не виявлено протягом жодної з фаз дієти. Ми включили стандарт куркуміну для кількісної оцінки рівня куркуміну в калі; однак куркумін не був виявлений у всіх зразках.
Вплив куркуми на експресію гена господаря
Взаємодія мікробіоти, жовчних кислот та ЕНС
Щоб оцінити, наскільки вплив куркуми на рухливість залежав від сигналізації на основі ENS (Alemi et al., 2013), ми звернулися до мишей гетерозиготних щодо нульового алелю рецептора Ret (Tsuzuki et al., 1995). Ret, який кодує трансмембранний білок, який пов'язує ліганди сімейства нейротрофічних факторів глійних клітин, є геном, найчастіше причетним до хвороби Гіршпрунга (Edery et al., 1994; Romeo et al., 1994), порушення розвитку, пов'язане з відсутністю перистальтики в дистальній частині товстої кишки. Хейкерот та його колеги повідомляють, що миші Ret +/− демонструють> 90% зменшення поздовжньої та кругової скорочувальної здатності м’язів кишечника та 70–95% зменшення вивільнення двох нейромедіаторів (речовини P та VIP), незважаючи на еквівалентну кількість кишкових нейронів (Gianino et al., 2003). Ми виявили, що миші дикого типу (Ret +/+), що вирощуються традиційно, мають значно повільніший час транзиту, ніж їх гетерозиготні (Ret +/−) однорозі (p = 0,05, однобічний t-тест Стьюдента; таблиця S2F).
ОБГОВОРЕННЯ
Інші дієтичні інгредієнти (наприклад, полісахариди (Kashyap et al., 2013)) та продукти бактеріального метаболізму (наприклад, бутират (Soret et al., 2010)) раніше були описані для впливу на рухливість моделей мишей. Населення, яке переживає зміну культурних/кулінарних традицій через подорожі, імміграцію чи еміграцію, сприйнятливі до помітних змін у мікробіоті кишечника, як структурних, так і функціональних, що може мати наслідки для здоров’я в подальшому. В принципі, наш підхід може бути використаний для ідентифікації та характеристики біологічної діяльності та взаємодії мікробіотичних складових харчових продуктів, характерних для дієтичних/культурних традицій, що склалися впродовж століть, але зараз вразливі до зменшення використання через західництво. Їх виключення із сучасної дієти може призвести до втрати ключових харчових інгредієнтів, які можуть бути використані для зміцнення здоров'я в сучасному суспільстві. Ці інгредієнти можуть також служити цінними інструментами для виявлення та характеристики механізмів взаємодії їжі та мікробіоти, впливаючи на різні особливості нашої фізіології.
ЕКСПЕРИМЕНТАЛЬНІ ПРОЦЕДУРИ
Вимірювання часу шлунково-кишкового транзиту з використанням нерассасывающегося червонокармінного барвника
Карміново-червоний (Sigma-Aldrich, Сент-Луїс, Міссурі) готували у вигляді 6% (мас./Об.) Розчину в 0,5% метилцелюлози (Sigma-Aldrich) та автоклавували перед ввезенням у гнотобіотичні ізолятори. Мишей підтримували строгий 12-годинний світловий цикл (світло світиться між 06:00 і 18:00) і давали 150 мкл розчину карміну між 08:00 і 08:30 за місцевим часом. Тварини не голодували заздалегідь. Фекалії збирали кожні 30 хвилин (до 8 годин з моменту пробірки) і наносили смуги на стерильну білу серветку, щоб визначити наявність червоного кармінного барвника. Час від дачі до первинної появи карміну в калі було записано як загальний час проходження кишки для цієї тварини.
Генерування клонованої колекції культур анаеробних штамів бактерій з калових мікробіоти здорової 24-місячної дитини з Бангладеш
Аналізи in vitro для декон’югації жовчних кислот
Основні моменти статті
На рухливість кишечника впливають різні комбінації мікробіоти кишечника за дієтою (81 символ)
Куркума уповільнює рухливість мишей-гнотобіотиків за допомогою бангладешської мікробіоти/дієти (80 символів)
Ефект куркуми включає секрецію/декон'югацію жовчної кислоти та сигналізацію Ret (78 символів)
Гнотобіотичні миші можуть визначати ключові взаємодії між традиційними продуктами та мікробіотою (85 символів)
- Ожиріння та чорношкірі жінки Особливі міркування, пов'язані з генезисом та терапевтичними підходами
- Наомі Кемпбелл показала, що їсть щодня лише одну їжу, щоб зберегти свій худий подіум
- Переваги кверцетину, побічні ефекти, дозування та взаємодія
- Російська модель Playboy, яка обурила Дубай, бовтаючись з хмарочоса на фотографіях, що кидають виклик смерті
- На рухливість і морфологію сперми впливає індекс маси тіла