Веселкова форель, генетично відібрана для збільшення вмісту жиру в м’язах, підвищує активацію сигналізації TOR печінки та експресію ліпогенних генів
Unité Mixte de Recherches 1067 Nutrition Aquaculture and Génomique, Institut National de la Recherche Agronomique, Pôle d'hydrobiologie, 64310 Saint Pée-sur-Nivelle, Франція
Адреса для запитів на передрук та іншої кореспонденції: S. Skiba-Cassy, UMR 1067 Nutrition, Aquaculture & Génomique, Institut National de la Recherche Agronomique, Pôle d'hydrobiologie, 64310 Saint-Pée-sur-Nivelle, Франція (електронна пошта: [ захищений електронною поштою]).
Unité Mixte de Recherches 1067 Nutrition Aquaculture and Génomique, Institut National de la Recherche Agronomique, Pôle d'hydrobiologie, 64310 Saint Pée-sur-Nivelle, Франція
Unité Mixte de Recherches 1067 Nutrition Aquaculture and Génomique, Institut National de la Recherche Agronomique, Pôle d'hydrobiologie, 64310 Saint Pée-sur-Nivelle, Франція
Unité Mixte de Recherches 1067 Nutrition Aquaculture and Génomique, Institut National de la Recherche Agronomique, Pôle d'hydrobiologie, 64310 Saint Pée-sur-Nivelle, Франція
Анотація
управління відкладенням жиру є значним викликом як для здоров'я людини, так і для розведення сільськогосподарських тварин. У людей ожиріння, виражене як надмірне розширення жирової тканини, часто асоціюється з розвитком метаболічних розладів, які стають дедалі поширенішими у всьому світі і, як прогнозується, значно зростуть протягом наступних 10 років (50). Управління відкладенням жиру у сільськогосподарських тварин, включаючи рибу, також стало надзвичайно важливим, особливо з точки зору якості м'яса, оскільки зберігання ліпідів у скелетних м'язах впливає на харчову цінність та сенсорні властивості м'яса (49).
Генетичний відбір часто застосовувався у сільськогосподарських тварин для управління вмістом жиру в організмі (7а, 24), але рідко застосовувався в аквакультурі. Нещодавно було розроблено дві експериментальні лінії райдужної форелі шляхом дивергентного відбору з низьким або високим вмістом жиру в м’язах із застосуванням неруйнівного методу вимірювання на живій рибі (36). Генетичний відбір високого вмісту жиру в м’язах не впливає на споживання корму, і подібний вміст жиру у всьому тілі було зафіксовано у двох лініях 80-грамової риби, яку годували однаковою дієтою (20). Метаболічна характеристика ліній змусила авторів припустити, що лінії представляють відмінності у використанні джерел енергії із зменшеним окисленням печінкової жирної кислоти та посиленим використанням глюкози як у печінці, так і в м'язах риб у жировій м'язовій лінії (FL) порівняно з м'яза лінія м'язів (LL) (20, 21). Оскільки інсулін контролює метаболізм глюкози та ліпідів, ми припустили, що шляхи інсуліну могли вплинути на генетичний відбір вмісту м'язового жиру.
Експериментальна процедура та процедура відбору проб.
Таблиця 1. Формула та аналітичний склад дієти
Рівні метаболітів у плазмі.
Рівні глюкози в плазмі, триацилгліцерину (TG) та вільних жирних кислот (FFA) вимірювали за допомогою глюкози RTU (BioMerieux, Marcy l'Etoile, Франція), PAP 150 (Biomérieux, Marcy-l'étoile, Франція) та наборів NEFA C (Wako Chemicals, Neuss, Німеччина) відповідно відповідно до рекомендацій кожного виробника.
Екстракція білка та Вестерн-блот.
Аналіз експресії генів: RT-PCR у реальному часі.
Загальні зразки РНК витягували із -80 ° C замороженої печінки риби, що голодувала, та риби, що перегорталася на 8 і 24 години, за допомогою реагенту Trizol (Invitrogen, Карлсбад, Каліфорнія) відповідно до рекомендацій виробника. Одна мікрограма отриманої загальної РНК була зворотно транскрибована в кДНК за допомогою набору SuperScript III RNaseH- зворотної транскриптази (Invitrogen) та випадкових праймерів (Promega, Charbonnières, Франція) відповідно до інструкцій кожного виробника. Рівні експресії цільових генів визначали за допомогою кількісної RT-PCR у реальному часі, використовуючи специфічні праймери ПЛР у реальному часі (табл. 2). Щоб уникнути ампліфікації геномної ДНК, пари праймерів включали один, що охоплює інтрон, олігонуклеотид, коли це можливо. Різні продукти ПЛР спочатку перевіряли шляхом секвенування, щоб підтвердити природу амплікона.
Таблиця 2. Послідовності праймерів
F, пряма грунтовка; R, зворотна грунтовка; nt, нуклеотиди. Приєднання до GenBank або приєднання Sigenae No. має такий вигляд: коефіцієнт подовження-1α (EF1α), AF498320; глюкокіназа (GK), AF135403; піруваткіназа (PK), AF246146; фосфоенолпіруваткарбоксикіназа (PEPCK), AF246149; глюкоза 6-фосфатаза 1 (G6Pase1), tcay0019b.d.18_3.1.s.om.8.1-1693; G6Pase2, AF120150; сериндегідратаза (SD), tcay0007b.b.13_3.1.s.om.8; синтаза жирних кислот (FAS), tcab0001c.e.06_5.1.s.om.8; АТФ-цитратна ліаза (ACLY), CA349411.1; глюкозо-6-фосфатдегідрогеназа (G6PDH), CA351434; карнітинпальмітоїлтрансфераза 1a (CPT1a), AF 327058; CPT1b, AF606076.
Ефективність ПЛР (Е) вимірювали як нахил стандартної кривої з використанням послідовного розведення кДНК, і всі значення були вище 1,9.
Статистичний аналіз.
Таблиця 3. Основні особливості райдужної форелі з ФЛ та ЛЛ
Значення є середніми ± SE (n = 3). FL і LL, жирові та сухі м’язові лінії риби; WW, волога вага.
Рис. 1.Рівень глюкози, вільних жирних кислот (FFA) та триацилгліцерину (TAG) у плазмі у рибі з жиру (FL) та пісних ліній (LL) через 3, 8 та 24 години після годування (0 відповідає рибі, що голодує). Дані є середніми ± SE 9 зразків. P значення часу, лінії та ефекту взаємодії вказані на правильно. *P
Сигнальний шлях Akt/TOR.
Рис.2.Вестерн-блот-аналіз Akt, мішені рапаміцину (TOR), p70 рибосомної S6 протеїнкінази 1 (S6K1) та фосфорилювання білка S6 у печінці форелі райдужної форелі натощак та на 3 години з FL та LL. P-Akt, P-TOR, P-S6K1 та P-S6, фосфорильовані форми Akt, TOR, S6K1 та S6, відповідно. На гель завантажували двадцять мікрограмів загального білка на доріжку. Показана репрезентативна пляма. Вестерн-блотування проводили на 6 окремих зразках, які дали подібні результати.
Рис.3.Вестерн-блот-аналіз фосфорилювання білків Akt, TOR, S6K1 та S6 у 3-годинній печінці райдужної форелі від FL та LL. На гель завантажували двадцять мікрограмів загального білка на доріжку. Показана репрезентативна пляма. Вестерн-блотування проводили на 6 окремих зразках, які дали подібні результати. Графіки представляють співвідношення між фосфорильованим білком і загальною кількістю цільового білка. Дані фосфорилювання білка є середніми значеннями ± SE (n = 6) і були проаналізовані за допомогою непараметричних тестів Манна-Уітні. *P
Рівні РНК месенджера генів-мішеней.
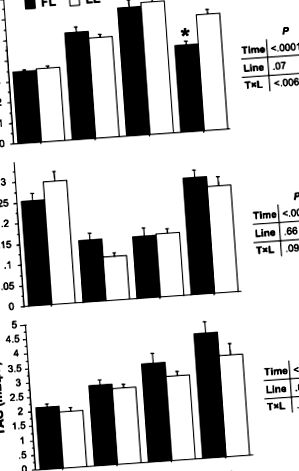
Рис.4.Експресія генів виділених ферментів у печінці голодної форелі натощак (відкриті батончики) та цілодобово (наповнені батончики) форелі від FL та LL. Глюкокіназа (GK), піруваткіназа (PK), ізоформи 1 і 2 глюкози-6-фосфатази (G6Pase1 і G6Pase2), фосфоенолпіруват-карбоксикіназа (PEPCK), сериндегідратаза (SD), АТФ-цитратна ліаза (ACLY), жирна кислота синтетаза FAS), рівні глюкозо-6-фосфатдегідрогенази (G6PDH), карнітинпальмітоїлтрансферази 1 (CPT1a та CPT1b) та рівні мРНК, що реагують на білок, що реагує на стероли (SREBP1), оцінювали за допомогою RT-PCR у реальному часі. Значення виразу нормуються за допомогою транскриптів, висловлених фактором подовження-1α (EF1α). Результати є середніми + SE (n = 6) і були проаналізовані за допомогою двосторонньої ANOVA з подальшим тестом Стьюдента-Ньюмена-Кілса для множинного порівняння. *P
Метою цього дослідження є досягнення більш глибокого розуміння молекулярних механізмів, що призводять до накопичення м'язового жиру, шляхом порівняння рибних ліній, вибраних для низького та високого вмісту жиру в м'язах. Наше дослідження було зосереджене на сигнальних шляхах інсуліну/поживних речовин як головному регуляторі метаболізму та вивчило експресію декількох генів-цільових метаболізму.
У рядках, випущених із третього покоління, було представлено однаковий вміст жиру у всьому тілі, але різний вміст м’язового жиру (20). Продовження процедури відбору (четверте покоління відбору) збільшило розбіжність у рівні м’язового жиру, що призвело до збільшення вмісту жиру в усьому тілі. Відсутність різниці в жировій тканині черевної порожнини, яка є переважним місцем зберігання жиру в лососевих, відрізняє цю модель від інших моделей сільськогосподарських тварин, отриманих шляхом генетичного відбору, що в цілому призводило до загального збільшення жиру в різних відділах тіла ( 38). У цьому дослідженні збільшення ожиріння м’язів у риб з FF не було зумовлене більш високими темпами росту чи кращою ефективністю корму. Крім того, генетичний відбір збільшив приріст жиру без супутнього зменшення надходження азоту.
Хижа риба, така як райдужна форель, характеризується обмеженою здатністю ефективно використовувати дієтичні вуглеводи (48) і, отже, вважається «непереносимою глюкозою» (10а, 24а). Пероральне або внутрішньовенне введення глюкози та збагачена вуглеводами дієта призводять до стійкої гіперглікемії у різних видів риб, включаючи веселку (5, 7, 22a, 26a, 31). Порівняння рівнів глюкози в плазмі двох ліній показало, що риби з FL, здавалося, мають кращу здатність керувати рівнями глюкози в плазмі після їжі, ніж риби LL. Глікемія залишалася суттєво підвищеною у риб LL через 24 год після годування, тоді як вона зменшилася у риб FL, досягнувши рівнів, подібних до тих, що вимірювались у риб, що голодували 48 годин. Цей результат підкріплює гіпотезу про те, що різнобічний відбір за вмістом м’язового жиру у форелі змінив механізми використання палива, особливо здатність риб використовувати глюкозу.
Гомеостаз глюкози є результатом балансу між використанням глюкози шляхом гліколізу та виробленням глюкози через глюконеогенез та глікогеноліз. Дослідження експресії генів GK і PK показало, що гліколітичний шлях не був диференційовано регульований між лініями. Це слід підтвердити аналізом всього гліколітичного потоку як на молекулярному, так і на клітинному рівні. Порушення пригнічення після їжі ендогенного вироблення глюкози в печінці є метаболічною особливістю райдужної форелі (27–29, 46). Це дослідження ще раз підтвердило, що на глюконеогенез лише незначно впливає підживлення у райдужній форелі, оскільки з трьох досліджених глюконеогенних генів (2 ізоформи G6Pase та PEPCK) лише перша ізоформа G6Pase була знижена через 24 години після підгодівлі. Аналіз двох ізоформ G6Pase підтвердив, що у риб різні копії гена, що виникли в результаті події розмноження геному, могли еволюціонувати окремо і набувати різних зразків експресії, як повідомлялося раніше для про-опіомеланокортину (22). Щодо цих ферментів, риби FL та LL реагували аналогічно на повторне годування, припускаючи, що ендогенне вироблення глюкози не відповідає за стійкість підвищеного рівня глюкози в плазмі протягом 24 годин після згодовування у риб LL.
Нарешті, ми також продемонстрували, що мРНК CPT1b була менш представлена в печінці FL, ніж риба LL. Однак, оскільки ізоформа була однаково виражена в обох лініях, а активність CPT1 не вимірювалась у цьому дослідженні, ми не можемо чітко зробити висновок, що риби LL мають посилену здатність використовувати жирні кислоти як джерело енергії, хоча наші результати частково підтверджують отримані від риби, що походить з попереднього покоління селекції (20).
Перспектива та значення
ПОДЯКИ
Ми вдячні М. Дж. Бортеру, Е. Планьєс-Жуану, К. Вашо і Ф. А. Пуджаде за технічну допомогу, а також технічному персоналу Інституту національної дослідної агрономіки (INRA) експериментальних установ Pisciculture Expérimentale INRA des Monts d'Arrée (Drennec, Sizun, Франція).
- Активізація м’язів та набір м’язів Делос Терапія
- Огляд Цілі харчування - KAGED MUSCLE
- PRIME PubMed Вплив шини Есмарха на жування та активність м’язів язика під час сну
- Відгуки про NutraVesta ProVen - Що слід знати перед покупкою - СПОНСОРОВАНИЙ ЗМІСТ Гість
- Вміст Шукранлілли - Сторінка 64