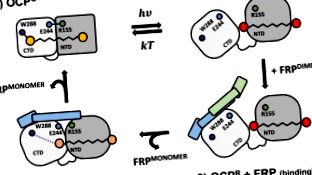
Пурпуровий мутант Trp288Ala Synechocystis OCP наполегливо гасить флуоресценцію фікобілісоми і щільно взаємодіє з FRP
Додати до Менділі
Основні моменти
OCP W288A здатний гасити флуоресценцію PB.
Механізми загартування PB за допомогою OCP R та OCP W288A еквівалентні.
Як і OCP R, OCP W288A зв'язується з FRP зі стехіометрією 1: 1.
Зв'язування FRP вимагає його мономеризації; спричиняє ущільнення та “оранжування” OCP W288A .
FRP, здається, функціонує як адаптер або білок каркаса щодо OCP.
Анотація
У ціанобактеріях апельсиновий каротиноїдний білок (OCP) та білок для відновлення флуоресценції (FRP) мають центральне значення для фотозахисного механізму, що полягає у регульованому гасінні флуоресценції фікобілісоми (PB). Через тимчасовий та гнучкий характер світлоактивованої червоної загартувальної форми OCP R, яку отримують із стабільної темно адаптованої оранжевої форми OCP O, шляхом фотоконверсії, детальний механізм фотозахисту залишається незрозумілим. Тут ми демонструємо, що наш нещодавно описаний мутант W288A Synechocystis OCP (далі - OCP W288A) є повністю функціональним аналогом форми OCP R, яка здатна до загасання флуоресценції PBs in vitro без необхідності фотоактивації. Цей ефект гасіння PB скасовується у присутності FRP, який взаємодіє з OCP W288A з мікромолярною спорідненістю та видимою стехіометрією 1: 1, несподівано, що означає дисоціацію димерів FRP. Це створює OCP W288A як надійну модельну систему, що забезпечує нові уявлення про взаємодію між OCP та FRP для регулювання фотозахисту у ціанобактерій.
Графічний реферат
- Завантажити: Завантажити зображення з високою роздільною здатністю (147 КБ)
- Завантажити: Завантажте повнорозмірне зображення
Попередній стаття у випуску Далі стаття у випуску
- Yunnan Jinggu Ziya puer 100г Сира чаша міні-чай фіолетовий чай для схуднення, догляд за шкірою зелена їжа
- Zijian, фіолетовий чай, чайні продукти для схуднення Puerh, Китай zijuan, фіолетовий чай, чай для схуднення Puerh
- Юньнань чорний фіолетовий чай пуер, Китай коричневий чай для схуднення Ziya догляд за красою гомілка, вид китайський
- Хірургія зниження ваги - Центр передового досвіду баріатричної хірургії - Бронкс, Нью-Йорк -
- Відповідь Алі Федотовському; Вразливий пост про її тіло після немовляти був неймовірно потужним