Позаклітинні везикули жирової тканини - потенційна роль ожиріння та діабету 2 типу?
Сюань Гао
1 Інститут серцево-судинних та медичних наук, Університет Глазго, Глазго, Великобританія
Карлос Саломон
2 Лабораторія біології екзосом, Центр клінічної діагностики, Центр клінічних досліджень Квінслендського університету, Королівський Брісбен та жіноча лікарня, Університет Квінсленда, Брісбен, QLD, Австралія
3 Фармацевтичний факультет, кафедра клінічної біохімії та імунології, Університет Консепсьона, Консепсьйон, Чилі
4 Материнсько-фетальна медицина, Кафедра акушерства та гінекології, Фонд клініки Охснера, Новий Орлеан, Лос-Анджелес, США
5 Mater Research Institute-University of Queensland, Translational Research Institute, Woolloongabba, QLD, Австралія
Діліс Дж. Фрімен
1 Інститут серцево-судинних та медичних наук, Університет Глазго, Глазго, Великобританія
Анотація
Вступ
Протягом останніх декількох десятиліть функція жирової тканини та адипоцитів була широко досліджена через їх центральну роль в енергетичному гомеостазі, ожирінні та діабеті (1, 2). Відкриття адипокінів призвело до визнання ключової ролі продуктів секреції жирової тканини в опосередкуванні наслідків надлишкового накопичення жирової тканини та її більш широкої ролі в обміні речовин. Зовсім недавно секреція жирової тканини позаклітинних везикул (ЕВ) та їх потенційна роль у регуляції метаболізму та розвитку інсулінорезистентності (ІР) та діабету 2 типу стали предметом розслідування. У цій статті буде розглянуто наявні дані про природу ЕВ, що виробляється складовими частинами жирової тканини, та їх потенційний локальний та віддалений вплив на кінцеві органи.
Позаклітинні везикули - це сферичні везикули із зовнішнім ліпідним бішаром, які вивільняються майже з усіх живих клітин від бактерій до багатоклітинних організмів (3). EV класифікуються відповідно до їх розміру та шляху, за допомогою якого вони були утворені (тобто ендоцитарної або плазматичної мембрани). Електромобілі групуються за розміром та походженням як екзосоми (
40–100 нм), мікровезикули (
100–1000 нм), а також апоптотичні тіла (
Структура і функції жирових тканин
Види жирової тканини
Біла жирова тканина людини розподілена по всьому тілу, основні депо класифікуються як підшкірна жирова тканина та вісцеральна жирова тканина (7). Вісімдесят відсотків білої жирової тканини знаходиться в підшкірному відділі, а до 10–20% - у вісцеральному відділі, головним чином навколо брижі та сальника (7). Також є невелика кількість жирової тканини, розташованої навколо кровоносних судин (периваскулярна жирова тканина) та в печінці, м’язах, суглобах та кістковому мозку. У той час як підшкірна жирова тканина функціонує переважно доброякісно як депо для зберігання надлишку жирних кислот, вісцеральна жирова тканина тісніше пов'язана з несприятливим метаболічним та запальним профілем, який спостерігається у осіб із ожирінням та ІЧ (8–10). Запаси коричневої жирової тканини значні у гризунів, але у людей в основному є лише у немовлят або дорослих, які пройшли адаптацію до холоду (11). Коричнева жирова тканина сприяє не тремтячому термогенезу за допомогою експресії роз’єднуючого білка 1 в його мембранах мітохондрій і може відігравати важливу роль в енергетичному гомеостазі (12). Біла жирова тканина може бути індукована для вираження деяких особливостей коричневої жирової тканини, а отримані адипоцити називаються бежевими (13).
Клітинний склад жирової тканини
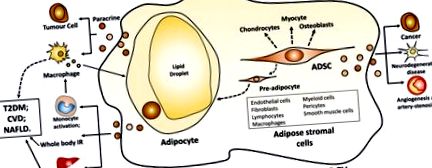
Жирова тканина містить адипоцити та стромальні клітини, отримані з жиру (рис. (Рис. 1). 1). Адипоцити - основний тип клітин жирової тканини. Надлишок калорій, як жирні кислоти, зберігається в краплях ліпідів у межах адипоцитів у вигляді тригліцеридів. У постпрандіальний період новоутворені менші адипоцити більш жахливо поглинають вільні жирні кислоти, що виділяються з циркулюючих тригліцеридів у ліпопротеїнах плазми ліпопротеїновою ліпазою, що призводить до утворення більших адипоцитів (14). Жирові стромальні клітини містять попередні адипоцити, ендотеліальні клітини, фібробласти, лімфоцити, макрофаги, мієлоїдні клітини, перицити, гладком’язові клітини та мезенхімальні стромальні стовбурові клітини (15). Жирові стромальні клітини підтримують проліферацію та диференціювання преадипоцитів до адипоцитів in vivo та in vitro і секретують різноманітні цитокіни та фактори росту, що чинять потенційні паракринні ефекти (15). похідні жирової тканини мезенхімальні стовбурові клітини (ADSC) мультипотентні і можуть диференціюватися на адипоцити, остеобласти, хондроцити та міоцити (16).
Білі адипоцити та EV, отримані з ADSC. Скорочення: EV, позаклітинна везикула; ADSC, мезенхімальні стовбурові клітини, отримані з жирової тканини; ІЧ, інсулінорезистентність; TGF, трансформуючий фактор росту; T2DM, цукровий діабет 2 типу; ССЗ, серцево-судинні захворювання; НАЖХП, неалкогольна жирова хвороба печінки.
Розширення жирових тканин
Коли люди страждають ожирінням, надмірне споживання калорій зберігається у вигляді тригліцеридів у адипоцитах білої жирової тканини. Якщо є недостатня ємність у зрілих адипоцитах, нові адипоцити утворюються з попередніх адипоцитів, щоб збільшити ємність зберігання (17). Формування адипоцитів (адипогенез) відбувається у дві фази (18). Перша фаза адипогенезу білої жирової тканини спрямована на диференціацію та передбачає вироблення виділених білих попередніх адипоцитів із мезенхімальних стовбурових клітин. Після здійснення преадипоцити втрачають свою мульти-потенцію і можуть лише диференціюватися в адипоцити або проліферувати. Кінцева диференціація з утворенням зрілих білих адипоцитів призводить до характерного вигляду зрілого адипоцита, що містить одну єдину краплю ліпідів, яка займає майже весь простір всередині клітини. Подібним чином диференціація коричневої жирової тканини включає стадію диференціювання, за якою слід кінцева стадія диференціації (18).
У деяких індивідуумів існує обмежена здатність виробляти зрілі адипоцити з попередніх адипоцитів (гіперплазичне розширення адипоцитів), і замість цього надлишки жирних кислот зберігаються в існуючих зрілих адипоцитах, що призводить до збільшення їх розміру (гіпертрофічне розширення) (19). Більші адипоцити, як правило, є більш дисфункціональними, і вони стають резистентними до інсуліну, що призводить до посилення ліполізу завдяки стійкості до антиліполітичних ефектів інсуліну (8). Збій ангіогенезу та забезпечення адекватного кровопостачання гіпертрофічних адипоцитів призводить до некрозу, інфільтрації макрофагів у жирову тканину та запалення та вивільнення адипокіну. «Розливання» жирних кислот, які неможливо утримувати в підшкірних адипоцитах, призводить до збільшення вісцерального жирового відділу і, зрештою, припливу жирних кислот до ектопічних ділянок, що зберігаються у вигляді внутрішньоклітинних крапель ліпідів у тканинах, таких як печінка та підшлункова залоза. Утворення позаматкового жиру тісно пов’язане з розвитком ІР та T2DM, і особи з обмеженою можливістю розширення адипоцитів, такі як південноазіатці, мають підвищений ризик діабету 2 типу (20).
Електромобілі з адипоцитів
Склад ЕД адипоцитів
Миші коричневих адипоцитів продукують екзосоми, і їх продукція збільшується за допомогою обробки цАМФ (цАМФ - другий вісник, викликаний холодним впливом та β-адренергічною стимуляцією) (31). Продукція екзосоми адипоцитів бежевого, але не білого кольору була збільшена майже в 11 разів завдяки обробці цАМФ (31). Коли вся жирова тканина миші була піддана холоду, продукція екзосом також збільшувалася (31). Профілювання мікроРНК екзосом, продукованих мишачими бурими адипоцитами, визначило miR-92a як специфічний маркер, який був знижений при холодному впливі (31). Годування мишей дієтою з високим вмістом жиру спричиняє відбілювання коричневої жирової тканини та збільшення рівня miR-92a в сироватці, тоді як вплив холоду асоціюється зі зниженням рівня miR-92a в сироватці. У худих людей, активність яких коричневої жирової тканини оцінювали за міченим поглинанням глюкози, існувала негативна кореляція між активністю коричневої жирової тканини та рівнем miR-92a в сироватці крові (31). Крім того, у 10 людей, які протягом 10 днів піддавались холодній акліматизації, кількість сироватки miR-92a зменшилася, а зміна рівнів miR-92a корелювало зі зміною активності коричневої жирової тканини.
Функції ЕВ, похідних від жирової тканини
Адипоцити можна знайти в мікросередовищі пухлини, і було показано, що вони сприяють прогресуванню пухлини (34). Ожиріння є фактором ризику меланоми та її злоякісного прогресування. У дослідженні екзосом підшкірних адипоцитів людини, виділених диференціальним ультрацентрифугуванням (35), існувала кореляція між випаданням екзосом жирової тканини та ІМТ донора. При використанні в рівних концентраціях екзосоми від донорів із надмірною вагою та ожирінням збільшували міграцію меланоми більше, ніж екзосоми від худих особин залежно від дози (35). Вважалося, що цей ефект опосередковується за допомогою окислення жирних кислот, оскільки інгібування етомоксиром зворотно впливає (35). Цікаво, що екзосоми, вироблені зрілими адипоцитами 3T3-F442A, були виявлені за допомогою мас-спектрометрії, що містять велику кількість білків, що беруть участь у метаболізмі ліпідів, особливо тих, що беруть участь в окисленні жирних кислот (35).
Адипоцити EV та метаболічний статус всього тіла
Кількість вісцеральної, але не підшкірної ЕВ, отриманої з жирової тканини ex vivo на грам жиру, кількісно виміряна проточною цитометрією, корельована з HOMA-IR у всьому тілі (але не з індексом маси тіла або рівнями hsCRP) у пацієнтів (n = 11) з аневризмою аорти, у якої були зібрані біопсії жирової тканини (21). У подібному дослідженні ЕВ підшкірної жирової тканини, вироблені з 16 осіб, обернено корелювали з обхватом талії та наявністю метаболічного синдрому, тоді як ЕВ вісцеральної жирової тканини позитивно корелювали з ферментами печінки плазми (24).
Циркулюючі жирові мікрочастинки, визначені наявністю периліпіну А, від мишей ob/ob призвели до активації моноцитів у циркуляції та жировій тканині мишей дикого типу (32). Периліпін А-позитивні ЕВ є вищими у мишей з ожирінням, спричиненим дієтою, та у людей з метаболічним синдромом (39). У людей циркулюючий периліпін А-позитивний EV може бути зменшений за допомогою 3-місячного низькокалорійного дієтичного втручання. Використовуючи FABP-4 як маркер циркулюючих екзосом, отриманих адипоцитами, оцінювали зміну профілю екзосоми мікроРНК, отриманого адипоцитами, через рік після шунтування шлунка (40). Спостерігалися зміни в профілі miRNA, які передбачалося регулювати сигнальний шлях інсуліну, і ступінь зміни пов'язаного профілю miRNA корелювала як зі зміною IR, як оцінювали HOMA, так і зі зміною рівня плазмових рівнів амінокислот з розгалуженим ланцюгом (40).
Мезенхімальні стовбурові клітини, отримані з жирових тканин (ADSC)
Існує великий інтерес до жирової тканини як джерела стовбурових клітин для регенеративної медицини для використання при раку та інших захворюваннях. Сприятливі ефекти такого лікування можуть бути результатом паракринних ефектів ADSC, опосередкованих EV. Показано, що екзосоми, вироблені ADSC, виділеними з жирової тканини людини, містять невеликі види РНК, переважно мікроРНК та сноРНК, з деякими доказами збагачення видів тРНК (44). Здається, що вміст відображає не просто вихідний клітинний вміст, а те, що деякі види РНК переважно виділяються (44). Є дані про те, що секреторний профіль білка ADSC відрізняється від індивіда до індивідуума, і це підвищує ймовірність того, що ADSC включає гетерогенну популяцію клітин функціонально різних підтипів і може продукувати відповідний EV (45). Існують також дані, що дозволяють припустити, що функціональні аспекти ADSC відрізняються від стовбурових клітин, отриманих з інших тканин (46). Електромобілі з ADSC розглядалися як шлях доставки терапевтичної міРНК до хворих клітин.
ADSC EV у раку
Мезенхімальні стовбурові клітини, отримані з жирової тканини, були виділені з черевного жиру у пацієнтів, які перенесли неопластичну урологічну операцію, та у учасників без раку (47). Профілювання мікроРНК екзосом із цих ADSC показало, що як у онкологічних, так і у онкологічних хворих вміст деяких екзосом та ADSC міРНК був подібним. Однак виявилося селективне збагачення деяких miРНК (let-7-a-1, miR-21 та miR-1260b) в екзосоми (47). ADSC, трансфікований експресіями експресійної плазміди miR-122, екзосом, що містять miR-122. Коли екзосоми, що містять miR-122, додавали до клітин гепатоцелюлярної карциноми, клітини ставали чутливими до хіміотерапевтичних препаратів (48). Крім того, внутрішньопухлинне введення трансфікованих екзосом ADSC EV підвищило ефективність протиракового агента на гепатоцелюлярну карциному на моделі мишей in vivo (48). Також було показано, що екзосоми ADSC сприяють міграції клітинної лінії раку молочної залози (MCF7) (49).
ADSC EV при судинній хворобі
Рестеноз венозних трансплантатів є особливою проблемою при операціях шунтування коронарних артерій. ADSC використовували для спроби зменшити неоінтимальну гіперплазію у трансплантатах вен. Показано, що ADSC людини за допомогою культури клітин in vitro та на моделі миші зменшує утворення неоінтіми трансплантата вен шляхом інгібування проліферації та міграції клітин гладком’язових клітин судин та зменшення міграції та запалення макрофагів (53). ADSC також пригнічує активацію, диференціювання та проліферацію Т-клітин (54). У свинячій моделі метаболічного синдрому та стенозу ниркової артерії лікування аутологічним ЕВ від ADSC призвело до зменшення запалення нирок та збільшення кровотоку в нирках та швидкості клубочкової фільтрації (55). Інші виявили, що комбіноване лікування ADSC плюс екзосоми, отримані з ADSC, має чудову здатність захищати нирку від гострої ішемії-реперфузійної травми у щурів на порівнянні з будь-якою окремо (56).
ADSC та нейродегенеративні захворювання
ADSC також представляють інтерес для лікування нейродегенеративних розладів, таких як бічний аміотрофічний склероз (57). Екзосоми мишачого ADSC захищають моторні нейроноподібні клітини NSC-34 від окисних пошкоджень, збільшуючи їх життєздатність (57), а також екзосоми ADSC людини захищають нейрони від індукованого глутаматом пошкодження (58). Інші показали на мишах in vitro, що нановезикули та мікровезикули ADSC запобігали апоптозу в клітинах нейронів та посилювали ремієлінізацію на зрізах мозочка, демієлінованих за допомогою лізофосфатидилхоліну (59). Знову ЕВ розглядали як засіб доставки з терапевтичними наслідками для нейродегенеративних захворювань. ADSC секретує екзосоми, що містять неприлізин, основний фермент, що розщеплює β-амілоїдний пептид, і екзосоми здатні доставляти цей білок до клітинної лінії нейробластоми (N2a), що призводить до зменшення секретованого та внутрішньоклітинного β-амілоїдного пептиду (60). Отже, існує терапевтичний потенціал для такого ЕВ при хворобі Альцгеймера. Крім того, було показано, що екзосоми з ADSC мають терапевтичний потенціал у in vitro моделі нейрональних клітин миші хвороби Хантінгтона (61).
Висновок
Внески автора
XG переглянув літературу, написав перший проект і створив малюнок. CS перевірив статтю на предмет точності як експерт з електромобілів та відредагував остаточний проект. DF переглянув літературу, написав остаточний проект та вніс редакційні зміни.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
Подяка
Ми вдячні за фінансування з таких джерел: Diabetes UK 15/0005182, Lions Medical Research Foundation (LMRF), Університет Квінсленда та Fondo Nacional de Desarrollo Científico y Tecnológico (FONDECYT 1170809).
- Чи може ця хірургія для схуднення вилікувати цукровий діабет типу 2 для просунутих лапароскопічних партнерів?
- Експериментальна харчова алергія призводить до запалення жирової тканини, системних метаболічних змін і
- Наркотики, які борються з діабетом та ожирінням, можуть лікувати Covid-19
- Жир та діабет 1 типу Університет штату Айова, дитяча лікарня
- Ремісія цукрового діабету 2 типу та значне зниження маси тіла, досягнуте за допомогою метформіну та