Порушення вимирання страху через дефіцит припливу Ca 2+ через напружені канали Ca 2+ типу L у мишей, дефіцитних для Tenascin-C
Фабіо Морелліні
1 Інститут біосинтезу нейронних структур, Zentrum für Molekulare Neurobiologie Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Німеччина
2 Дослідницька група поведінкової біології, Zentrum für Molekulare Neurobiologie Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Germany
Олексій Малишев
3 Кафедра нейрофізіології Рурського університету в Бохумі, Бохум, Німеччина
4 Інститут вищої нервової діяльності та нейрофізіології Російської академії наук, Москва, Росія
Максим Волгушев
3 Кафедра нейрофізіології Рурського університету в Бохумі, Бохум, Німеччина
4 Інститут вищої нервової діяльності та нейрофізіології Російської академії наук, Москва, Росія
5 Департамент психологічних наук, Університет штату Коннектикут, Сторрс, Коннектикут, США
Марина Чистякова
3 Кафедра нейрофізіології Рурського університету в Бохумі, Бохум, Німеччина
5 Департамент психологічних наук, Університет штату Коннектикут, Сторрс, Коннектикут, США
Джорджі Папашвілі
1 Інститут біосинтезу нейронних структур, Zentrum für Molekulare Neurobiologie Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Німеччина
Летиція Фелліні
1 Інститут біосинтезу нейронних структур, Zentrum für Molekulare Neurobiologie Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Німеччина
Ральф Кліні
1 Інститут біосинтезу нейронних структур, Zentrum für Molekulare Neurobiologie Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Німеччина
Мелітта Шахнер
6 Центр неврології, Медичний коледж університету Шаньтоу, Шаньтоу, Китай
7 Центр спільної нейронауки і відділ клітинної біології та нейронауки Кека, Університет Рутгерса, Піскатей, штат Нью-Джерсі, США
Олександр Дитятьов
1 Інститут біосинтезу нейронних структур, Zentrum für Molekulare Neurobiologie Hamburg, Universitätsklinikum Hamburg-Eppendorf, Hamburg, Німеччина
8 Група молекулярної нейропластичності, Німецький центр нейродегенеративних захворювань (DZNE), Магдебург, Німеччина
9 Медичний факультет, Університет Отто-фон-Геріке, Магдебург, Німеччина
10 Центр поведінкових наук про мозок (CBBS), Магдебург, Німеччина
Анотація
Вступ
Тенасцин-С (ТНК) помітно експресується в різних тканинах під час розвитку. У центральній нервовій системі, що розвивається, ТНК бере участь у регулюванні проліферації клітин-попередників олігодендроцитів та астроцитів. Експресія TNC регулюється в мозку дорослого, за винятком областей, що підтримують нейрогенез у дорослому віці, таких як гіпокамп та гіпоталамус (Wiese et al., 2012). Після травми експресія TNC регулюється в нейронах, що відповідають на образу. TNC підтримує регенерацію спинного мозку, сприяючи відростанню аксонів та утворенню синапсів в каудальному відділі спинного мозку до місця ураження (Yu et al., 2011).
Селективне порушення LTP, викликане протоколами, які включають активацію L-VGCC у мишей TNC -/-, припускає, що дефіцит TNC призводить до порушення експресії та/або функціональності цих каналів, які складаються з 3-4 субодиниць: утворюючи α1 субодиницю та допоміжну β, а також субодиниці α2δ та γ (Hofmann et al., 1994). У мозку ссавців Cav1.2 і Cav1.3 є двома основними α1-субодиницями L-VGCC, які становлять важливий шлях проникнення Ca 2+ в нейрони.
Тут ми намагалися більш щільно пов’язати спостережуваний дефіцит LTP у мишей TNC -/- зі зниженою функцією кальцієвих каналів L-типу та дефіцитом поведінки. Ми показуємо, що у мишей TNC -/- рівень експресії двох субодиниць L-VGCC α1 не знижується, але приплив Са 2+ через L-VGCC значно зменшується. Далі ми показуємо залежність від L-VGCC при вимиранні контекстуальних спогадів страху у мишей TNC -/-. Ми прийшли до висновку, що порушення функціональності L-VGCC може бути причиною погіршення LTP та поведінкового дефіциту у мишей TNC -/-.
Матеріали і методи
Миші TNC -/- (Evers et al., 2002) були виведені на тлі C57BL/6. Тет-дванадцяти тижневі самці ТНК -/- і ТНК +/+ одноплідники були отримані при гетерозиготному розведенні та утримувались при перевернутому світлі 12:12 год: темному циклі (світло вимикається о 07:00) та стандартних умовах утримання (23 ± 1 ° C; 50% вологості; їжа та вода ad libitum). Тести на поведінку проводили в експериментальній кімнаті, що прилягала до приміщення для тварин, і освітлювали неяскравим червоним світлом. Експерименти проводились в середині темної фази циклу. Всі матеріали очищали мильною водою, водою та етанолом (75%) між мишами. Експерименти проводились відповідно до Директиви Ради Європейського Співтовариства (86/609/ЄЕС), а використовувані процедури були затверджені штатом Гамбург. Було зроблено обережність, щоб мінімізувати біль або дискомфорт для тварин.
Аналіз вираження Cav1.2 та Cav1.3
Поліклональні антитіла проти субодиниць Cav1.2 і Cav1.3 L-VGCC були люб'язно надані Р. Вестенбруком та В. Каттераллом і описані в інших місцях (Hell et al., 1996). Моноклональні антитіла проти гліцеральдегід-3-фосфатдегідрогенази кролика (GAPDH) отримано від Chemicon International (Темекула, Каліфорнія, США).
Імуногістохімічний аналіз експресії Cav1.2 та Cav1.3 проводили, як описано Kochlamazashvili et al. (2010). Для вестерн-блоттінгу гіпокампі гомогенізували в 200 мкл ТЕ-буфера (50 мМ Трис/HCl, 5 мМ ЕДТА, рН 8). Після визначення концентрації білка за допомогою аналізу білка BCA TM (Thermo Scientific, Рокфорд, Іллінойс, США) 50 мкг білків на смугу піддавали SDS-PAGE на 10% гелях з подальшим аналізом Вестерн-блот. Білки переносили на нітроцелюлозну мембрану (Protran, Schleicher and Schuell, Dassel, Німеччина), і мембрану блокували 5% нежирним сухим сухим молоком у PBS, рН 7,5. Мембрану інкубували з первинним антитілом (1: 1000) протягом ночі при 4 ° C з струшуванням, промивали в PBS 0,05% Твін (PBS-T) і зондували кон'югованим з HRP вторинним антитілом (1: 10000 в PBS, що містить 5% сухого молока) протягом 1 год. Після промивання імунодетекцію проводили з використанням хемілюмінесцентного субстрату з тривалою тривалістю (Пірс, Бонн, Німеччина) на рентгенівських плівках (Kodak Biomax-ML, Sigma-Aldrich). Інтенсивності смуг були денситометрично визначені за допомогою програмного забезпечення для зображення TINA 2.09 (DesignSoft Inc., Будапешт, Угорщина).
Записи LTP у зрізах гіпокампа
Ca 2+ Візуалізація
Контекстуальне кондиціонування страху
Препарати для поведінкових експериментів
Ніфедипін (25 мг/кг) суспендували у 10% -ному носії Cremophor EL/PBS, а дилтіазем (15 мг/кг) - у фізіологічному розчині (0,9% NaCl у воді). Внутрішньочеревні ін'єкції виконували за 50 хв (ніфедипін) або 20 хв (дилтіазем) до випробування з відкликанням та протоколу вимирання, проведеного на 2-й день контекстного тесту кондиціонування страху.
Статистичний аналіз
Порівняння двох груп проводили за допомогою двостороннього t-тесту. Дані про поведінку оцінювали за допомогою багатофакторного дисперсійного аналізу (ANOVA), за яким, за необхідністю, проводили пост-хост-тести Ньюмана-Кельса: двосторонній ANOVA (з «генотипом» та «лікуванням» як між факторами груп), змішаний двосторонній (з « генотип »як між факторами груп та« часом »як усередині фактора групи) та змішаним тристороннім ANOVA (з« генотипом »та« лікуванням »як між факторами груп, так і« часом »як фактором групи). Всі тести були двосторонніми, і рівень значимості був встановлений на рівні p -/- Мишей врятовують тимчасовою активацією L-VGCC під час індукції LTP
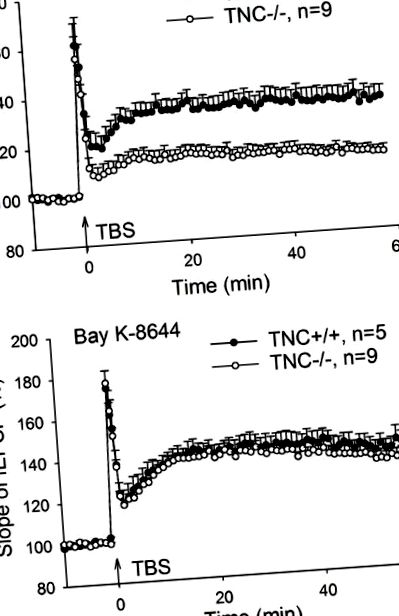
Відновлення довготривалого потенціювання CA1 (LTP) у мишей тенасцину-С (TNC -/-) за допомогою активатора затоки напруги, керованого напругою Ca 2+ (L-VGCC), Bay K-8644. (A) Чотири поїзди стимуляції стихійним спалахом (TBS) колатеральних/комісуральних волокон Шаффера, що індукують порушення LTP в CA1-області TNC -/- мишей. (B) LTP у мишей TNC -/- може бути відновлений до рівня дикого типу за допомогою активатора L-VGCC Bay K-8644 (10 мкМ). Наведено середні значення та значення SEM, середній нахил збуджуючих постсинаптичних потенціалів (fEPSP), зафіксований за 10 хв до індукції LTP, встановлений на 100%.
Виразність каналу L-VGCC не зменшується в гіпокампах ТНК -/- мишей
Спочатку ми провели імуногістохімічний аналіз, щоб оцінити, чи впливає дефіцит ТНК на загальну експресію або локалізацію субодиниць Cav1.2 та Cav1.3 α1 нейронних L-VGCC. У області СА1 гіпокампу не виявлено зниження експресії жодної субодиниці каналу (рис. (Рис. 2). 2). Відповідно до попереднього дослідження (Hell et al., 1996), ми спостерігали найсильнішу експресію L-VGCCs в сомах і проксимальних дендритах пірамідних нейронів CA1, але ці канали також були помітні в дистальній частині дендритних дерев.
Імунореактивність для субодиниць Cav1.2 та Cav1.3 нейрональних L-VGCC у зонах CA1 TNC +/+ та TNC -/- мишей. Найсильніший сигнал спостерігався в соматах і верхівкових дендритах клітин, розташованих у пірамідальному шарі. Очевидної різниці в експресії між генотипами не було, хоча незначне збільшення експресії Cav1.3 у мишей TNC -/- було помічено шляхом порівняння зображень трьох пар мишей дикого типу та нокауту. Шкала шкали: 200 мкм, застосовується до всіх панелей.
Далі ми провели напівкількісний Вестерн-блот-аналіз з рівними кількостями білка загального гомогенату, приготованого з гіпокампів мишей TNC -/- та TNC +/+. Ми використовували споріднені очищені поліклональні антитіла проти субодиниць Cav1.2 і Cav1.3 нейронних L-VGCC, які розпізнавали дві смуги 210-220 і 180-190 кДа (Hell et al., 1996). Загальні рівні цих двох форм були кількісно визначені за допомогою денситометрії та нормалізовані щодо рівнів GAPDH. Рівні GAPDH були майже однаковими у порівняних зондах, показуючи, що це належний контроль навантаження та експресії, який можна використовувати для нормалізації рівнів L-VGCC. Результати показали підвищену, а не знижену експресію цих двох форм субодиниць Cav1.2 і Cav1.3 в гіпокампі мишей TNC -/- порівняно з мишами TCN +/+ (рис. (Рис. 3). 3). Слід зазначити, що на додаток до смуг з однорідними молекулярними вагами для субодиниць каналу у вестерн-блот з цими антитілами видно додаткові смуги невідомої ідентичності (рис. (Рис. 2). 2). Тому ми вирішили, що ці додаткові смуги не будуть вимірюватися.
Підвищена експресія L-VGCCs в гіпокампі TNC -/- мишей. Гомогенати гіпокампів з TNC -/- та TNC +/+ односмітників піддавали вестерн-блот-аналізу з використанням антитіл проти субодиниць Cav1.2 і Cav1.3 L-VGCC та проти гліцеральдегід-3-фосфатдегідрогенази (GAPDH) для контролю навантаження. (A) Показані репрезентативні вестерн-плями. (B) Кількості Cav1,2 та Cav1,3 коливаються від
220 кДа (позначені вертикальними лініями) визначали за допомогою денситометрії та нормалізували до рівнів GAPDH. Зірочки в (A) вказують смуги невідомої ідентичності. Засоби та SEM рівнів експресії (4 тварини для кожного генотипу) були пов'язані із середнім значенням, виміряним для TNC +/+ гіпокампі, яке було встановлене на 100%, *** p -/- мишей, припускаючи, що порушення L- Залежні від VGCC механізми LTP у мишей TNC -/- обумовлені зміною функціональних властивостей або експресією клітинної поверхні цих каналів.
Приплив Ca 2+ через L-VGCC зменшений і нечутливий до ніфедипіну в пірамідних нейронах TNC -/- CA1
Щоб безпосередньо перевірити, чи дефіцит ТНК призводить до порушення активності L-VGCC, ми вимірювали приплив Са 2+ у нейронах ТНК -/- та ТНК +/+, використовуючи візуалізацію Са 2+. Ми заповнили пірамідні клітини CA1 чутливим до Ca 2+ барвником Oregon Green 488 BAPTA-1 і записали зміни флуоресценції, індуковані TBS або послідовностями імпульсів деполяризації, що застосовуються за допомогою патч-піпетки (малюнки 4A, B). Для оцінки внеску L-VGCCs ми вимірювали приплив Са 2+ в контрольних умовах та після додавання ніфедипіну до носія запису. Різниця між сигналами Ca 2+, записаними за цих двох умов, характеризує внесок L-VGCC. Ми виявили значну різницю між чутливими до ніфедипіну компонентами у мишей TNC +/+ та TNC -/-. У мишей TNC +/+ застосування ніфедипіну призвело до чіткого зменшення сигналів Ca 2+ в соматах пірамідних нейронів CA1 у відповідь на TBS. У мишей TNC +/+ сигнали Ca 2+ зменшувались на
10% (до 90,1% контролю, зменшення на 9,9 ± 3,1%, n = 13, p = 0,008). На відміну від цього, у мишей TNC -/- застосування ніфедипіну не зменшувало сигналів Ca 2+ (101,3% контролю, зміна 1,3 ± 3,6%, n = 10; p = 0,726; малюнки 4C, D). Різниця між генотипами у зменшенні сигналів Ca 2+ за допомогою ніфедипіну (і, отже, у внеску каналів L-типу в двох генотипах) була значною (p = 0,022).
Таким чином, вхід Ca 2+, опосередкований L-VGCC під час TBS або тета-подібної прямої постсинаптичної активації, порушується в гіпокампі мишей TNC -/-. Ці результати забезпечують міцну підтримку гіпотези про те, що ТНК регулює активність L-VGCC в зоні CA1 гіпокампу (Evers et al., 2002). Далі ми запитали, чи грає цей механізм роль у регуляції залежної від гіпокампу поведінки.
Придбання та збереження довгострокової пам'яті страху є звичайними явищами, але вимирання порушується у TNC -/- Миші
Знижений вплив блокаторів L-VGCC на поведінку у ТНК -/- мишей
У мишей TNC -/- блокатор L-VGCC ніфедипін не впливає на приплив Ca 2+ у пірамідні нейрони CA1 (рис. (Рис. 4) 4), а також не зменшує розмір LTP (Evers et al., 2002). Таким чином, ми запитали, чи поведінкові ефекти ніфедипіну також не будуть порушені у мишей TNC -/-. Відомо, що фармакологічна блокада L-VGCCs інгібує згасання страху (Cain et al., 2002; Izquierdo et al., 2016), хоча залишається предметом дискусій, чи обумовлені ці наслідки порушеннями специфічних когнітивних процесів, що опосередковують вимирання або спричинене більш генералізованим руховим гальмуванням (Waltereit et al., 2008; Singewald et al., 2015). Ми провели контекстні тести на кондиціювання та вимирання, як описано вище, за допомогою мишей TNC +/+ та TNC -/-, яким вводили або транспортний засіб, або блокатори VGCC типу L ніфедипін або дилтіазем за 20 хв до випробування на вимирання 2-го дня. Дилтіазем використовували для підтвердити, що можливі ефекти, викликані фармакологічною блокадою VGCC типу L, не викликані побічними ефектами, вже описаними для ніфедипіну (Waltereit et al., 2008).
На закінчення, інгібуючий вплив блокаторів L-VGCCs на вимирання був менш вираженим у TNC -/-, ніж у мишей TNC +/+, що вказує на закупорку задіяних механізмів.
Обговорення
У цьому дослідженні ми показали, що порушений L-VGCC-залежний LTP в гіпокампі TNC -/- не викликаний зниженою експресією субодиниць L-VGCC, але це, швидше за все, через зменшений приплив Ca 2+ через Канали L-типу. Більше того, наші поведінкові дані свідчать про те, що знижена активність L-VGCC може лежати в основі порушеного згасання умовного страху, що спостерігається у мишей з дефіцитом ТНК.
Наші дані візуалізації Ca 2+ вперше безпосередньо показують, що залежні від L-VGCC перехідні процеси Ca 2+, викликані TBS вхідного вмісту CA3 до пірамідних клітин CA1, порушені у мишей TNC -/-. Оскільки не відбувається зменшення експресії основних субодиниць Cav1.2 та Cav1.3 L-VGCC, а функцію, що сприяє LTP, може врятувати гострим застосуванням активатора L-каналу Bay K-8644, ми робимо висновок що при конститутивній відсутності ТНК експресуються L-VGCC, але вони менш активні, ніж у присутності ТНК.
Примітно, що знищення умовного страху могло лише частково пригнічуватися ніфедипіном та дилтіаземом у мишей TNC -/-, тоді як ці блокатори L-VGCC у мишей TNC +/+ були повністю скасовані. Це спостереження свідчить про те, що інші механізми, незалежні від L-VGCC, відповідають за залишкове вимирання у мишей TNC -/-. Такі механізми, швидше за все, будуть активовані як компенсаторна реакція на знижену активність каналів L-типу за відсутності TNC. Дійсно, ми спостерігали, що експресія субодиниць Cav1.2 та Cav1.3 була посилена у TNC -/- проти TN +/+ гіпокампі, припускаючи, що компенсаторні механізми підтримують належну клітинну функцію та адаптивну поведінку у мишей TNC -/-.
Цікаво, що у пацієнтів з хворобою Альцгеймера (AD) TNC ко-експресується в бляшках Aβ (Mi et al., 2016). Крім того, в мишачій моделі AD експресія TNC регулюється, в той час як дефіцит TNC зменшує про-, але посилює протизапальні функції в моделі AD і пов'язаний зі зниженим навантаженням на мозковий Aβ та більш високим рівнем постсинаптичної щільності білка 95 (Xie та ін., 2013). Беручи до уваги роль ТНК у регуляції L-VGCC (наявні дані) та довготривалої депресії (Evers et al., 2002), можна припустити, що зменшення залежності від L-VGCC депресії може перекриватися з -запальні ефекти дефіциту ТНК та сприяють збереженню постсинаптичного механізму в моделі AD. Більше того, було встановлено, що генетична мінливість L-VGCC має плейотропний вплив на психопатологію, пов’язану з розладом спектру аутизму, розладом уваги та гіперактивністю, біполярним розладом, основним депресивним розладом та шизофренією (Cross-Disorder Group of the Psychiatric Genomics Consortium, 2013 ). Оскільки ТНК, здається, є головним регулятором діяльності L-VGCC, дуже спокусливо припустити, що ТНК пов'язана з деякими з цих розладів.
Внески автора
FM, MV, RK, MS та AD розробили експеримент. FM, AM, MV, MC, GP, LF та RK збирали та аналізували дані. FM, MV, MS та AD написали та переглянули рукопис; усі автори схвалили остаточну версію рукопису.
Заява про конфлікт інтересів
Автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
- Втрачені гори в Кару розкривають секрети масового вимирання Геологічна сторінка
- Я хочу залишатися пишною - мій страх втрати ваги
- Обмеження рухливості нижніх кінцівок та порушення функції м’язів у жінок з виразковими захворюваннями
- Легка переривчаста гіпоксемія у новонароджених мишей викликає постійний нейрофункціональний дефіцит і білий колір
- Як боротися зі страхом знову товстіти, перебуваючи у формі від товстої до підтягнутої дівчини