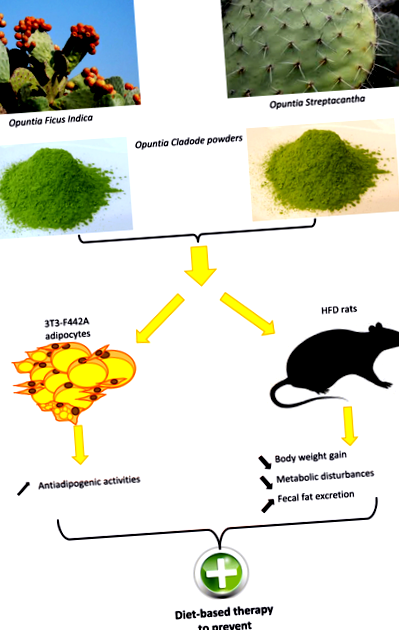
Опунція порошки кладоди пригнічують адипогенез у 3 адипоцитах T3-F442A та моделі щурів з високим вмістом жиру, змінюючи метаболічні параметри та сприяючи виведенню жиру з калом
Анотація
Передумови
Ожиріння є основною проблемою охорони здоров'я у всьому світі. Малорухливий спосіб життя та харчовий перехід на перероблені продукти харчування та висококалорійну дієту є чинниками, що сприяють ожирінню. Отже, зріс попит на нутрицевтичну їжу, таку як рослинні продукти для схуднення, які пропонують потенціал для протидії ожирінню. Ми припустили це Опунція споживання кладод може допомогти контролювати вагу в контексті профілактики ожиріння.
Методи
Це дослідження було розроблене для вивчення антиадипогенних ефектів ліофілізованих Опунція порошки кладоди (OCP) у клітинній моделі in vitro для диференціації адипоцитів та моделі щурів ожиріння, спричиненої ожирінням in vivo з високим вмістом жиру (HFD). Випробували два OCP, один з диких видів O. streptacantha а другий із найвідоміших видів О. фікус-індика.
Результати
Преадипоцити 3 T3-F442A обробляли OCP під час процесу диференціювання інсуліном. Лікування OCP погіршувало диференціацію в адипоцитах, що підтверджується зниженим вмістом тригліцеридів та низьким вмістом глюкози, який залишався порівнянним із тим, що спостерігався у недиференційованих контрольних групах, що свідчить про те, що OCP надає антиадипогенний ефект. Щурів Sprague – Dawley годували нормальним або HFD, доповнювали або не OCP протягом 8 тижнів. Лікування OCP трохи зменшило збільшення маси тіла, вагу жиру в печінці та животі, покращило деякі метаболічні параметри, пов’язані з ожирінням, і збільшило виведення тригліцеридів з калом. У сукупності ці результати показали, що OCP може сприяти зменшенню адипогенезу та накопичення жиру в контексті HFD, зокрема, сприяючи фекальній екскреції жирів.
Висновки
Опунція кладоди можуть використовуватися як дієтична добавка або потенційний терапевтичний засіб у дієтичних терапіях для контролю ваги для запобігання ожирінню.
Графічний реферат
Передумови
Ожиріння є серйозною проблемою охорони здоров'я, яка не лише зменшує тривалість життя, але й пов'язана з розвитком багатьох хронічних захворювань, таких як серцево-судинні захворювання, діабет 2 типу, гіпертонія, жирова хвороба печінки та рак. Це вважається п'ятим ризиком смерті у всьому світі [1, 2].
У 2017 році в Мексиці було найвище поширення ожиріння серед дорослого населення (15–74 роки, 32,4%), тоді як у таких країнах, як Японія або Корея, рівень захворюваності був найнижчим (нижче 6%). Прискорена урбанізація, поліпшення соціально-економічних умов та зміни дієти вважаються відповідальними за різке та швидке збільшення рівня поширеності ожиріння. Традиційне споживання їжі зменшилось на користь збільшення споживання рафінованих продуктів, а також солодощів та дієт, багатих жирами/цукром [3]. Очікується, що показники ожиріння ще збільшаться до 2030 року, необхідні нові стратегії та економічно ефективні дії для профілактики та контролю ожиріння у дітей, підлітків та дорослих [4]. Пропаганда здорового способу життя населення є головною проблемою для сектору охорони здоров’я. Необхідна комплексна державна політика, спрямована на зміну світової тенденції, особливо в Мексиці.
Дослідження гризунів показали, що Опунція екстракти модифікують біомаркери ожиріння. У пацюків із ожирінням Цукера споживання Нопала послаблювало стеатоз печінки, пов’язаний із ожирінням, та зменшував метаболічні відхилення, пов’язані з ожирінням. Оцет або ізольовані молекули, присутні в Опунція Кладоди, такі як кемпферол або ізорамнетин, що використовуються на моделях мишей із ожирінням, підтверджують потенціал цих молекул проти ожиріння та протидіабетичний потенціал [15,16,17,18,19,20,21]. Ці дослідження свідчать про те, що на моделях ожиріння на щурах/мишах, спричинених дієтою з високим вмістом жиру (HFD), доповненою Опунція кладодні порошки (OCP). Подальші результати на моделях тварин необхідні для розуміння основних молекулярних механізмів цих ефектів.
Ріст жирової тканини відбувається через збільшення розміру існуючих адипоцитів або кількості адипоцитів. Дисбаланс між споживанням енергії та витратами енергії породжує надлишок жирової тканини, що призводить до ожиріння. Диференціація преадипоцитів на адипоцити включає розгалужену мережу, що включає фактори транскрипції, відповідальні за експресію ключових білків, що індукують утворення зрілих адипоцитів. Адипогенез також включає зміни в морфології клітин, індукцію чутливості до інсуліну та зміни секреторної здатності β-клітин. Розшифровка механізму впливу певних поживних речовин на диференціацію адипоцитів та адипогенез є важливою для профілактики ожиріння та супутніх захворювань [22].
Це дослідження було покликане дослідити, чи Опунція види виявляють властивості проти ожиріння, вивчаючи антиадипогенний ефект двох Опунція порошків кладоди (OCP) та з'ясування механізмів, що лежать в основі таких ефектів. Для цього ми використовували порошки найдикішого (OSC) та найбільш одомашненого (OFI) Опунція сорти. Ми вибрали ці два види за найвищу різницю градієнтів одомашнення (від видів предків (OSC, що ростуть у дикому середовищі існування) до найбільш розмножуваних Опунція для комерційного виробництва (OFI). Диференціацію преадипоцитів на адипоцити досліджували, обробляючи 3 клітини T3-F442A [22] OCP, щоб дослідити ефекти на клітинному рівні. Ті ж порошки також тестували на тваринній моделі ожиріння, годуючи щурів Спрег-Доулі з дієтою з високим вмістом жиру (HFD), доповненою порошками чи ні. Ця тваринна модель дозволила нам дослідити рівень усього тіла як перший крок до випробувань на людях.
Методи
Реагенти
Цитохалазин B, 2-дезоксиглюкоза, інсулін та модифікована Дульбекко середовище Eagle’s (DMEM) були придбані у Sigma – Aldrich (Saint-Quentin-Fallavier, Франція). [3 H] -2-дезоксиглюкоза від PerkinElmer (Бостон; WalthamMA, США).
Препарат рослинного матеріалу опунції та порошку кладоди
Опунція молоді кладоди з диких видів OSC (O. streptacantha Лем., Кв. Тунець Loca) та OFI (О. фікус-індика [L.] Mill., Cv. RojoVigor) були зібрані (квітень 2010 та 2012) з Опунція Банк зародків агроботанічного саду, розташований в Ель-Оріто, Сакатекас, Мексика. Про офіційну ідентифікацію рослин повідомляють Ramirez-Tobias et al. [23]. Рослини вирощували в однакових умовах навколишнього середовища [12]. Кладоди промивали, подрібнювали в рідкому азоті за допомогою подрібнювача KrupsGX 4100 (Мехіко, Мексика) і витримували при - 80 ° C до подальшої обробки. Зразки сушили ліофілізацією (Labconco, Канзас-Сіті, Міссурі, США), просівали через сітку 80, потім зберігали у поліетиленових пакетах при 4 ° C до використання [14]. Як повідомлялося раніше, визначали вміст жиру, сирої клітковини та загальних фенольних сполук [12].
Культура клітин та диференціація адипоцитів
Культура клітин
Аналіз тригліцеридів (TG)
Внутрішньоклітинний TG визначали кількісно за допомогою ферментативного набору TG PAP 150 (TG PAP 150, BioMérieux, Marcy l’Etoile, Франція) після лізису клітин (0,1 N NaOH). Щоб врахувати клітинну проліферацію або токсичність молекул, вміст TG був пов’язаний із вмістом білка, що визначався ферментативним набором біцинхонінової кислоти (BCA) (Pierce, Thermofischer Scientific, Bordeaux, France). Результати виражали як відсоток контрольних клітин, оброблених лише інсуліном (50 нМ).
Аналіз засвоєння глюкози
Поглинання глюкози вимірювали відповідно до Kim et al. [24] з деякими змінами [25]. Коротко кажучи, через 10 днів обробки клітини двічі промивали в DMEM без сироватки і попередньо інкубували в цьому середовищі при температурі 37 ° C протягом 16 годин. Після цього періоду голодування клітини двічі промивали бікарбонатним буфером Кребса-Рінгера (KRB) та інкубували при 37 ° С протягом 30 хв зі 100 нМ інсуліном (або ні для негативного контролю). Для ініціації поглинання глюкози до кожної лунки додавали 2-дезокси- [1- 3 H] -глюкозу (1 мкКі/мл), розведену в 0,1 мМД розчині глюкози, і планшети інкубували при 37 ° С протягом 10 хв. Після інкубації клітини двічі промивали крижаним буфером KRB і лізували в 0,1 N NaOH. Половину вмісту кожної лунки переносили у сцинтиляційні флакони та додавали 10 мл сцинтиляційного коктейлю (Ultima Gold, Perkin Elmer, Boston, WalthamMA, USA). Радіоактивність, включена в клітини, вимірювали за допомогою рідкого сцинтиляційного лічильника (Hewlett Packard, США). Вміст білка BCA аналізували для кожної точки на решті половини.
Визначення клітинної токсичності
Після інкубації лунки обережно промивали холодним забуференним фосфатом фізіологічним розчином, а потім до кожної лунки додавали 20 мкл 5 мг/мл МТТ і інкубували протягом 4 годин. Згодом середовище з кожної лунки обережно відсмоктували і додавали 100 мкл диметилсульфоксиду для розчинення кристалів формазану. Пластини струшували протягом 30 хв з подальшим вимірюванням поглинання при 570 нм за допомогою зчитувача мікропланшетів Tecan (Tecan, Raleigh, США).
Експерименти на тваринах
Тварини та дієти
Біохімічний аналіз
Зразки плазми відокремлювали від клітин крові центрифугуванням при 1000 ×g протягом 15 хв. Рівні лептину, інсуліну та хемоаттрактантного білка-1 (MCP-1) у плазмі крові аналізували за допомогою набору Luminex (RMHMAG-84 K-05) (Thermofisher, Бордо, Франція). Параметри TG, глюкози та печінки (аспартатамінотрансфераза, AST; аланінамінотрансфераза, ALT) були виміряні в установах Anexplo, Тулуза (Франція). Адіпонектин оцінювали за допомогою медичного засобу TECO Medical (E091-Rkit, Ройтлінген, Німеччина), а С-реактивний білок (CRP) вимірювали за допомогою набору Abcam (ab108827, Abcam, Cambrigde, Великобританія).
Вимірювання рівня тригліцеридів у печінці та фекаліях (ТГ)
Печінкові ліпіди екстрагували гомогенізацією тканин печінки у солі, забуференному фосфатом. До гомогенатів додавали етанол (1: 9, об./Об.), І зразки перемішували при кімнатній температурі протягом 1 год для розчинення ТГ. Після центрифугування при 2000 ×g протягом 10 хв супернатант збирали для вимірювання рівня TG за допомогою ферментативного набору TG PAP 150 (TG PAP 150, BioMérieux, Marcy l’Etoile, Франція), згідно з протоколом виробника. Фекальні ліпіди TG екстрагували з фекалій, зібраних протягом 24 годин. Зразки гомогенізували в стерилізованій воді, потім центрифугували при 2000 ×g протягом 10 хв. Супернатант збирали для вимірювання рівня TG за допомогою ферментативного набору TG PAP 150 (TG PAP 150, BioMérieux, Marcy l’Etoile, Франція), згідно з протоколом виробника.
Статистичний аналіз
Усі дані були виражені як середнє значення ± стандартна похибка середнього значення (SEM) трьох (або більше) незалежних експериментів (експерименти на клітинах) або 10 щурів на групу (експерименти in vivo). Статистичну значимість визначали за допомогою одностороннього дисперсійного аналізу (ANOVA), після чого проводили спеціальний тест Ньюмана – Кеульпоста за допомогою програмного забезпечення GraphPad Prism. Статистична значимість була позначена *сто𠧧 сто𠧧§ стор § сто𠧧 стор Рис. 1
Результати
Характеристика біологічних сполук у двох Опунція кладодні порошки (OCP)
Для кожного виду (OSC, OFI) збирали молоді кладоди на подібній стадії зрілості. Вміст макромолекул, фенольних кислот та флавоноїдів, а також антиоксидантна здатність ОЦП були проаналізовані в попередньому дослідженні [12]. Результати узагальнені в таблиці 3. Проксимальний склад не показав відмінностей у білках (11,0 та 11,7%) та вмісті жиру (0,62 та 0,68%), однак OSC мав вищий вміст клітковини (6,52%), тоді як OFI мав найбільший вміст золи (14,2%). OSC містив найвищу концентрацію фенольної сполуки (65,1 мкг еквіваленту галової кислоти/г) та антиоксидантну здатність, але різниці у вмісті флавоноїдів у цих двох видів не спостерігалося.
Ефекти Опунція порошки кладоди (OCP) на 3-адипоцитарній диференціації T3-F442A
Цитотоксична дія порошків кладуди Opuntia (OCP)
Для оцінки потенційних цитотоксичних ефектів OCP попередньо адипоцити диференціювали на зрілі адипоцити протягом 10 днів з 50 нМ інсуліном у присутності різних концентрацій OCP (0, 1, 10 та 100 мкМ). Як показано на рис. 1, лікування OSC (рис. 1a) та OFI (рис. 1b) не робило помітного впливу на життєздатність клітин, приблизно 100% від контролю, навіть при найвищій концентрації OSC (100 мкМ). При менших концентраціях (1 і 10 мкМ) життєздатність клітин була підвищена, можливо, завдяки мітогенному ефекту OCP.
Порошки кладуди опунції (OCP) інгібують зберігання тригліцеридів (TG) в адипоцитах
Щоб вивчити вплив OCP на диференціацію 3 пре-адипоцитів T3-F442A в адипоцитах, злиті клітини обробляли зростаючими концентраціями OCP. Як показано на рис. 1c, d, на вміст TG не впливали OSC та OFI в недиференційованих клітинах (без інсуліну). Диференційовані клітини демонстрували значне збільшення вмісту внутрішньоклітинного TG (близько 250%), що було значно знижене в клітинах, оброблених 100 мкМ OCP (OSC, 60%; OFI, 50%; стор Рис.3
Метаболічні параметри
Вплив добавок OCP досліджували на метаболічні параметри, вимірюючи рівні сироваткових рівнів маркерів, пов’язаних із ожирінням (рис. 4). Як показано на рис. 4 a, b, збільшення ожиріння було пов’язане зі зниженням рівня адипонектину в групі F (F = 75% проти SD; стор Рис.4
Дієта з HFD дещо підвищила рівень циркулюючого TG (130%), і це було скасовано як добавками OCP (рис. 4c), хоча і не суттєво. Такі ж спостереження можна зробити для рівня глюкози в крові. Добавки OCP мали тенденцію до зниження рівня TG та глюкози (рис. 4c, d). Подібним чином, рівень циркулюючого інсуліну (рис. 4д) був підвищений у групі F (195%; стор Таблиця 4 Сироваткові печінкові маркери
Оцінка тригліцеридів (TG) у фекаліях
Наші результати показали, що щури, яких годували HFD, що отримували OCP, мали нижчу масу тіла та знижували рівень TG у сироватці та печінці порівняно з контрольними щурами HFD (F). Для розуміння механізмів, причетних до зниження рівня TG, вміст TG у фекаліях щурів вимірювали за 3 дні до закінчення експериментів. Результати на рис. 5b вказують на те, що концентрація TG була збільшена у фекаліях з трьох груп HFD, особливо у групі F-OFI (123%; стор
Обговорення
У цьому дослідженні ми досліджували вплив на ожиріння двох OCP, найдикішого OSC та найбільш одомашненого OFI, використовуючи 3 клітини адипоцитів T3-F442A та щурів із ожирінням HFD.
У нашому дослідженні щури, яких годували HFD, набирали помітно більше ваги, ніж ті, що годували звичайною дієтою, підтверджуючи, що ожиріння, спричинене дієтою, було успішним. Помітної різниці в споживанні їжі серед усіх груп не спостерігалося. Цікаво, що добавки OCP (F-OSC, F-OFI) запобігали збільшенню ваги тварин при порівнянному споживанні їжі. Крім того, OCP, як правило, зменшував розвиток жиру в животі протягом 8 тижнів дієти, не зменшуючи споживання їжі. Таким чином, ми можемо зробити висновок, що добавка OCP в їжу може зменшити збільшення маси тіла, пригнічуючи розширення маси жирової тканини.
Відомо, що HFD індукує NAFLD у тваринних моделей та людей, викликаючи відкладення жиру в печінці [39, 40]. НАЖХП тісно пов'язана з ожирінням. У нашій моделі ожиріння на щурах, що харчуються HFD, ми показали, що добавка OCP у раціоні має тенденцію до зниження маси печінки, що може бути пов'язано з меншим зберіганням TG у печінці. Подібним чином Моран-Рамос та співавт. продемонстрував це Опунція споживання кладоди послаблює стеатоз печінки у пацуків Цукера із ожирінням [18], а також інші дослідження на основі HFD, доповнені кверцетином [35] або Vignanakashimae екстракти (ще одна багата флавоноїдами рослина) [32] також призвели до зниження приросту маси тіла та накопичення ліпідів у печінці. Взяті разом, ці результати свідчать про те, що OCP може бути ефективним проти жирової печінки у щурів із ожирінням з HFD. Примітно, що лікування ОЦП не спричинило жодних помітних несприятливих токсичних ефектів на печінку.
Uebelhack та співавт. [9] та Chong et al. [41] проілюстрував, що наслідки Опунція-похідні клітковини діють на зменшення поглинання жиру в організмі добровольців шляхом зв’язування з жиром та збільшення виведення його з калом, ймовірно, шляхом зменшення всмоктування жиру в кишечнику. Для подальшого розуміння механізмів, що пояснюють менший приріст ваги, викликаний Опунція Додавання добавки в HFD, ми оцінили виведення жиру з фекаліями на нашій моделі щурів, яке помітно збільшилось у щурів, які отримували HFD, і було набагато більш вираженим, коли щурам додавали OFI. Ці висновки підтверджують гіпотезу, згідно з якою ефекти OCP на вагу досягаються за рахунок зменшення всмоктування жиру з дієти, що призводить до зниження споживання енергії і, отже, до меншого збільшення ваги. Нарешті, були виявлені протизапальні ефекти nopal. Bouhini et al. Продемонстрували зменшення хронічного запалення низького ступеня, пов’язаного з ожирінням, це могло бути пов’язано з впливом волокон нопалу на мікробіоти кишечника [17, 20].
Висновки
Наше дослідження проводили з використанням моделі щурів на ожиріння та клітинної моделі, яка дозволяє зменшити кількість використовуваних тварин та отримати інформацію про клітинний спосіб дії. Однак використання тварин підкреслювало зниження всмоктування жиру в кишечнику та нетоксичний ефект дієти Опунція порошків, що свідчить про їх потенціал для використання у раціоні людини. Спосіб дії Опунція при лікуванні ожиріння потребує подальшого аналізу, але, схоже, деякі ефекти можна спостерігати на молекулярному рівні шляхом регулювання шляху диференціювання адипоцитів, зменшення всмоктування жиру, а також можливої модифікації мікробіоти кишечника. На закінчення, наші дані свідчать про те, що споживання кладоди OFI може бути корисним для лікування ожиріння та профілактики захворювань печінки (НАЖХП), пов’язаних із ожирінням.
Наявність даних та матеріалів
Набори даних, використані та/або проаналізовані під час поточного дослідження, доступні у відповідного автора за обґрунтованим запитом.
- Російська модель Playboy, яка обурила Дубай, бовтаючись з хмарочоса на фотографіях, що кидають виклик смерті
- Дієта і тренування Наталі Розер - модель тижня плавання в Майамі
- Фенольні кислоти сучасних та стародавніх зерен Вплив на модель клітин in vitro - Truzzi - 2020 - Journal
- Стійкість моделі цукрового діабету 2 типу, викликаної дієтичним годуванням з низьким вмістом жиру
- Викрасти модель Розанні Девісон з гурманами та дієтами Секрети