Поліетилен з надвисокою молекулярною вагою: Вплив хімічних, фізичних та механічних властивостей на поведінку при зносі. Огляд
П'єрангіола Бракко
1 Відділ хімії та НІС (наноструктуровані інтерфейси та поверхні) Центр, Торінський університет, 10125 Торіно, Італія
Анудж Белларе
2 Відділення ортопедичної хірургії, Бригам і жіноча лікарня, Гарвардська медична школа, Бостон, Массачусетс 02115, США; ude.tim.mula@juna
Алессандро Бістолфі
3 лікарня CTO, Città della salute e della Scienza, 10126 Torino, Італія; ti.ot.etulasalledattic@iflotsiba
Saverio Affatato
4 Лабораторія медичних технологій, Ортопедичний інститут Ріццолі, 40136 Болонья, Італія; ti.roi.oncet@otataffa
Анотація
Поліетилен з надвисокою молекулярною масою (UHMWPE) є найпоширенішим підшипниковим матеріалом у суглобовій ендопротезуванні суглобів завдяки унікальній комбінації чудових механічних властивостей та зносостійкості порівняно з іншими полімерами. Протягом останніх десятиліть багато досліджень було зосереджено на подальшому поліпшенні своїх показників з метою забезпечення міцних імплантатів молодим та активним пацієнтам. Починаючи з «історичних», стерилізованих гамма-повітрям поліетиленів, до так званих першого та другого поколінь сильно зшитих матеріалів, на ринку поступово з’являється безліч різних складів. У цій роботі розглядається взаємозв'язок структури та властивостей цих матеріалів, з особливим акцентом на характеристиках зносу in vitro та in vivo, шляхом аналізу існуючої літератури.
1. Вступ
Поліетилен з надвисокою молекулярною масою (UHMWPE) використовується як несучий матеріал при загальній ендопротезуванні суглобів вже понад 50 років. Ідея замінити деградований хрящ полімерним вкладишем сягає кінця 1950-х років. У той час сер Джон Чарнлі обрав політетрафторетилен (ПТФЕ), полімер з низьким тертям, в якості несучого матеріалу для заміни природного ацетабулума, шарнірно прикріпленого до металевої головки стегнової кістки, для заміщення стегна. Через неприпустимо низьку зносостійкість ПТФЕ, перші "артропласти з низьким тертям" різко зазнали краху через кілька років імплантації. У 1962 році UHMWPE, такий же низький коефіцієнт тертя, але набагато більш зносостійкий полімер, замінив PTFE в ендопротезуванні кульшового суглоба Чарнлі з надзвичайно кращими характеристиками. Відтоді ендопротезування знало значний розвиток, але UHMWPE залишається золотим стандартом для штучних стегон, а тепер інших штучних суглобів, включаючи коліно та плече [1].
Незважаючи на відносно успішну історію, постійно зростаюча кількість щорічних процедур [2,3] і, перш за все, різке збільшення попиту у молодих, більш активних пацієнтів [4] стимулювали постійні дослідження оптимізованих рецептур матеріалів та процедур обробки, забезпечити високий рівень продуктивності та довговічності.
Кожне потенційне нововведення супроводжувалось великою кількістю доклінічних випробувань, проведених дослідниками у всьому світі, часто з дуже різними методами, а іноді із суперечливими результатами.
Лише деякі з цих досліджень були спрямовані на встановлення кореляції між хімічними та морфологічними характеристиками полімеру та його механічними властивостями та зносостійкістю. У деяких випадках пошукові дослідження корелювали властивості матеріалу з клінічним результатом імплантації.
Ця робота спрямована на вивчення такого співвідношення шляхом аналізу відповідної літератури, яка з’явилася за останні десятиліття.
2. UHMWPE
UHMWPE - це особливий тип поліетилену (ПЕ) з надзвичайно високою молекулярною масою. Міжнародна організація зі стандартів (ISO 11542) (ISO, 2001) визначає UHMWPE як молекулярну масу не менше 1 млн. Г/моль, тоді як Американське товариство випробувань та матеріалів (ASTM) вказує, що UHMWPE має молекулярну масу більше 3,1 млн. г/моль [5]. Окрім молекулярної маси, мікроструктура полімеру також відіграє важливу роль у визначенні його фізичних, хімічних та механічних властивостей. UHMWPE, як і більшість поліетиленів, є напівкристалічним полімером, що складається щонайменше з двох взаємопроникаючих фаз: кристалічної фази, в якій макромолекули складаються в упорядковані кристалічні ламелі та аморфну, невпорядковану фазу, можливо, інтеркальовану частково впорядкованою, так званою all-trans, міжфазна [6,7].
3. «Історичні» та звичайні радіаційні стерилізовані поліетилени
Термін «історичний» часто позначав поліетилени, які стерилізувались 25–40 кГр гамма-випромінювання в повітрі [10]. Ці типи поліетилену мають тривалу клінічну історію, починаючи з перших новаторських імплантатів у 1960-х і до кінця 1990-х, до того часу більшість виробників перейшли на інертно-стерилізовану бар'єрну упаковку ПЕ та/або на зшиту ПЕ. Однак приклади стерилізованих гамма-повітрям поліетиленів також можна епізодично зустрічати в сучасних клінічних застосуваннях [10,11].
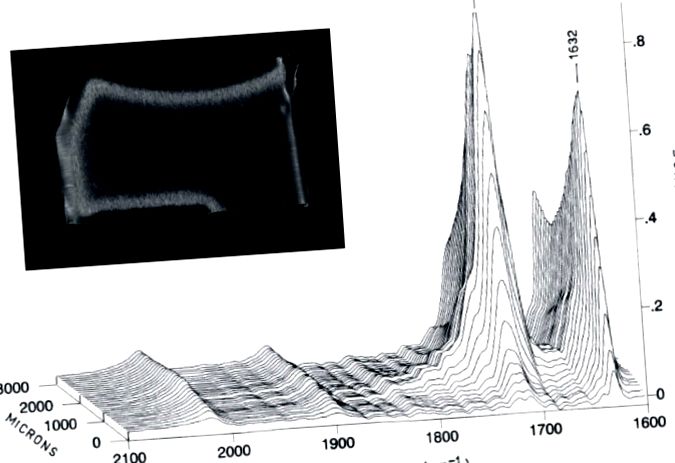
Поперечний переріз гамма-повітряної стерилізованої великогомілкової вставки, що демонструє характерний ефект «коронки» (підповерхнева біла смуга), а також спектри інфрачервоного перетворення Фур'є (FTIR), що свідчить про наявність рясних продуктів окислення. Адаптовано з [17], з дозволу.
Ступінь та швидкість радіаційного окислення залежить від кількох факторів, включаючи загальну поглинену дозу та потужність дози, температуру стерилізаційного центру, наявність кисню та товщину зразка, що, в свою чергу, визначає розподіл концентрації кисню через товщину імплантат. Крім того, окислювальний процес, розпочатий під час стерилізації, може продовжуватися зі змінними, але низькими показниками, під час зберігання на полиці та імплантації (старіння після опромінення). Знову ж таки, швидкість та ступінь окисного розкладання залежать від часу витримки шельфу та температури, а також від кількості доступного кисню в шельфі та in vivo [19]. Крім того, виявляється, що механічні напруження, що виникають під час використання in vivo, також можуть полегшити окислювальний процес [23,24]. Підсумовуючи, з цього випливає, що стерилізація випромінюванням з високою енергією у присутності повітря може призвести до сильно мінливих рівнів окислення в поліетиленах, на які впливають різні фактори.
В цілому було продемонстровано, що окисна деградація призводить до значних змін механічних властивостей UHMWPE і, зокрема, до крихкості. Добре відомо, що крихкість полімерів корелює із властивостями розтягування [25,26]. Відповідно, збільшення модуля пружності та зменшення подовження до руйнування, граничного напруження та в'язкості було продемонстровано в ряді досліджень [27,28,29] (рис. 2); крім того, також спостерігалось зниження опору втомної тріщини [20,30], тоді як часто різке зниження зносостійкості (рис. 3) було продемонстровано в результаті численних досліджень in vitro та вилучення [22,29,31,32, 33,34].
Малі криві зміщення ударного навантаження для стерилізованих гамма-повітрям сверхстелевих поліетиленових (UHMWPE) гомілкових вставок у поверхневих і підземних місцях: (a) контроль, неупрацьований; (b) зберігається у віці 5 років; (c) полиця, витримана 10 років. Адаптовано з [27], з дозволу.
Отримана поліетиленова гомілкова вставка, що демонструє серйозні пошкодження зносу, включаючи сильне розшарування та знос (10 років in vivo).
Знос цього матеріалу, як правило, вимірюється як втрата ваги на мільйон циклів після обліку поглинання бичачої сироватки під час артикуляції проти металевої або керамічної поверхні. Контрольний зразок, як правило, завантажується і просочується бичачою сироваткою, але не шарнірним, і поглинання рідини періодично вимірюється разом із зношеними зразками. Швидкість зносу також повідомляється як коефіцієнт зносу, який є втратою ваги, нормованою на навантаження, і загальним пройденим шляхом зносу [35,36].
Однак варто зазначити, що кілька досліджень in vitro повідомляли про значно кращі показники зношування поліетиленів, опромінених гамма-повітрям, порівняно з неопроміненими. Наприклад, Есснер та його колеги [37], в рамках всебічного дослідження, що вивчало клінічну значимість експериментів на тренажері стегна, продемонстрували, що об'єм зносу нестерилізованих та стерилізованих чашок EtO вдвічі перевищував об'єм гамма-опромінених у повітряних чашках. Подібним чином Affatato та ін. [38] показали, що після 5М циклів у тренажері стегна стерилізовані EtO зразки носили в 1,2 рази швидше, ніж опромінені гаммою, і той самий результат був підтверджений навіть у наступному тесті в режимі зносу третього тіла [39]. McKellop та ін. [40], в іншому експерименті на тренажері стегна також виявив незрозумілу швидкість зносу двох чашок, опромінених гамма-повітрям, виготовлених з різних смол (GUR 4150 і 1020, зі стеаратом кальцію та без), і на 54% вищий показник зносу для чашки, виготовленої з тією ж смолою GUR 4150, стерилізованої етиленоксидом.
Це, ймовірно, відбувається тому, що, як було зазначено вище, гамма-опромінення призводить до поєднання зшивання та розщеплення ланцюга, причому останнє переважає лише після тривалого часу старіння після опромінення. Враховуючи протилежний вплив цих двох явищ на зносостійкість UHMWPE [17,33,41,42], стає очевидним, що проби, стерилізовані радіацією, будуть демонструвати менший знос неопромінених або стерилізованих плазмою EtO/газ при короткому опроміненні масштаб часу та умови зберігання, що дозволяють зшиванню переважати більшою мірою, ніж розщеплення ланцюга. Навпаки, після відповідного прискореного старіння або більш тривалого старіння в режимі реального часу, на полиці або in vivo, показники зносу та втоми гамма-опромінених зразків значно погіршуються внаслідок окислювальної деградації та заперечують будь-які короткострокові переваги зшивання, пов’язаних із методами стерилізації які використовують іонізуюче випромінювання [21,29,32,33,43].
Це спостереження спонукало дослідників на місцях реалізувати стратегії, щоб скористатися перевагами зшивання, викликаного променевою обробкою, водночас мінімізуючи недолік тривалого окислення.
Першим прийнятим заходом була стерилізація UHMWPE високоенергетичним випромінюванням у середовищі з низьким вмістом кисню (вакуум або інертний газ, тобто аргон або азот) [10,44,45,46]. Ця практика дозволяє уникнути контакту з киснем під час стерилізації, а якщо підкладка загорнута у відповідну бар’єрну упаковку, також протягом наступного терміну придатності [11,47]. На жаль, це не запобігає контакту з киснем, розчиненим у поліетилені перед упаковкою в середовищі з низьким вмістом кисню, а також з киснем, доступним in vivo [43], тому в цих поліетиленах спостерігається також деяке окиснення, навіть якщо набагато нижчі рівні ніж для опромінення, стерилізованого на повітрі [11,48,49].
4. Поліетилен високого зшиття 1-го покоління
4.1. Покращення зносостійкості
До кінця 1990-х років велика кількість лабораторних та клінічних досліджень показали, що зшивання забезпечує значне поліпшення зносостійкості UHMWPE. Механізми, за допомогою яких відбувається це вдосконалення, були висвітлені різними дослідниками [41,42,50,51,52]. В основному, як вважають, знос UHMWPE відбувається за рахунок пластичної деформації полімеру з молекулярним вирівнюванням у напрямку руху, що призводить до утворення дрібних витягнутих волокон, орієнтованих паралельно одна одній. В результаті такого розташування поверхня зносу UHMWPE може зміцнюватися вздовж напрямку ковзання, в той час як вона слабшає в поперечному напрямку. Ван та співавт. [50] дійшов висновку, що в умовах різноспрямованих рухів, які можуть стосуватися як тазостегнового, так і колінного суглоба, це явище пом’якшення орієнтації головним чином відповідає за відшарування волокнистого сміття від зношених поверхонь, які спостерігались у багатьох звітах [53,54,55]. Отже, вважається, що оскільки зшивання індукує вуглець-вуглецеві зв’язки між сусідніми ланцюгами, тим самим зменшуючи рухливість ланцюга та гальмуючи таку молекулярну орієнтацію, це могло б ефективно уповільнювати утворення поверхневих волокон і робити поліетилен більш стійким до знос [41,51,56].
Хоча в літературі існують деякі суперечки щодо хімічних механізмів радіаційного зшивання UHMWPE [19,56,57,58], більшість авторів сходяться на думці, що щільність зшивання лінійно зростає до доз випромінювання порядку 100 кГр, вище якого вона прагне до плато (рисунок 4 а) [42]. Однак зменшення в'язкості при розтягуванні та руйнуванні продовжується при дозі випромінювання вище 100 кГр [59,60]. Отже, більшість “зв’язаних” поліетиленів “1-го покоління” з’явилися в експериментальних in vitro та клінічних дослідженнях наприкінці 1990-х років і на початку 2000-х опромінювались дозами від 50 до 105 кГр [5].
- Втрата ваги та шорсткість поверхні твердих смол для крісла крісла після впливу зубної щітки
- Втрата ваги - чи можливо тонізувати навіть у голодному режимі Обмін стеками фізичної підготовки
- Втрата ваги при консервативному лікуванні ожиріння у жінок пов’язана з фізичними навантаженнями та
- Вплив оздоровчих повідомлень про здоров’я та втрати на харчування та фізичну активність
- Недієтичний підхід до схуднення дитини - фізична терапія Гармонія тіла