Перехресні взаємодії між клітинами щогли та адипоцитами у фізіологічних та патологічних умовах
Анотація
Вступ
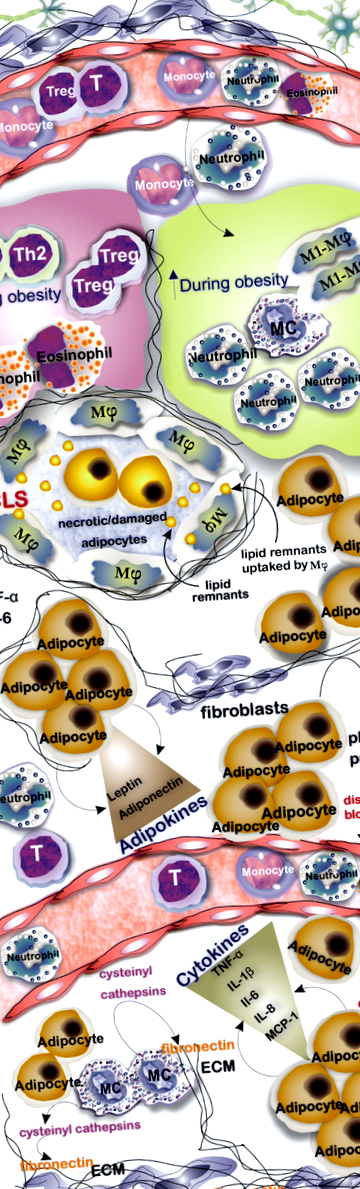
Адипоцити - основна популяція клітин в АТ. Однак у АТ зазвичай зустрічається кілька типів клітин, кількість яких коливається в худому та ожирінні АТ, наприклад, тоді як кількість макрофагів, МК та нейтрофілів М1 збільшується при ожирінні, кількість мешканців АТ Th2, Treg та еозинофілів зменшується. AT при ожирінні інфільтрований запальними клітинами, а утворення коронкоподібних структур, що характеризуються круговими некротичними/пошкодженими адипоцитами з макрофагами, є загальною знахідкою. Адипоцити не тільки зберігають ліпіди, але також виділяють кілька цитокінів і адипокінів, які впливають на імунну реакцію та гемостаз тканини. Збільшення кількості і розміру адипоцитів, що оточують судинну систему, призводить до формування фізичного тиску і, як наслідок, порушення кровотоку. MCs шляхом індукції вивільнення цистеїнілових катепсинів з ендотелію та адипоцитів відіграють роль у катаболізації фібронектину
Зростаюча кількість дослідників повідомляє про накопичення МЦ в АТ осіб із ожирінням [8, 9]. МС стимулюють вивільнення цистеїнілових катепсинів із судинних клітин та адипоцитів для катаболізації білка ECM фібронектину для підтримки адипогенезу [10]. Повідомлялося, що внутрішньочеревна ін’єкція динатрію хромоглікату (DSCG; широко використовуваний інгібітор активації та дегрануляції МС) мишам дикого типу (WT) перешкоджає здатності набирати масу тіла [11]. Цікаво, що нещодавні дослідження пов’язували позитивні ефекти традиційних продуктів харчування, таких як китайська гірка диня та кверцетин (біофлавоноїд, що міститься в дієтичних рослинах), із здатністю зменшувати приріст маси тіла та резистентність до інсуліну (ІР) до MC, при якому використання таких продуктів зменшує інфільтрацію МК в АТ та запобігає утворенню запального мікросередовища [12, 13]. Маючи молекулярне розуміння перехресних зв’язків між резидентними АТ та інфільтрованими клітинами, включаючи моноцити та макрофаги, може пролити світло на краще лікування ожиріння та супутніх захворювань, таких як ІЧ та діабет.
Походження, розвиток та функція щоглової клітини
a MCs експресують широкий спектр рецепторів до хемокінів та цитокінів. Їх основні рецептори до IgG, IgE та SCF зображені. b Адипоцити отримують із клітин-попередників адипоцитів. Показані їх основні поверхневі рецептори та молекули, що беруть участь у розпізнаванні клітин. c Молекулярний механізм UCP1 у виробництві тепла
Структура жирових тканин і біологія
Хоча спочатку АТ вважали інертним органом накопичення жиру, ця точка зору змінилася за останні десятиліття. В даний час його визначають як високометаболічну та активну тканину, яка реагує на певні хімічні речовини та виробляє багато адипокінів (діючи як ендокринний орган), що регулює обмін речовин [22]. AT - пухка сполучна тканина, що складається з різноманітних клітин, переважно адипоцитів, які оточені матриксом колагенових волокон, фібробластів, кровоносних судин та імунних клітин [23]. Надмірне споживання калорій супроводжується відкладенням жиру та зростанням адипоцитів з подальшою активацією стресу ендоплазматичного ретикулуму та оркестрацією реакцій на окислювальний стрес [24]. Активація цих шляхів призводить до продукування та вивільнення прозапальних цитокінів, головним чином IL-6 та TNF-α [24]. Формування такого прозапального середовища підтримує активацію резидентних лейкоцитів та інфільтрацію інших запальних клітин, включаючи макрофаги, нейтрофіли, дендритні клітини, лімфоцити та MC [24, 25]. ECM відіграє ключову роль у гомеостазі та регуляції AT. Накопичення білків ECM, включаючи колаген, на ранніх стадіях ожиріння сприяє ремоделюванню тканин, завдяки якому стимулюється фіброз та інфільтрація прозапальних лейкоцитів в АТ [26].
AT виробляє широкий спектр адипокінів, які відіграють ключову роль у регуляції метаболізму глюкози та ліпідів [27], а їх порушення регуляції пов’язане із системним запаленням [28]. (Таблиця 1).
AT худих особин виробляє і вивільняє адипокіни з протизапальними властивостями, головним чином, адипонектин та апелін, тоді як AT осіб, що страждають ожирінням, виділяє прозапальні цитокіни, такі як резистин, лептин та вісфатин [43]. Крім того, деякі дослідження виявляють імунорегуляторні властивості адипокінів, таких як адипонектин, який пригнічує активацію макрофагів М1, одночасно сприяючи проліферації підтипу М2 [44]. Проліферація та диференціація преадипоцитів або клітин-попередників адипоцитів усередині судинної фракції строми призводить до утворення нових адипоцитів [45]. Здійснені мишачі предки білих адипоцитів з CD31 -, CD45 -, CD29 +, CD34 +, Sca-1 + та CD24 +/− фенотипом беруть участь у адипогенезі [45] (рис. 2b).
Імунні клітини всередині жирової тканини
Клітини вродженого імунітету
Роль моноцитів та макрофагів у AT
Відмінною особливістю низькоякісного запалення при AT є утворення коронкоподібних структур (CLS), які є синцитіальними структурами, що складаються з оточених некротичних/пошкоджених адипоцитів з макрофагами. Наявність CLS асоціюється з підвищеним рівнем медіаторів запалення, головним чином TNFα та простагландину E2 [53]. Дослідження виявили, що ці макрофаги можуть розсмоктувати залишки ліпідів оточених мертвих адипоцитів, а також сприяти запаленню [54]. Однією з різниць між двома типами білого AT є менша кількість CLS, що присутній у підшкірному AT, порівняно з вісцеральним AT як у ожирілих, так і у худих мишей [55]. Кількість макрофагів F4/80 + CD11b + збільшується у ВАТ із ожирінням. Вони продукують IL-6, TNFα та металопротеїнази (ММР), які пов’язані з розвитком ІЧ та створенням запального мікросередовища [24, 56].
Роль нейтрофілів всередині AT
Нейтрофіли є одними з перших клітин, які інфільтрують AT після початку дієти з високим вмістом жиру (HFD) у мишей [64]. Вони можуть бути залучені до AT за допомогою IL-8, що секретується з адипоцитів, і CXCL2, що секретується макрофагами [24, 58]. Еластаза, що секретується нейтрофілами, сприяє поляризації макрофагів M1 через TLR-4 і погіршує субстрат-1 рецептора інсуліну, що призводить до зниження чутливості AT до інсуліну [24]. У межах АТ нейтрофіли вивільняють прозапальні цитокіни, включаючи IL-8, CCL2, MMP-9 та мієлопероксидазу, які посилюють стан запалення [58]. Докази ролі активації нейтрофілів у ожирінні включають підвищену експресію маркера активації CD66b та збільшення мієлопероксидази та кальпротектину, що вивільняються з нейрофілів. Мієлопероксидаза сприяє розвитку ожиріння, а її абляція або гальмування запобігає набору ваги та ІР [65]. Крім того, вивільнені нейтрофілами супероксиди індукують апоптоз та активують макрофаги, завдяки яким вони сприяють утворенню прозапального стану [29]. Еластаза серед медіаторів, що вивільняються нейтрофілами, має важливе значення для індукції ІР, а інгібування еластази покращує чутливість до інсуліну [64].
Клітини адаптивного імунітету
Залучення клітин вродженого та пристосувального імунітету до організації відповідей на АТ. Показана запальна та протизапальна активність макрофагів М1 та М2
Клітини щогли, що перебувають у жировій тканині
Імуноофарбовування зрізів АТ для триптази та CD117 є загальним підходом, що використовується для визначення присутності популяцій МЦ у межах АТ [11]. МК із своїм прозапальним профілем медіаторів сприяють стану запалення та беруть участь в апоптозі та ангіогенезі і можуть сприяти прогресуванню ожиріння та непереносимості глюкози шляхом вивільнення IL-6 та IFN-γ [11] (Таблиця 2).
Популяція MC у жировій тканині має динамічний характер, демонструючи зміни, пов’язані з ремоделюванням тканин при ожирінні. Як дозрівання, так і диференціація МК можуть відбуватися у ВАТ, оскільки клітини c-Kit + Thy - 1 lo Lin - Sca +, виявлені в підшкірно-жирових прокладках миші, диференціюються в MMC in vitro [22, 68]. Виходячи з анатомічного положення жирових прокладок, таких як підшкірний та епідидимальний жири, МК демонструють різну активність та розподіл [31]. Наприклад, вісцеральний ВАТ мишей із ожирінням демонструє більшу кількість МЦ порівняно з показниками худих мишей. Більше того, немає суттєвої різниці в кількості MC у підшкірному WAT між ожирілими та худими мишами [68]. Глибокі відмінності були виявлені при порівнянні МК в жировій тканині при патологічному ожирінні та після інсульованої баріатричною операцією втрати ваги. Дивно, але спостерігалося різке збільшення жирових клітин-резидентів у групі втрати ваги з десятикратним збільшенням вісцеральної та чотириразового збільшення підшкірної жирової тканини [70]. Миші з дефіцитом МС та стабілізуючі МС агенти, такі як хромоглікат динатрію, послужили спробі визначити роль МЦ-резидентів АТ при ожирінні та ІР. Крім того, повідомлялося про фармацевтичне зниження MCs, коли застосовували піоглітазон, агоніст PPARγ [4, 11].
MC Crosstalk з клітинами жирової тканини
Функція медіаторів MC у жировій тканині - уроки з тваринних моделей
Графічне резюме трьох моделей тварин, щоб продемонструвати участь МС у ожирінні, спричиненому дієтою. (WT: дикий тип, AT: жирова тканина, HFD: дієта з високим вмістом жиру, HSC: гемопоетичні стовбурові клітини, CLOD: ліпосоми натрію клодронату, DSCG: ліпосоми натрію хромоглікату натрію, BMMC: тучні клітини, одержувані з кісткового мозку)
Роль MC у А.Т. Браунінгу
Обговорення та висновки
Хоча огляд висновків вказує на те, що відсутність MCs не перешкоджає ожирінню, дослідження, спрямовані на виявлення взаємодії MCs і адипоцитів, показують, що MCs накопичуються в AT осіб з ожирінням, включаючи як моделі мишей, так і людей. Більш того, АТ-резиденти МЦ під впливом цитокінів, що походять від АТ, активізуються і вивільняють прозапальні цитокіни, що погіршують запальний стан. Крім того, МК відіграють певну роль у реконструкції AT ECM та сприяють набору лейкоцитів із запальною активністю. Потрібні подальші дослідження, щоб повністю визначити перехресні зв’язки між МС та іншими клітинами-резидентами АТ та як це впливає на запалення, енергетичний гомеостаз та індукцію бежевих адипоцитів.
- Вроджені умови гіпофосфатемії у дітей SpringerLink
- Інвалідність та стан здоров’я CDC
- Відкриття того, як клітини відчувають рівень кисню, приносить Нобелівську премію
- Вплив Giardia duodenalis на білки, що недоїдають і не харчуються мишами SpringerLink
- Поліморфізм генів FTO та ризик ожиріння серед китайської популяції, мета-аналіз SpringerLink