Параметри астроцитоми
Зрозумійте варіанти діагностики астроцитоми.
Дететарні зміни є привабливим способом адаптації до реальності діагнозу раку, оскільки дієта є одним із аспектів зцілення, який повністю залежить від пацієнта. Факт, добре відомий в галузі онкології, полягає в тому, що кожна пухлина і тип пухлини має унікальний генетичний профіль з індивідуальним набором мутацій, зміною кількості копій, експресією білка тощо. Отже, різні пухлини, і особливо пухлини, що походять з різних тканин, або різні підтипи пухлин, що виникають в одній тканині (наприклад, гліобластома проти мутантної астроцитоми IDH1), можуть мати різні метаболічні потреби та різну чутливість до різних форм дефіциту поживних речовин. Подібно до того, як не існує жодного протиракового препарату, який би однаково добре працював для кожного виду раку, ймовірно, не існує єдиної протиракової дієти. В ідеалі дієта повинна бути адаптована до унікальної чутливості типу пухлини, якщо такі знання існують.
Що включити
Існує велика література про харчові продукти з потенційними протираковими властивостями. Дієта - це питання особистого смаку, що, мабуть, для кожної людини краще проводити більшу частину власних досліджень щодо вибору дієти. Основна частина протиракових продуктів потрапляє під заголовки овочів, фруктів або спецій. Кілька основних рекомендацій можуть бути:
- Максимізуйте мікроелементи щільною, низькокалорійною рослинною їжею
- Загальне споживання фруктів слід контролювати через вміст цукру, хоча багато видів ягід відрізняються своїми протираковими компонентами, наприклад птеростильбеном, що міститься в чорниці та винограді
- Визначте, скільки насправді потрібно вашому тілу білка (можливо, десь близько 8-10% калорій як білка (0,65-0,85 грама білка на кілограм маси тіла) і обмежте споживання білка до цього рівня. Потреба в певних амінокислотах зросте однак при відновленні після операції або радіохіміотерапії
- Намагайтеся підтримувати стабільний рівень глюкози в крові, уникаючи занадто великої кількості цукру, крохмалю та продуктів з високим глікемічним індексом
- Обмежте жирні кислоти омега-6 (переважно олії, отримані з насіння) та включайте омега-3 оливи з довгим ланцюгом ЕРА та DHA, що містяться в холодноводній рибі. Важливість вибору правильних жирів заслуговує власного розділу.
Жири та олії
Головне, про що слід пам’ятати, вибираючи жири та олію у своєму раціоні, - це те, що рак процвітає завдяки омега-6 жирним кислотам, зокрема 20-вуглецевій арахідоновій кислоті. Ракові клітини використовують арахідонову кислоту як попередник для утворення запальних простагландинів (таких як PGE2) та лейкотрієнів, які сприяють розвитку раку та головним фактором, що спричиняє запалення мозку. Частина арахідонової кислоти в наших клітинах складається з омега-6 жирних кислот з меншими ланцюгами, таких як лінолева кислота. Однак набагато більша частка може вживатися безпосередньо в продуктах харчування. В яйцях по суті багато арахідонової кислоти, оскільки вона необхідна для розвитку ембріонів. М'ясо, що згодовується зерном, також може бути рясним джерелом дієтичної арахідонової кислоти. У багатьох насіннєвих оліях багато омега-6 лінолевої кислоти, за винятком лляної олії та деяких інших.
Іншим способом обмеження запалення, що сприяє розвитку раку, є включення рясної кількості довголанцюгових омега-3 жирних кислот, таких як ЕРА та DHA, які конкурують за ті самі ферменти, що і омега-6 олії, та мають протизапальну дію. Основним джерелом EPA та DHA є різні види холодноводних риб. Важливо переконатися, що ваш продукт з риб’ячого жиру пройшов перевірку на наявність ртуті та інших промислових забруднень. Оптимальна доза риб'ячого жиру не була чітко встановлена в клінічних випробуваннях, однак добова доза 3 грам комбінованих ЕРА та DHA мала користь у дослідженні метастазованих (вторинних) пацієнтів з пухлиною головного мозку.
Конкретні поживні речовини та нутрицевтики (хімічні речовини, отримані з харчових продуктів, що мають властивості, подібні до наркотиків) будуть розглянуті в розділі "Додатки".
Стратегії обмеження доступу пухлини до поживних речовин
Дослідження з щурами, що несуть гліому, говорить нам, що залежно від контексту дієтичні добавки заліза можуть бути або шкідливими, або корисними для хворих на рак (18). Залізо є найважливішим поживним елементом для проліферації клітин, і високоякісні гліоми мають підвищену експресію рецепторів трансферину (19). Трансферин є основним білком-носієм заліза. У дослідженні щурів (18) самцям щурів Wistar імплантували в стегно хімічно індуковану клітинну лінію гліоми щурів (штам 35), і після утворення пухлинного вузла щурів поділяли на кілька груп лікування. Контрольним щурам давали водопровідну воду, що містить 0,2-0,3 мг/л іонів заліза (Fe 2+). Інша група щурів отримувала питну воду з добавкою 60-63 мг/л іонів заліза (Fe 2+). У групі, що отримувала залізо, пухлини зростали швидше, ніж у контрольній групі, а щури, яким додавали залізо, мали на 34% коротший термін життя, ніж контрольна група.
На відміну від цього, коли щурам давали разову дозу опромінення 15 Гр на область пухлини, щури з добавкою заліза мали набагато кращу реакцію на випромінювання та довше виживання, ніж щури, які отримували опромінення, але ніяких добавок заліза не отримували. Ці опромінені, доповнені залізом щури жили вдвічі довше, ніж необроблені контрольні щури. Клітини гліоми в групі, що опромінювалась, з добавкою заліза, гинули внаслідок поєднання апоптозу та ферроптозу, однієї із форм залізозалежної загибелі клітин. Таким чином, залізо виглядає як ефективний радіосенсибілізатор, але насправді може стимулювати ріст пухлини поза контекстом радіації.
Обмеження калорійності
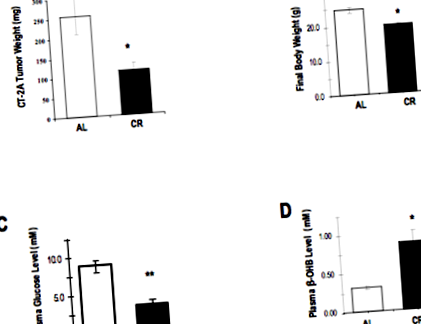
Багаторазові експерименти з мишами показали потенційну користь обмеження калорій (CR) у значному уповільненні росту імплантованих пухлин головного мозку. У цих експериментах використовували високоангіогенну астроцитому миші CT-2A, імплантовану імунокомпетентним мишам. Цю модель можна розглядати як імітацію високоангіогенних гліом людини, зокрема гліобластом.
В одному з цих досліджень (8) мишей отримували дієту звичайної миші, яка калорійно обмежувалась на 30% порівняно з необмеженою контрольною групою. Цей ступінь обмеження калорій призвів до того, що миші втратили 30% ваги тіла протягом двотижневого періоду, тоді всі тварини були принесені в жертву.
Результати цього обмеження калорійності росту та біології пухлини є досить вражаючими. До кінця двох тижнів вага пухлини зменшився на 65% у групі CR порівняно з контрольними мишами. Глюкоза в крові була знижена на 63%, а кетонових тіл - на 114% у мишей CR.
Ефекти обмеження калорійності (CR) проти годівлі ad libitum (AL) у мишей, що несуть гліому
На молекулярному рівні активація фактора транскрипції ядерного фактора каппа-бета (NF-KB) (див. Обговорення в статті "Цільова інвазія") була значно знижена, як і рівні ферменту ЦОГ-2 (див. Обговорення Celebrex у відновлених препаратах). Обидві ці молекули беруть участь у біології злоякісних гліом і сприяють таким процесам, як інвазія, ангіогенез та імуносупресія. Приваблюючий макрофаги хемокін CXCL2 (або MIP-2) та маркер макрофагів CD68 були значно знижені у мишей CR, що свідчить про зменшення інфільтрації макрофагів у пухлину (див. Орієнтація на макрофаги, пов’язані з пухлинами/мікроглія).
Подібні дослідження обмеження калорійності у мишей з експериментальними гліомами деталізують додаткові переваги та механізми, за допомогою яких обмеження калорій може перешкоджати росту та інвазивності пухлини. Одне застереження полягає в тому, що метаболізм мишей приблизно в сім разів швидший, ніж метаболізм людини. Тому для повторення цих результатів у людей буде потрібно більш суворе обмеження калорій. Ступінь схуднення є більш точним показником наслідків обмеження калорій. Оскільки миші в цьому дослідженні втратили 30% ваги тіла протягом двох тижнів, цей ступінь обмеження калорій, очевидно, досить екстремальний і не був би стійким у довгостроковій перспективі, хоча тривале підтримання маси тіла в нормальний діапазон, ймовірно, був би корисним.
Стимулюючий вплив обмеження калорій на протираковий імунітет вивчається на сторінці Перевиховання імунної системи.
Обмеження білка та IGF-1
Якщо ви живете в одній з найбільш багатих країн світу, ви, швидше за все, вживаєте більше білка, ніж насправді потрібно вашому організму. З трьох джерел калорій (вуглеводи, білки та жири), протеїн, мабуть, має найкращу репутацію корисного для здоров’я, тому ми не часто чуємо про переваги зменшення споживання білка.
Середнє споживання для північноамериканців та північних європейців становить близько 15-18% від загальної кількості калорій у вигляді білка. Це значно більше, ніж рекомендована добова доза 10% калорій як білка (або приблизно 0,83 грама білка на кілограм ваги). RDA розроблений для задоволення потреби в білках 97,5% дорослого населення. Середня потреба в білку для здорової дорослої людини навіть менша, ніж це: 0,65 г білка на кілограм маси тіла, або, можливо, 8% від загальної кількості калорій (9). Окінавці, населення з дуже низьким рівнем раку, приймають близько 9% калорій як білок (10).
Інсуліноподібний фактор росту 1 (IGF-1), як випливає з його назви, сприяє клітинному зростанню. Приєднуючись до свого рецептора (IGF1R), він ініціює активацію сумнозвісного сигнального шляху PI3K/Akt/mTOR, який є надмірно активним при багатьох видах раку, включаючи астроцитоми високого та низького рівня (11). Насправді, одним із основних препаратів, який зараз тестується в клінічних випробуваннях на гліому низького ступеня, є еверолімус, інгібітор mTOR. Тут виникає важливість обмеження білка.
Обмеження білка проти обмеження калорій
Як дослідження на тваринах, так і на людях виявили, що споживання білка є головною детермінантою рівня IGF-1 у сироватці крові. Одне дослідження (9) поставило групу людей на дієту з обмеженням калорій на 20% протягом року. Хоча це помірне тривале обмеження калорій знижувало рівень інсуліну та С-реактивного білка (маркер запалення), сироватковий IGF-1 у цій групі не знижувався. Потім дослідники порівняли членів Товариства обмеження калорій (споживаючи в середньому 1800 ккал на день, 24% від загальної кількості калорій з білка) з вегетаріями без калорійного обмеження, які їдять лише 10% від загальної кількості калорій як білок. В обох групах був низький рівень інсуліну та С-реактивного білка, але вегани з низьким вмістом білка мали нижчий рівень загального та вільного IGF-1, незважаючи на вищу масу тіла, індекс маси тіла та вміст жиру в організмі. Для подальшого доказу кореляції споживання низького вмісту білка зі зниженим IGF-1, шість членів групи обмеження калорій зменшили споживання білка на 43%, до рівня трохи вище рівня середнього вегана з низьким вмістом білка, протягом трьох тижнів. Це втручання призвело до 25% зниження рівня IGF-1 у сироватці крові.
Зв'язок між споживанням білка, рівнем IGF-1 та рістом пухлини було продемонстровано в контрольованих дослідженнях на тваринах. Та сама група, яка опублікувала раніше описане дослідження (9), також провела дослідження, порівнюючи 7% до 21% загальної кількості калорій як білок у мишей, яким прищеплювали клітини раку простати та молочної залози (10). Коли миші отримували 21% або 7% білкової дієти протягом чотирьох тижнів до імплантації клітин раку передміхурової залози, різниця у споживанні білка призвела до 81% зменшення маси пухлини для нижчої білкової групи до кінця дослідження. Коли обмеження білка було розпочато через чотири тижні після імплантації пухлинних клітин, нижча білкова група мала на 50% легші пухлини, ніж вища білкова група до кінця дослідження. Важливо зазначити, що між двома групами не було різниці у масі тіла або рівні глюкози, що свідчить про те, що рівень глюкози не впливав на обмеження росту пухлини, яке спостерігалося в цьому дослідженні. Вражаюче, ксенотрансплантати раку передміхурової залози ледве росли в мишах з обмеженим вмістом білка.
Потім у цьому ж дослідженні дослідники порівняли обмеження білка з хіміотерапією з інгібітором mTOR еверолімусом, а також обмеженням білка та еверолімусом разом. Миші з обмеженим вмістом білка (7% від загальної кількості калорій як білок) і миші, яким давали еверолімус, мали подібний ступінь пригнічення росту пухлини. Пухлини були найменшими, коли обмеження білка поєднувалося з еверолімусом. Щоб пояснити це ефективне інгібування пухлини, тестували рівні фосфорильованого (активного) mTOR, фосфорильованого S6K (нижча мішень mTOR) та Ki67 (маркер клітинної проліферації). Обмеження білка дуже суттєво знижувало кожен з цих трьох маркерів, як і терапія еверолімусом самостійно, з найбільшим гальмуванням після комбінованого обмеження білка та еверолімусу. Автори відзначають, що обмеження білка є більш потужним, ніж обмеження калорій або жиру, при зниженні рівня IGF-1.
Ці дослідження, що показують ефективність обмеження білка для зниження рівня IGF-1 та уповільнення росту пухлини, є дуже обнадійливими, оскільки, хоча обмеження калорій може забезпечити користь у короткостроковій перспективі, споживання меншої кількості калорій, ніж вимагає організм, не може бути стійким у довгостроковій перспективі . Переваги обмеження білка, з іншого боку, не залежать від обмеження калорій, і тому можуть зберігатися в довгостроковій перспективі.
мутантні пухлини p53 та депривація глюкози
Більшість мутацій гена TP53 при раку спричиняють надмірну експресію мутантних білків p53, які набули онкогенного посилення функції. Справа не просто у втраті функції супресора пухлини p53, а в посиленні функції промотору пухлини мутантними білками. Мутації TP53 є майже універсальними для IDH-мутантних астроцитом, а також часто зустрічаються в IDH-мутантних олігоастроцитомах та деяких підтипах гліобластоми. Дослідження (16), опубліковане в 2012 році в журналі Cell Cycle групою з університету Джорджтауна у Вашингтоні, пропонує докази того, що накопичення білка мутантного p53 може гальмуватися дієтою з обмеженим вмістом вуглеводів, що призводить до значного гальмування росту пухлини у мишей з мутантами p53 пухлини.
Вчені вперше показали, що експресія мутантних білків p53 може пригнічуватися in vitro, виснажуючи концентрацію глюкози в клітинному середовищі. І навпаки, на експресію мутантного p53 не впливало виснаження сироватки та амінокислот. Встановлено, що це пригнічення накопичення мутантного p53 після виснаження глюкози відбувається внаслідок деградації (розщеплення) білка внаслідок аутофагічного процесу, а не активності протеасом.
Потім цей розпад мутантного p53 шляхом обмеження глюкози тестували на мишах. Трансгенних мишей p53-мутантів (p53 A135V) та мишей дикого типу (немутантів) рандомізували на одну з трьох дієт: звичайну чау-мишу, дієту з низьким вмістом вуглеводів та дієту з високим вмістом вуглеводів. Дієта з низьким вмістом вуглеводів складала 74% білка, 24% жиру та 2% вуглеводів за калорійністю, або 71,7% білка, 10% жиру та 1,9% вуглеводів за вагою (решта - клітковина, вітаміни та мінерали). За калорійністю стандартна дієта та високовуглеводні дієти становили 53% та 69% вуглеводів, 20% та 17% білків.
Аналізи крові показали, що миші на низьковуглеводній дієті значно знизили рівень глюкози в крові натще: приблизно 100 або Поділіться цим
- Дістилятори для зерна пропонують варіанти годівлі свиней, копаючи глибоко, щоб заробити на національному свинарському фермері DDGS
- Визначна серія лекцій Здорова дієта - що ми знаємо, а що просто обман - Календар IRSC
- Дієтична їжа Дженні Крейг - ресурси для схуднення
- Повідомлення дієтичних новин пацієнтам, що не бажають - Публікації Раеналі
- РАЙОННИЙ ІНСТИТУТ ОСВІТИ; НАВЧАННЯ (ДІЄТА), Надя П