Ожиріння впливає на лихоманку та поведінку хворих під час гострого системного запалення
Кафедра ветеринарної-фізіології та біохімії, Університет Юстаса-Лібіха, Гіссен, Гіссен, Німеччина; і
Кафедра ветеринарної-фізіології та біохімії, Університет Юстаса-Лібіха, Гіссен, Гіссен, Німеччина; і
Кафедра ветеринарної-фізіології та біохімії, Університет Юстаса-Лібіха, Гіссен, Гіссен, Німеччина; і
Кафедра ветеринарної-фізіології та біохімії, Університет Юстаса-Лібіха, Гіссен, Гіссен, Німеччина; і
Кафедра ветеринарної-фізіології та біохімії, Університет Юстаса-Лібіха, Гіссен, Гіссен, Німеччина; і
Група досліджень функції мозку, Школа фізіології, Факультет наук про здоров'я, Університет Вітватерсранда, Йоганнесбург, ПАР
Анотація
Ожиріння набуває значних масштабів у людей і пов'язане з вищим ризиком серцево-судинних захворювань, діабету та когнітивних змін, а також вищою смертністю під час інфекції та запалення. Основна увага в цьому огляді зосереджена на впливі ожиріння на прояви лихоманки, поведінки при хворобі та запальних реакцій під час гострого системного запалення.
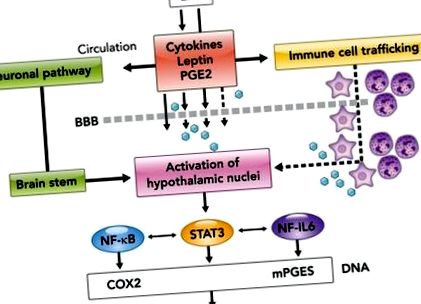
ФІГУРА 1.Імунна передача сигналів до мозку під час гострого системного запалення
Як повідомляється, протизапальні цитокіни [наприклад, антагоніст рецепторів IL-1 (IL-1ra) та IL-10] та глюкокортикоїди, серед інших медіаторів, беруть участь у регулюванні відновлення поведінки, що залежить від PGE2, лихоманки та хвороби (133) . Крім того, пропонується транспортер PGE2 (PGT), який відіграє роль у припиненні лихоманки через кліренс PGE2 з мозку (63). Дійсно, було показано, що експресія транспортера PGE2 (PGT) (35) індукується після системного введення LPS вздовж ендотеліальних клітин та оболонок мозку, схильних до видалення PGE2 з мозкової тканини. Крім того, було показано, що експресія PGT досягає піку, коли рівні PGE2 у лікворі починають різко знижуватися (63).
Хоча лихоманка є загальною реакцією на інфекцію та запалення, у важких випадках сепсису та септичного шоку може спостерігатися переохолодження, стан або відповідь, що характеризуються температурою тіла нижчою за нормальну (8, 23). Було запропоновано, що перехід від лихоманки до переохолодження, який відзначається під час важких форм інфекції, може бути регульованою реакцією терморегуляції, спричиненою змінами в термоефекторній активності, зумовленими мозком, тобто інгібуванням термогенезу, а не просто терморегуляційною недостатністю через шок пов'язані з важкою інфекцією (5, 6, 131). Медіатори та модулятори, які пропонується брати участь у змінах активності термоефектора, обумовлених мозком, необхідних для індукції переохолодження, включають ендоканнабоїди та ліпідні медіатори запалення, такі як фактор активації тромбоцитів, простагландини, епоксиеікозатрієнові кислоти та лейкотрієни (посилання 158; для огляду). див. посилання 129). На додаток до перерахованих вище ліпідних медіаторів запалення, також передбачається, що фактор некрозу пухлини цитокінових запалень (TNF) -α потенційно відіграє роль у переохолодженні, викликаному інфекцією (78, 85, 165); Однак, точний механізм, за допомогою якого ФНО опосередковує переохолодження, залишається предметом дискусій.
Все більший обсяг роботи зафіксував вплив багатьох факторів, пов’язаних із способом життя, таких як ожиріння, дієта, старіння, фізичні навантаження та стрес, на запальні процеси, що розпочалися під час гострої та хронічної інфекції та запалення (2, 26, 53, 90, 98, 105, 127, 174). Основна увага в цьому огляді зосереджена на впливі ожиріння на прояви лихоманки, поведінки при хворобі та запальних реакцій, відзначених під час гострого системного запалення, як описано вище.
Фізіологічний стан переїдання (ожиріння) складний і передбачає збільшення зберігання ліпідів у білій жировій тканині (ВАТ). На величину збільшення та розподілу ВАТ впливає вік. Залежно від своєї функції, WAT можна класифікувати на депоновану WAT, структурну WAT та волокнисту WAT (147), а кровопостачання та метаболічна функція WAT частково не регулюється зі старінням (36). На додаток до того, що ВАТ виконує свою фізіологічну функцію накопичення енергії або структурного захисту, наприклад, у нирках, він також добре відомий як важливий ендокринний орган, який виділяє різноманітні так звані адипокіни, такі як лептин або адипонектин, і цитокіни, включаючи IL-1β, IL-6, TNF-α та IL-1ra, які позначаються як адипоцитокіни, коли вони походять від WAT (84, 166). РИСУНОК 2 показує, що під час ожиріння відбувається перехід до низькопрофільного прозапального стану через збільшення прозапальних медіаторів та зміну протизапальної регуляції.
РИСУНОК 2.Патофізіологічні зміни, які сприяють виникненню запального стану під час ожиріння залежно від ступеня ожиріння тіла та стану здоров’я (2, 4, 169)
• апелін, який зменшує LPS-індуковану лихоманку при введенні внутрішньоцеребровентрикулярно (icv) (61)
• C1q/TNF-пов'язаний білок 13, який зменшує споживання їжі та масу тіла при введенні icv (17)
• вісфатин, який викликає лихоманку, анорексію та млявість при введенні icv (110).
Ожиріння асоціюється із збільшенням надходження імунних клітин з периферії в мозок (3, 16, 153). Дійсно, за певних умов периферичні моноцити можуть вторгнутися в мозок і стати мікроглією (97). Один із основних механізмів рекрутування імунних клітин у мозок під час ожиріння може стосуватися фракталкіну хемокінів (CX3CL1), який, як видається, виражається в ожирінні, спричиненому дієтою (DIO), та моделях ожиріння HFD. Було показано, що ін’єкція невеликих заважаючих РНК до CX3CL1 в дугоподібне ядро гіпоталамуса зменшує набір моноцитів та ожиріння у трансплантованих зеленим флуоресцентним білком кістковому мозку трансплантованих мишей дикого типу HFD (100). Крім того, миші з дефіцитом рецепторів CX3CR1 демонструють зменшений набір мієлоїдних клітин у ВАТ (119). Більше того, ми показали, що лептин може впливати на відомі точки входу імунних клітин у мозок, а саме навколо шлуночків, уздовж мозкових оболонок та судин головного мозку (139), щоб набирати нейтрофільні гранулоцити до мозку (138). У подальших дослідженнях тривалі LPS-індуковані поведінкові зміни, зафіксовані у мишей із ожирінням, були пов'язані з посиленим залежною від лептину вербуванням мозку нейтрофільних гранулоцитів (3).
Потенційна роль мікробіома в кишечнику в індукції запалення гіпоталамуса також виявляється (145), оскільки, як було показано, перенесення мікробіомів на вільних від зародків гризунах веде до розвитку фенотипу ожиріння (37, 126). Окрім прийому HFD, підвищена проникність кишечника та подальше вивільнення ендотоксинів з мікробів кишечника в кровообіг може також частково пояснити наявність запалення гіпоталамусу та посилену ендотоксемію, зафіксовану у людей з ожирінням та ожирінням (11, 25). Люди, що страждають ожирінням, можуть не тільки ризикувати підвищеною ендотоксемією, але й дефектами термогенезу. Спостереження, що центральне введення TNF-α у низьких дозах призводить до зниження активності НДТ, вказує на те, що деякі дефекти термогенезу, відзначені при ожирінні, також можуть бути пов’язані із запаленням гіпоталамусу низького ступеня, що виникає при ожирінні (9). Однак внесок НДТ в терморегуляцію дуже залежить від виду та віку, і, таким чином, хоча він і залишається перспективною метою лікування ожиріння, його актуальність потребує подальшого з'ясування (177).
Таблиця 1 Короткий зміст генетичних моделей, що використовуються для дослідження впливу ожиріння на гарячку та поведінку при хворобі
ip, внутрішньочеревно; iv, внутрішньовенно; sc, підшкірна; Щури Цукер (фа/фа); Щури з дефіцитом рецепторів лептину (щури Колецького); Щури Otsuka Long-Evans Tokushima Fatty (OLETF); Миші з дефіцитом рецепторів лептину (дб/дб); Миші з дефіцитом лептину (об/об). Тире вказують значення, які не були виміряні або надані.
Щури Колецьких з безглуздою мутацією рецептора лептину (162) та щури OLETF, у яких відсутній рецептор холецистокініну-А, не виявили суттєвих відмінностей у гарячкових реакціях на ЛПС під час експериментів, проведених у термонейтральному середовищі (температура навколишнього середовища 28 ° С). або 29 ° C) (67, 155). Однак результати дослідження, проведеного з використанням щурів OLETF, як правило, припускають, що фебрильна реакція може бути посилена у щурів OLETF із ожирінням, оскільки статистичне порівняння значень, отриманих для 6-годинного індексу лихоманки, дало P значення 0,07. Після введення високої дози LPS (100 мкг/кг) щурам Колецького при субтермонейтральній температурі навколишнього середовища (тобто 22 ° C), щури мали тривале переохолодження, що супроводжується 1) притуплене збільшення кортикостерону, потенційно пов'язане з дефіцитом лептину (155), і 2) підвищений рівень циркулюючого TNF-α, що часто спостерігається під час важкого септикоподібного запалення та пов’язане з індукованою інфекцією гіпотермією (78, 85, 165).
Таблиця 2 Короткий зміст досліджень, що вивчають вплив ожиріння, спричиненого дієтою, на лихоманку, поведінку при хворобі та запалення, викликане введенням ЛПС
DIO, ожиріння, спричинене дієтою; ∗, симптоми хвороби млявості, птозу, пілоерекції, пози плоского тіла та носових виділень оцінювали за допомогою п’ятибальної шкали, адаптованої за моделлю миші; IDO, індоламін-2,3-діоксигеназа. Тире вказують значення, які не були виміряні або надані.
Спостереження про те, що нейтралізація дії периферично вивільненого IL-6 та лептину послаблює останню частину фебрильної фази у щурів DIO, схоже, впливає на лептин та IL-6 у модуляції тривалої лихоманки, що відзначається при введенні LPS у ожирілих тварин (118). І лептин, і IL-6 передають сигнал шляхом JAK-STAT3, і ми, та інші, показали, що під час індукованого LPS запалення лептин та IL-6 сприяють просторово-часовій активації STAT3 1) клітини в структурах мозку, що беруть участь у розвитку лихоманки та анорексії та 2) ендотеліальні та гліальні клітини у всьому мозку (48, 57, 58, 102, 134, 137, 139, 141, 142).
На відміну від досліджень, що демонструють посилену реакцію поведінки на хворобу із посиленим запаленням гіпоталамусу у щурів/мишей DIO після введення ЛПС, є деякі дослідження, які повідомляють про ослаблені реакції поведінки при хворобі. Миші HFD демонстрували ослаблену депресивно-подібну поведінку, як оцінювали за допомогою тесту на підвіску хвоста (TST) та анорексію через 1 день після введення ЛПС, але посилювали запалення в гіпокампі та гіпоталамусі (7). Цікаво, що Піні та його колеги також продемонстрували ослаблену втрату маси тіла у мишей DIO день 1 після адміністрування ЛПС (112). Однак у тому ж дослідженні анорексія значно подовжувалась і посилювалась у щурів DIO порівняно з худими щурами на день 7. Таким чином, як також визнано Андре та співавт. (7), час вимірювань поведінки хвороби потрібно ретельно контролювати, оскільки перебільшені реакції на хворобу, наслідком посиленої запальної реакції на периферії та мозку, можуть бути відзначені лише пізніше.
Як вже згадувалося раніше, існують системи протидії (вісь HPA), які беруть участь у зниженні температури (133) та реакцій на поведінку при хворобі (72). Відмінності в моделях ожиріння та між ними, наприклад, генетичні або DIO/HFD, можуть призвести до різних гострих або хронічних процесів, що супроводжуються власними різними ефектами на вісь HPA, що, в свою чергу, може впливати на те, як генетичні або DIO/HFD ожиріння тварини реагувати на запальний подразник, такий як ЛПС. Обговорені вище дослідження виявили, що активність осі HPA є такою 1) посилюється при холодовому стресі і на початковому рівні у щурів Цукера (176), і 2), покращений HFD або DIO (151, 163). Примітно, нещодавнє дослідження показало, що мікрогліальна активація та запалення в мозку (гіпокампу) дб/дб миші залежали від глюкокортикоїдів; глюкокортикоїди знижують поріг вивільнення прозапальних цитокінів у дб/дб миші (34).
Хоча відповідний внесок маси тіла як такої як дієти у вплив на реакції на гарячку та хворобу під час гострого запалення залишається суперечливим, існує припущення, що рівень ожиріння може відігравати певну роль (92). Більше того, також було виявлено, що запальна реакція може змінюватися в залежності від структур мозку і дійсно може бути більш вираженою в областях мозку, що опосередковують реакції на хворобу, таких як гіпоталамус та гіпокамп, порівняно з іншими регіонами мозку. Якщо рівень ожиріння дійсно відіграє роль у визначенні реакцій на гарячку та хворобу під час гострого запалення, деякі відмінності, зафіксовані у результатах, отриманих у кількох дослідженнях з використанням ДІО, можуть бути пов'язані зі складом дієти (92).
Хоча повна патофізіологічна картина ще не з’ясована, загалом, як показано на ФІГУРІ 3, сучасна література підтримує припущення, що ожиріння саме по собі посилює запалення в головному мозку (збільшення цитокінів та активація мікроглії) та на периферії (підвищений рівень цитокінів у циркуляції; наприклад, IL-6 та адипокіни, наприклад, лептин). Коли ожиріння поєднується з додатковим викликом вродженої імунної системи, як, наприклад, ЛПС, виявляється, що подальші реакції запалення (IL-6, TNF, IL-1β) та реакції на хворобу (лихоманка та поведінка при хворобі) стають більш помітними. Посилені реакції запалення та хвороби потенційно пов'язані зі станом так званого "грунтування" (7, 112, 117), подібним до того, що, як пропонувалося, має місце в процесі старіння (104). У людей кілька досліджень фактично підтверджують клінічну значимість спостережень, проведених у дослідженнях, проведених на ожирілих тваринах. Наприклад, ожиріння асоціюється з тривалою лихоманкою під час інфекцій сечовивідних шляхів (175), а індекс маси тіла> 34 - із післяпологовою фебрильною захворюваністю у матерів-підлітків (52).
РИСУНОК 3.Ожиріння впливає на реакцію на системні інфекції та запалення
Прозапальний стан низького ступеня, який відзначається під час ожиріння, також може бути одним із причинних факторів підвищеного ризику розвитку серцево-судинних захворювань, діабету (64) і навіть, можливо, психічних захворювань, пов'язаних з ожирінням (2). Більше того, деякі дослідження припускають більш високий ризик розвитку інфекції у людей із ожирінням та вищий рівень смертності серед осіб із ожирінням під час зараження (42, 81, 138, 154, 161). Однак потенційний зв’язок між ожирінням та вищою смертністю не є прямолінійним і, схоже, залежить від конкретного захворювання/інфекції, кардіометаболічної придатності, віку, статі, генетики та раніше існуючих захворювань людини (46, 109). Більше того, ожиріння може мати навіть певний захисний потенціал, наприклад, під час сепсису, було відзначено наявність лептину, ключового адипокіну, підвищеного під час ожиріння, для стабілізації температури тіла, поліпшення клітинної імунної відповіді та зменшення прозапальних цитокінових реакцій (152 ). Таким чином, ожиріння в деяких випадках може бути більше модулятором, ніж підсилювачем реакцій на хворобу та імунною активацією під час інфекції.
СНОПКИ
Цю роботу підтримала Програма зв’язків групи Фонду Олександра фон Гумбольдта (L.M.H., C.R.), а C.R. - за підтримки Програми Еммі Нотер Німецького дослідницького фонду (проект DFG RU 1397/2-1).
Ніяких конфліктів інтересів, фінансових чи інших, автор не заявляє.
- Ожиріння та сидяча поведінка Що таке курка, яка яйце Південна Флорида Сонце Сентінель - Південь
- Ожиріння та хрипи здорово
- Нові підказки, чому неправильне харчування в утробі матері призводить до ожиріння в подальшому житті - ScienceDaily
- Ожиріння та надмірна вага мозку можуть пришвидшити старіння мозку; Поради щодо запобігання ожиріння
- Ожиріння та гіпомагніємія - PubMed