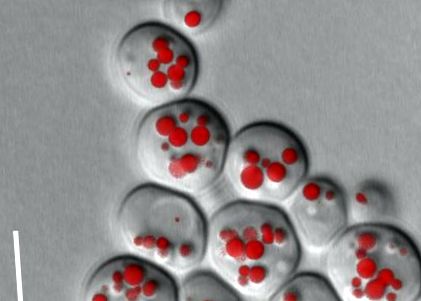
Ожирілі та тонкі дріжджові клітини
Мікроскопічне розуміння клітинного метаболізму ліпідів
Сьогодні ліпіди на вустах у всіх, незалежно від того, жирні кислоти ω-3/6, хороший і поганий холестерин чи просто жир, який має прикру звичку накопичуватися на наших стегнах. Такі серйозні захворювання, як ожиріння, атеросклероз та цукровий діабет 2 типу, безпосередньо пов’язані з порушеннями ліпідного обміну. Модель системних дріжджів ("хлібопекарські дріжджі") забезпечує чудові можливості для вивчення асоційованих з ліпідами захворювань, включаючи використання мікроскопії високої роздільної здатності.
Автори
Теми та теги
Жир як фактор ризику
Відповідно до його центрального значення для організму, ліпідний обмін контролюється за допомогою різноманітних механізмів регуляції. Однак ці механізми переоцінені нашим сучасним способом життя занадто великою кількістю їжі та відсутністю фізичних вправ. Різкий розвиток захворювань, асоційованих з ліпідами, у промислово розвинутих країнах схильний до поширення негативного іміджу ліпідних речовин. Проте жир у найрізноманітніших формах є необхідним інгредієнтом усіх клітин. Навіть сильно злоякісні тригліцериди відіграють життєво важливу роль як буфер надлишків та потенційно небезпечних жирних кислот у нашому кровообігу або як запас енергії.
Лише нещодавно в жировій тканині був знайдений основний фермент, що руйнує жир (ATGL, жирова тригліцеридна ліпаза) [1], що продемонструвало, що дослідження жирів, як і раніше, є "золотою копалиною" для виявлення нових біомедично важливих ключових факторів (див. Також: GOLD - Геноміка порушень, пов’язаних з ліпідами, проект, проведений в рамках австрійської програми досліджень геному GEN-AU, та спеціального дослідницького проекту LIPOTOX, що фінансується FWF [Австрійський науковий фонд].
Великий погляд на маленькі клітини
Окрім молекулярно-біологічних, геномних та протеомічних методів, світлова мікроскопія з високою роздільною здатністю важлива для отримання інноваційного розуміння клітинного синтезу ліпідів, ліпідної та мембранної динаміки та морфологічних змін у зв'язку з порушеннями ліпідного обміну.
Діаметр дріжджової клітини 5–8 мкм вважався непридатним зразком для мікроскопічного дослідження. Насправді, технологічний прогрес, досягнутий у мікроскопії за останні кілька років завдяки вдосконаленим методам візуалізації та чудовим цілям, тепер може вирішити субклітинні структури дріжджових клітин (рис. 1). Конфокальна лазерна скануюча мікроскопія пропонує особливі переваги для тривимірного аналізу клітин, що спостерігаються у фізіологічних умовах протягом декількох поколінь [2]. Проблеми дифракції та розсіяного світла мінімальні через тонку товщину клітин. Типова бічна та осьова роздільна здатність становить приблизно. 150 нм та 350 нм відповідно. Тривимірна реконструкція, досягнута шляхом запису великої кількості "оптичних зрізів", і одночасне виявлення декількох флуорофорів дають абсолютно нові уявлення про просторові та динамічні взаємодії білків і ліпідів у живих клітинах.
Наявність варіантів флуоресцентного білка (наприклад, GFP - зелений флуоресцентний білок) у зв'язку з надзвичайно простими методами клонування створила основу для досліджень локалізації та експресії всіх білків протеома дріжджів (яких налічується приблизно 6000) [3]. Надійні протоколи підготовки до мікроскопії живих клітин та фарбування життєво важливих елементів дозволяють одночасно спостерігати за великими популяціями клітин, що є чудовою основою для збору кількісних даних мікроскопії.
Через товсті та тонкі дріжджі при дослідженні ліпідного обміну
Жири для зберігання містяться в клітині у вигляді крапель жиру. Однак це не пасивні жирові депо, а динамічні органели з численними білками та специфічними біохімічними функціями. Біогенез крапель ліпідів тісно пов’язаний із синтезом жирів, що зберігаються: якщо синтез вимкнений внаслідок мутації, не утворюються крапельки ліпідів, і утворюються «тонкі» дріжджові клітини. Ці мутанти особливо чутливо реагують на надлишок жирних кислот, які більше не можуть вбудовуватися в запасний жир. Ця ліпотоксичність жирних кислот також спостерігається у подібній формі в клітинах тварин. Тому ми можемо зробити висновок, що синтез запасного жиру є важливим клапаном для забезпечення надмірної жирної кислоти метаболічно нешкідливою. Біогенез та динаміку цих крапель ліпідів можна зобразити під мікроскопом високої роздільної здатності шляхом фарбування життєво важливими барвниками або міченими GFP білками (рисунок 2).
Якщо ферменти, що розщеплюють жир, вимкнені за допомогою мутації, це призводить до накопичення тригліцеридів у клітині і виробляються клітини дріжджів із «ожирінням». Цей дефект також призводить до затримки росту, що свідчить про те, що деградація жиру забезпечує важливі продукти метаболізму для росту клітин [4]. Ферменти Tgl3 і Tgl4, які беруть участь у процесі розщеплення жиру в дріжджах, структурно пов'язані з ATGL, і їх функція може бути частково замінена мишачим ATGL. Ця знахідка підтверджує високий ступінь функціонального та структурного збереження ферментів ліпідного обміну між дріжджами та клітинами тварин.
Просторова організація ліпідного обміну
Метаболізм ліпідів розподілений по різних ділянках клітини і піддається складному контролю. Для характеристики просторової організації близько 600 білків ліпідного обміну були локалізовані як злиття GFP з високою роздільною здатністю [5]. Серед інших спостережень це дослідження призвело до ідентифікації раніше невідомих білків крапель ліпідів. В даний час усі бл. За допомогою конфокальної лазерної скануючої мікроскопії досліджують 6 000 хромосомно виражених GFP злиття, а дані про локалізацію стають доступними науковому співтовариству в спеціально розробленій базі даних про локалізацію білка дріжджів, YPL.db [6] (рис. 3). Можна чітко продемонструвати, що локалізація білка не є статичною, але вирішальний вплив має стан розвитку клітини та порушення ліпідного обміну.
Екрани з високим вмістом на основі мікроскопії
Наявність великих колекцій дріжджових мутантів (приблизно 4500 життєздатних мутантів з делецією) та відповідних флуоресцентних барвників для запасів ліпідів спонукає до використання екранів на основі мікроскопії для мутантів ліпідного обміну. Нещодавно проведений мікроскопічний скринінг фактично виявив дріжджовий гомолог сейпіну, який є дефектним у пацієнтів із вродженою ліподистрофією Бернардінеллі-Сейпа 2. Відсутність цього білка в дріжджах призводить до порушення морфології крапель ліпідів [7, 8]. Це означає, що виявлення та характеристика збережених факторів зберігання ліпідів у дріжджах має величезний потенціал для розуміння молекулярних причин порушень ліпідного обміну у людей.
- Повні чоловічі миші виробляють більше імунних клітин, що стимулюють захворювання, ніж самки Мічиганської медицини
- Стрункі жінки мають більший ризик розвитку ендометріозу, ніж жінки з ожирінням - ScienceDaily
- Повні гавайці вчаться у тонких предків Дієтологи-дієтологи пропонують план із давньою їжею
- Дорослі з ожирінням та надмірною вагою схудли на вегетаріанських, веганських дієтах MDedge Endocrinology
- Ожиріння у 25 років Будьте готові страждати ще пізніше Science Tech Times