Регенерація підшлункової залози: основні дослідження та регуляція генів
Анотація
Регенерація підшлункової залози (PR) є цікавим явищем, яке може дати підказки щодо того, як можна досягти контролю за цукровим діабетом. Через різні регенеративні здібності підшлункової залози та печінки молекулярний механізм, відповідальний за PR, в основному невідомий. У цьому огляді ми описуємо п’ять репрезентативних мишачих моделей PR та тринадцять гуморальних мітогенів, які стимулюють проліферацію β-клітин. Ми також описуємо онтогенез підшлункової залози, включаючи молекулярні транскрипційні відмінності між α-клітинами та β-клітинами. Крім того, ми розглядаємо 14 мишачих моделей, які несуть дефекти в генах, пов'язаних з ключовими факторами транскрипції для онтогенезу підшлункової залози, щоб отримати подальше розуміння розвитку підшлункової залози.
Це попередній перегляд вмісту передплати, увійдіть, щоб перевірити доступ.
Параметри доступу
Придбайте одну статтю
Миттєвий доступ до повної статті PDF.
Розрахунок податку буде завершено під час оформлення замовлення.
Підпишіться на журнал
Негайний онлайн-доступ до всіх випусків з 2019 року. Підписка буде автоматично поновлюватися щороку.
Розрахунок податку буде завершено під час оформлення замовлення.
Список літератури
Yagi H, Soto-Gutierrez A, Kitagawa Y. Реінженерія цілих органів: підхід регенеративної медицини в травній хірургії для заміщення органів. Surg Today. 2013; 43: 587–94.
Такахасі К, Мурата С, Охкочі Н. Нова терапія для регенерації печінки за рахунок збільшення кількості тромбоцитів. Surg Today. 2013; 43: 1081–7.
Peng HS, Xu XH, Zhang R, He XY, Wang XX, Wang WH та ін. Багаторазові низькі дози еритропоетину затримують проліферацію гепатоцитів, але сприяють функції печінки у щурячої моделі субтотальної гепатектомії. Surg Today. 2014; 44: 1109–15.
Менге Б.А., Таннапфель А, Бєляєв О., Дрешер Р., Мюллер С, Уль З. та ін. Часткова панкреатектомія у дорослих людей не провокує регенерацію бета-клітин. Діабет. 2008; 57: 142–9.
Scow RO. Тотальна панкреатектомія у щурів: операція, наслідки та післяопераційний догляд. Ендокринологія. 1957; 60: 359–67.
Houry S, Huguier M. Тотальна спленопанкреатектомія у щурів. Технічний звіт. Eur Surg Res. 1983; 15: 328–31.
Мігліоріні Р.Х. Двостадійна процедура тотальної панкреатектомії у щурів. Діабет. 1970; 19: 694–7.
Wenger JM, Meyer P, Morel DR, Costabella PM, Rohner A. Радикальна спленопанкреатектомія із збереженням дванадцятипалої кишки у щурів. J Surg Res. 1990; 49: 361–5.
Richards C, Fitzgerald PJ, Carol B, Rosenstock L, Lipkin L. Сегментарний поділ підшлункової залози щурів для експериментальних процедур. Лабораторія Інвест. 1964; 13: 1303–21.
Пірсон К.В., Скотт Д., Торранс Б. Ефекти часткової хірургічної панкреатектомії у щурів. I. Регенерація підшлункової залози. Гастроентерологія. 1977; 72: 469–73.
Cavelti-Weder C, Shtessel M, Reuss JE, Jermendy A, Yamada T, Caballero F, et al. Перев'язка проток підшлункової залози після майже повної втрати бета-клітин: екзокринна регенерація, але відсутність регенерації бета-клітин. Ендокринологія. 2013; 154: 4493–502.
Xu X, D’Hoker J, Stange G, Bonne S, De Leu N, Xiao X та ін. Бета-клітини можуть утворюватися з ендогенних родоначальників у пораненій підшлунковій залозі дорослої миші. Клітинка. 2008; 132: 197–207.
Inada A, Nienaber C, Katsuta H, Fujitani Y, Levine J, Morita R, et al. Позитивні клітини підшлункової залози з вуглекислою ангідразою є попередниками як ендокринної, так і екзокринної підшлункової залози після народження. Proc Natl Acad Sci. 2008; 105: 19915–9.
Pan FC, Bankaitis ED, Boyer D, Xu X, Van de Casteele M, Magnuson MA, et al. Просторово-часові закономірності багатопотенційності в клітинах, що експресують Ptf1a, під час органогенезу підшлункової залози та факультативного відновлення, спричиненого травмами. Розвиток. 2013; 140: 751–64.
Shing Y, Christofori G, Hanahan D, Ono Y, Sasada R, Igarashi K, et al. Бетацелюлін: мітоген з пухлин бета-клітин підшлункової залози. Наука. 1993; 259: 1604–7.
Yamamoto K, Miyagawa J, Waguri M, Sasada R, Igarashi K, Li M, et al. Рекомбінантний бетацелюлін людини сприяє неогенезу бета-клітин і покращує непереносимість глюкози у мишей з діабетом, викликаних селективною перфузією алоксану. Діабет. 2000; 49: 2021–7.
Cras-Meneur C, Elghazi L, Czernichow P, Scharfmann R. Епідермальний фактор росту збільшує недиференційовані клітини підшлункової залози in vitro: баланс між проліферацією та диференціацією. Діабет. 2001; 50: 1571–9.
Song SY, Gannon M, Washington MK, Scoggins CR, Meszoely IM, Goldenring JR та ін. Розширення Pdx1-експресуючого епітелію підшлункової залози та неогенезу острівців у трансгенних мишей, що надмірно експресують трансформуючий фактор росту альфа. Гастроентерологія. 1999; 117: 1416–26.
Krakowski ML, Kritzik MR, Jones EM, Krahl T, Lee J, Arnush M, et al. Трансгенна експресія епідермального фактора росту та фактора росту кератиноцитів у бета-клітинах призводить до значних морфологічних змін. J Ендокринол. 1999; 162: 167–75.
Alvarez-Perez JC, Ernst S, Demirci C, Casinelli GP, Mellado-Gil JM, Rausell-Palamos F, et al. Фактор росту гепатоцитів/передача сигналу c-Met необхідний для регенерації бета-клітин. Діабет. 2014; 63: 216–23.
Xu G, Stoffers DA, Habener JF, Bonner-Weir S. Exendin-4 стимулює реплікацію бета-клітин та неогенез, що призводить до збільшення маси бета-клітин та покращення толерантності до глюкози у діабетичних щурів. Діабет. 1999; 48: 2270–6.
Greig NH, Holloway HW, De Ore KA, Jani D, Wang Y, Zhou J, et al. Одноразово щоденне введення екзендіну-4 діабет-мишам досягає довгострокових сприятливих ефектів на концентрацію глюкози в крові. Діабетологія. 1999; 42: 45–50.
Drucker DJ. Дія інкретину в підшлунковій залозі: потенційна перспектива, можливі небезпеки та патологічні підводні камені. Діабет. 2013; 62: 3316–23.
Гарбер AJ. Агоністи рецептора глюкагоноподібного пептиду 1 тривалої дії: огляд їх ефективності та переносимості. Догляд за діабетом. 2011; 34 (Додаток 2): S279–84.
Rooman I, Lardon J, Bouwens L. Gastrin стимулює неогенез бета-клітин і збільшує масу острівців із трансдиференційованої, але не з нормальної екзокринної тканини підшлункової залози. Діабет. 2002; 51: 686–90.
Suarez-Pinzon WL, Power RF, Yan Y, Wasserfall C, Atkinson M, Rabinovitch A. Комбінована терапія з глюкагоноподібним пептидом-1 та гастрином відновлює нормоглікемію у мишей з діабетичним NOD. Діабет. 2008; 57: 3281–8.
Pittenger GL, Vinik AI, Rosenberg L. Часткова ізоляція та характеристика ілотропіну, нового фактора росту, специфічного для острівців. Adv Exp Med Biol. 1992; 321: 123–130 (обговорення 131–122).
Dungan KM, Buse JB, Ratner RE. Ефекти терапії цукрового діабету 1 та 2 типу пептидом, отриманим із білка, асоційованого з неогенезом островів (INGAP). Diabetes Metab Res Rev. 2009; 25: 558–65.
Шах К.А., Патель М.Б., Пател Р.Ж., Пармар П.К. Mangifera indica (манго). Pharmacogn Rev. 2010; 4: 42–8.
Тютюлкова N, Тунева S, Горанчева U, Танев G, Живков V, Челібонова-Лорер H та ін. Гепатопротекторна дія силімарину (карсилу) на печінку щурів, які отримували D-галактозамін. Біохімічні та морфологічні дослідження. Методи Знайти досвідчений Клін Фармакол. 1981; 3: 71–7.
Vargas-Mendoza N, Madrigal-Santillan E, Morales-Gonzalez A, Esquivel-Soto J, Esquivel-Chirino C, Garcia-Luna YG-RM та ін. Гепатопротекторна дія силімарину. Світ J Гепатол. 2014; 6: 144–9.
Soto C, Raya L, Perez J, Gonzalez I, Perez S. Силімарин індукує експресію фактора транскрипції Nkx6.1 підшлункової залози та неогенез бета-клітин у моделі панкреатектомії. Молекули. 2014; 19: 4654–68.
Quagliarini F, Wang Y, Kozlitina J, Grishin NV, Hyde R, Boerwinkle E та ін. Атиповий ангіопоетиноподібний білок, який регулює ANGPTL3. Proc Natl Acad Sci. 2012; 109: 19751–6.
Yi P, Park JS, Melton DA. Бетатрофін: гормон, який контролює проліферацію бета-клітин підшлункової залози. Клітинка. 2013; 153: 747–58.
Wang Y, Quagliarini F, Gusarova V, Gromada J, Valenzuela DM, Cohen JC, et al. Миші, у яких відсутній ANGPTL8 (бетатрофін), виявляють порушення метаболізму тригліцеридів без порушення гомеостазу глюкози. Proc Natl Acad Sci. 2013; 110: 16109–14.
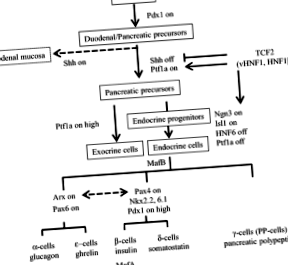
Гюні М.А., Ганнон М. Доля клітин підшлункової залози. Вроджені вади розвитку З ембріон сьогодні 2009; 87: 232–48.
Кім С.К., Хеброк М., Мелтон Д.А. Для розвитку підшлункової залози необхідна передача сигналів від нотохордів до ентодерми. Розвиток. 1997; 124: 4243–52.
Хеброк М, Кім С.К., Мелтон Д.А. Нотохордова репресія ендодермального звукового їжака дозволяє розвинути підшлункову залозу. Genes Dev. 1998; 12: 1705–13.
Gradwohl G, Dierich A, LeMeur M, Guillemot F. neurogenin3 необхідний для розвитку чотирьох ендокринних клітинних ліній підшлункової залози. Proc Natl Acad Sci. 2000; 97: 1607–11.
Haumaitre C, Barbacci E, Jenny M, Ott MO, Gradwohl G, Cereghini S. Нестача TCF2/vHNF1 у мишей призводить до агенезії підшлункової залози. Proc Natl Acad Sci. 2005; 102: 1490–5.
Artner I, Blanchi B, Raum JC, Guo M, Kaneko T, Cordes S, et al. MafB необхідний для дозрівання острівців бета-клітин. Proc Natl Acad Sci. 2007; 104: 3853–8.
Слабкий JM. Біологія розвитку підшлункової залози. Розвиток. 1995; 121: 1569–80.
Jonsson J, Carlsson L, Edlund T, Edlund H. Інсулін-промотор-фактор 1 необхідний для розвитку підшлункової залози у мишей. Природа. 1994; 371: 606–9.
Dutta S, Bonner-Weir S, Montminy M, Wright C. Нормативний фактор, пов’язаний з пізнім діабетом? Природа. 1998; 392: 560.
Роуз SD, Свіфт GH, Пейтон MJ, Hammer RE, MacDonald RJ. Роль PTF1-P48 у експресії ацинарних генів підшлункової залози. J Biol Chem. 2001; 276: 44018–26.
Кавагучі Ю, Купер Б, Ганнон М, Рей М, Макдональд Р.Дж., Райт CV. Роль регулятора транскрипції Ptf1a у перетворенні кишкових нащадків підшлункової залози. Nat Genet. 2002; 32: 128–34.
Krapp A, Knofler M, Ledermann B, Burki K, Berney C, Zoerkler N, et al. Білок bHLH PTF1-p48 важливий для формування екзокринної та правильної просторової організації ендокринної підшлункової залози. Genes Dev. 1998; 12: 3752–63.
Чуанг П.Т., Корнберг ТБ. Про дальність сигналізації їжака. Curr Opin Genet Dev. 2000; 10: 515–22.
Рамальо-Сантос М, Мелтон Д.А., МакМахон А.П. Їжачі сигнали регулюють різні аспекти розвитку шлунково-кишкового тракту. Розвиток. 2000; 127: 2763–72.
ван Туйл М, Гроенман Ф, Ван Дж, Кулішевський М, Лю Дж, Тіббоел Д та ін. Ангіогенні фактори стимулюють канальцевий розгалужений морфогенез легенів із дефіцитом звукового їжака. Dev Biol. 2007; 303: 514–26.
Хеброк М, Кім СК, Сен-Жак Б, Мак-Махон А.П., Мелтон Д.А. Регулювання розвитку підшлункової залози за допомогою їжачої сигналізації. Розвиток. 2000; 127: 4905–13.
Horikawa Y, Iwasaki N, Hara M, Furuta H, Hinokio Y, Cockburn BN та ін. Мутація гена гепатоцитів-ядерного фактора-1 (TCF2), пов'язаного з MODY. Nat Genet. 1997; 17: 384–5.
Ravassard P, Chatail F, Mallet J, Icard-Liepkalns C. Relax, новий транскрипційний регулятор bHLH щурів, який тимчасово експресується в зоні проліферації шлуночків центральної нервової системи, що розвивається. J Neurosci Res. 1997; 48: 146–58.
Naya FJ, Huang HP, Qiu Y, Mutoh H, DeMayo FJ, Leiter AB та ін. Діабет, дефектний морфогенез підшлункової залози та аномальна ентероендокринна диференціація у мишей із дефіцитом BETA2/neuroD. Genes Dev. 1997; 11: 2323–34.
Stoffers DA, Zinkin NT, Stanojevic V, Clarke WL, Habener JF. Агенезія підшлункової залози, пов’язана з делецією одного нуклеотиду в кодуючій послідовності гена IPF1 людини. Nat Genet. 1997; 15: 106–10.
Бальдерес Д.А., Магнусон М.А., Суссель Л. Nkx2.2: Крекційна лінія миші: новий інструмент для делеції гена, підшлункової залози та ЦНС. Буття. 2013; 51: 844–51.
Sussel L, Kalamaras J, Hartigan-O’Connor DJ, Meneses JJ, Pedersen RA, Rubenstein JL та ін. Миші, у яких відсутній фактор транскрипції гомеодомену Nkx2.2, страждають на діабет через зупинену диференціацію бета-клітин підшлункової залози. Розвиток. 1998; 125: 2213–21.
Dahl E, Koseki H, Balling R. Pax гени та органогенез. Біопроби. 1997; 19: 755–65.
Sosa-Pineda B, Chowdhury K, Torres M, Oliver G, Gruss P. Ген Pax4 важливий для диференціації бета-клітин, що продукують інсулін, у підшлунковій залозі ссавців. Природа. 1997; 386: 399–402.
Травень CL. Роль острівця-1 в ендокринній підшлунковій залозі: Уроки мишей з дефіцитом на острівці-1, що страждають від підшлункової залози. Острівці. 2010; 2: 121–3.
Pfaff SL, Mendelsohn M, Stewart CL, Edlund T, Jessell TM. Вимога до гена гомеобокса LIM Isl1 у генерації рухових нейронів виявляє моторно-нейронзалежний етап диференціації міжнейронів. Клітинка. 1996; 84: 309–20.
Ahlgren U, Pfaff SL, Jessell TM, Edlund T, Edlund H. Незалежна потреба в ISL1 у формуванні мезенхіми підшлункової залози та острівців. Природа. 1997; 385: 257–60.
Лемейре Ф.П., Дурвіо С.М., Труонг О, Ланной В.Дж., Суан Дж. Дж., Руссо Г.Г. Ядерний фактор 6 гепатоцитів, фактор транскрипції, який містить новий тип гомеодомену та одиничний домен. Proc Natl Acad Sci. 1996; 93: 9460–4.
Jacquemin P, Durviaux SM, Jensen J, Godfraind C, Gradwohl G, Guillemot F, et al. Ядерний фактор 6 транскрипції гепатоцитів регулює диференціювання ендокринних клітин підшлункової залози та контролює експресію проендокринного гена ngn3. Mol Cell Biol. 2000; 20: 4445–54.
Blanchi B, Kelly LM, Viemari JC, Lafon I, Burnet H, Bevengut M, et al. Дефіцит MafB спричиняє дефект ритмогенезу дихання та центральне апное зі смертельним результатом при народженні. Nat Neurosci. 2003; 6: 1091–100.
Соса-Пінеда Б. Ген Pax4 є важливим регулятором розвитку бета-клітин підшлункової залози. Клітини Mol. 2004; 18: 289–94.
Kordowich S, Collombat P, Mansouri A, Serup P. Arx та Nkx2.2. Дефіцит сполуки перенаправляє диференціювання альфа- та бета-клітин підшлункової залози на соматостатин/грелін, що експресують клітинні лінії. BMC Dev Biol. 2011; 11: 52.
Collombat P, Hecksher-Sorensen J, Broccoli V, Krull J, Ponte I, Mundiger T, et al. Одночасна втрата генів Arx та Pax4 сприяє уточненню долі клітин, що продукують соматостатин, за рахунок ліній альфа- та бета-клітин в ендокринній підшлунковій залозі миші. Розвиток. 2005; 132: 2969–80.
Price M, Lazzaro D, Pohl T, Mattei MG, Ruther U, Olivo JC та ін. Регіональна експресія гена гомеобокса Nkx-2.2 у передньому мозку ссавців, що розвивається. Нейрон. 1992; 8: 241–55.
Sander M, Sussel L, Conners J, Scheel D, Kalamaras J, Dela Cruz F, et al. Ген Homeobox Nkx6.1 лежить нижче за Nkx2.2 у головному шляху утворення бета-клітин у підшлунковій залозі. Розвиток. 2000; 127: 5533–40.
Henseleit KD, Nelson SB, Kuhlbrodt K, Hennings JC, Ericson J, Sander M. Активність фактора транскрипції NKX6 необхідна для розвитку альфа- та бета-клітин у підшлунковій залозі. Розвиток. 2005; 132: 3139–49.
Сімпсон Т.І., Прайс ді-джей. Pax6; плейотропний гравець у розробці. Біоесеї. 2002; 24: 1041–51.
St-Onge L, Sosa-Pineda B, Chowdhury K, Mansouri A, Gruss P. Pax6 необхідний для диференціації альфа-клітин, що продукують глюкагон, у підшлунковій залозі миші. Природа. 1997; 387: 406–9.
Вандерфорд NL Регуляція експресії MafA, специфічної для бета-клітин та глюкози. Острівці. 2011; 3: 35–7.
Zhang C, Moriguchi T, Kajihara M, Esaki R, Harada A, Shimohata H, et al. MafA є ключовим регулятором секреції інсуліну, стимульованого глюкозою. Mol Cell Biol. 2005; 25: 4969–76.
Подяка
Частина цього дослідження була підтримана грантом для наукових досліджень Міністерства освіти, культури, спорту, науки та технологій (№ 24659592) Т. Мізугучі, Т. Торіго, Н. Сато та К. Хірата. Частина цього дослідження також була підтримана грантом Міністерства охорони праці, праці та соціального захисту населення (№ 2601023) Т. Мідзугучі, Т. Торіго, К. Хірата та Н. Сато.
Інформація про автора
Приналежності
Кафедра хірургії хірургічної онкології, Медичний університет Саппоро, Саппоро, Хоккайдо, 060-8543, Японія
Кенджі Окіта, Тору Мідзугуті, Ота Шигенорі, Масаюкі Ішіі, Тошіхіко Нішідате, Томомі Уекі, Макото Мегуро та Ясутоші Кімура
Кафедра патології I, Медичний університет Саппоро, Саппоро, Хоккайдо, 060-8556, Японія
Тошіхіко Торігое та Норіюкі Сато
Департамент розвитку та регенерації тканин, Науково-дослідний інститут прикордонної медицини, Медичний університет Саппоро, Саппоро, Хоккайдо, 060-8556, Японія
Наокі Танімідзу, Норіхіса Ічінохе та Тосіхіро Мітака
Департамент клітинних наук, Науково-дослідний інститут прикордонної медицини, Медичний університет Саппоро, Саппоро, Хоккайдо, 060-8556, Японія
Кафедра хірургічної патології II, Медичний університет Саппоро, Саппоро, Хоккайдо, 060-8556, Японія
Кафедра хірургії, лікарня JR Саппоро, N-3, E-1, Чуо-Ку, Саппоро, Хоккайдо, 060-0033, Японія
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
- Про регуляцію кінцевого судинного русла при ожирінні та цукровому діабеті SpringerLink
- Одноклітинний транскриптомічний аналіз острівців підшлункової залози на стан здоров'я та діабет 2 типу SpringerLink
- Рівні ферментів підшлункової залози в сироватці крові у худих і ожирілих осіб SpringerLink
- Флегмона підшлункової залози SpringerLink
- Дослідження саркопенічного ожиріння прогресують у патогенезі та діагностичних критеріях SpringerLink