Опосередкований PepT1 трипептид KPV зменшує запалення кишечника
Пов’язані дані
Анотація
Передумови та цілі
KPV - це трипептид (Lys-Pro-Val), який має протизапальні властивості, проте механізми його дії досі залишаються невідомими. PepT1 - це ди/трипептидний транспортер, який експресується в тонкій кишці та індукується в товстій кишці під час запального захворювання кишечника (ВЗК). Метою цього дослідження було 1) дослідити, чи протизапальний ефект KPV опосередкований PepT1 в епітеліальних та імунних клітинах кишечника, та 2) вивчити протизапальний ефект KPV на двох моделях коліту мишей.
Методи
Клітини кишкового епітелію людини (Caco2-BBE та HT29-Cl.19A) та Т-клітини людини (Jurkat) стимулювались протизапальними цитокінами у присутності або відсутності KPV. Протизапальний ефект KPV оцінювали за допомогою репортера гена люциферази NF-κB, вестерн-блот, RT-PCR в реальному часі та ІФА. Експерименти з поглинанням проводили з використанням холодного KPV як конкурента для hPepT1 радіомаркованого субстрату або з використанням [3 H] KPV для визначення кінетичних характеристик поглинання KPV. Протизапальний ефект KPV також досліджували при DSS- та TNBS-індукованому коліті у мишей. KPV додавали до питної води, і запалення оцінювали на гістологічному рівні та за допомогою експресії прозапальної мРНК цитокінів.
Результати
Наномолярні концентрації KPV інгібують активацію сигнальних шляхів запалення NF-κB та MAP-кінази та зменшують прозапальну секрецію цитокінів. Ми виявили, що KPV діє через hPepT1, що експресується в імунних та кишкових епітеліальних клітинах. Крім того, пероральне введення KPV зменшує частоту виникнення DSS- та TNBS-індукованого коліту, що вказує на зменшення експресії прозапальних цитокінів.
Висновок
Це дослідження вказує на те, що KPV транспортується в клітини за допомогою PepT1 і може бути новим терапевтичним засобом для ВЗК.
ВСТУП
Однією з нормальних транспортних функцій епітеліальних клітин кишечника є поглинання дрібних пептидів з раціону за допомогою пептидної транспортної активності (1). Це опосередковується за допомогою Н + -сполученого транспортера олігопептидів (PepT1), який знаходиться на апікальній мембрані епітеліальних клітин кишечника (IEC) і який котранспортує пептиди та Н + (2). Специфічність hPepT1 широка і включає багато ді- та трипептидів на додаток до різних препаратів, отриманих із пептидів (3–8). PepT1 в основному експресується в мембранах меж щітки ентероцитів у тонкому кишечнику, у проксимальних канальцевих клітинах сегмента S1 нирки та в епітеліальних клітинах жовчних проток (4, 5, 9–15). Навпаки, в товстій кишці експресія мРНК і білка PepT1 є низькою (16) і іноді не може бути виявлена (10, 15, 17). Хоча людський PepT1 не експресується в нормальних епітеліальних клітинах товстої кишки (10, 16, 17), ми виявили його експресію на апікальній мембрані епітеліальних клітин у хронічно запаленій товстій кишці (17). Цікаво, що ми також показали, що імунні клітини, такі як макрофаги, які тісно контактують із власною пластинкою кишечника, також експресують PepT1 у своїх мембранах (17, 18).
Оскільки експресія hPepT1 товстої кишки регулюється вгору при ВЗК, його транспортна активність становить потенційну нову мішень для протизапальної терапії. Крім того, слід оцінювати важливість експресії hPepT1 імунними клітинами під час запалення кишечника, оскільки може бути терапевтично вигідним розвиток опосередкованих PepT1 протизапальних препаратів. Трипептид KPV (Lys-Pro-Val), який є С-кінцевою послідовністю α-меланоцитостимулюючого гормону (α-MSH), має протизапальну активність (19–21), і хоча основні механізми ще потрібно визначити, відомо, що KPV інгібує активацію NF-κB, вказуючи на інгібування синтезу прозапальних цитокінів. У цьому дослідженні ми досліджуємо трипептид KPV як медіатор протизапальних ефектів через PepT1, що виражається у запалених епітеліальних та імунних клітинах товстої кишки, а також його протизапальні властивості in vivo, використовуючи мишачі моделі коліту.
МАТЕРІАЛИ І МЕТОДИ
Культура клітин
Клітини Caco2-BBE і HT29-Cl.19A вирощували в DMEM з добавкою 14 мМ NaHCO3, 10% FBS і пеніциліном/стрептоміцином (Invitrogen, Grand Island, NY). Клітини Jurkat вирощували в RPMI 1640 (Invitrogen) з додаванням 10% FBS.
Реагенти
Тварини
Самки мишей C57BL/6 (8 тижнів, 18–22 г, лабораторії Джексона, Бар-Харбор, МЕ), що використовувались для цього дослідження, розміщувались у групі при контрольованій температурі (25 ° C) та фотоперіоді (12: 12-годинний цикл світло-темрява ), і дозволив необмежений доступ до стандартної дієти та водопровідної води. Мишам дозволяли пристосуватися до цих умов щонайменше за 7 днів до включення в експерименти.
Індукція коліту
Коліт індукували додаванням у питну воду 3% (мас./Об.) Декстрану сульфату натрію (DSS; молекулярна маса 40 000 Да; ICN Biochemicals, Aurora, OH) або введенням у товсту кишку 150 мг/кг маси тринітробензолу сульфонілу кислота (TNBS; Sigma), розчинена у 50% етанолі. Запалення товстої кишки оцінювали через 8 днів після лікування DSS або через 48 годин після введення TNBS. N = 10 мишей/група.
Активність мієлопероксидази (MPO) в товстій кишці
Аналіз подвійної люциферази
Вестерн-блот-аналіз
Поглинання експериментів
Клітини Caco2-BBE вирощували на фільтрах протягом 15 днів (площа = 1 см 2; розмір пор 0,4 мкм; поліефірні мембрани Transwell-Clear, Costar VWR, Suwanee, GA), промивали та стабілізували в HBSS + -10 мМ HEPES (pH 7,4) у базолатеральному відділенні та 10 мМ MES (рН 6,2) у верхівковому відділенні протягом 15 хвилин при 37 ° C. Верхівковий відсік завантажували протягом 15 хвилин при кімнатній температурі HBSS + -10 мМ MES (pH 6,2), що містить 20 нМ [3 H] KPV ± 20 мМ гліцин-лейцин або 20 мкМ [14 C] гліцин-саркозин ± 100 мкМ KPV, або 20 мкМ [14 С] гліцин-саркозин ± 100 мкМ гліцин-лейцин, або 20 нМ [14 С] гліцин-саркозин ± 20 мМ гліцин-лейцин. Потім клітини промивали в крижаному PBS, а радіоактивність, пов’язану з клітинами, визначали шляхом рідинного сцинтиляційного підрахунку в β-лічильнику.
Для клітин Jurkat для аналізу використовували 5,10 6 клітин. Клітини двічі промивали HBSS + -10 мМ MES (pH 6,2), стабілізували протягом 15 хвилин при 37 ° С та інкубували протягом 1 години при кімнатній температурі в тому ж буфері, що містив різні концентрації [3 H] KPV ± 20 мМ гліцину. -Лейцин. Потім клітини промивали крижаним PBS і визначали загальну радіоактивність. Конкретні поглинання розраховувались наступним чином: (поглинання радіоактивно міченого пептиду) - (поглинання радіоактивно міченого пептиду + гліцин-лейцин).
вимірювання цАМФ
Екстракція РНК та ПТ-ПЛР у режимі реального часу
Загальну РНК екстрагували з клітин або товстої кишки за допомогою реагенту TRIzol (Invitrogen) та зворотньо транскрибували за допомогою системи RETROscript® (Ambion Inc, Austin, Tx). Для RT-PCR в реальному часі використовували систему виявлення послідовності iCycler у реальному часі (Bio-Rad). Коротко, 10 нг кДНК ампліфікували при 95 ° C протягом 3 хвилин, після чого 40 циклів при 95 ° C протягом 15 секунд та 60 ° C протягом 1 хвилини, використовуючи 10 мкМ генно-специфічних праймерів (Таблиця 1, Додаткові дані) та iQ SYBR Green Suppermix (Bio-Rad). Рівні експресії GAPDH або 36B4 використовували як гени ведення домашнього господарства, а індукцію згину обчислювали методом Ct наступним чином: Δ CT = (CtTarget - Cthousekeeping) лікування - (CtTarget - Cthousekeeping) нелікування, а остаточні дані отримували з 2 -ΔCT .
Виявлення MCR в клітинах
ПЛР кДНК для кожного з меланокортинових рецепторів проводили за допомогою семінестірованного підходу з прямими та зворотними праймерами в першій ПЛР та внутрішніми прямими (infw) та оборотами праймерів у наступній ПЛР, як описано раніше (22). Грунтовки наведені в таблиці 2, Додаткові дані. Продукти ПЛР клонували у pGEM ® -T Easy Vectors (Promega), ампліфікували та секвенували.
Статистичний аналіз
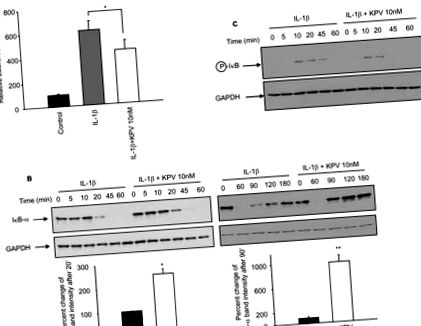
Всі оцінки виконувались із використанням програмного забезпечення SigmaPlot (SPSS, Чикаго, Іллінойс) та InStat v3.06 (GraphPad, Сан-Дієго, Каліфорнія), з даними, що відображаються як значення ± SEM. Кілька груп порівнювали ANOVA, використовуючи пост-хок-тест Тукі. * Значення P Рисунок 1A). Однак спільна інкубація клітин Caco2-BBE з KPV (10 нМ) та IL-1β суттєво знизила активність люциферази, індуковану IL-1β (Фігура 1A). Щоб підтвердити, що KPV зменшує активацію NF-κB, деградацію IκB-α та фосфорилювання, які можуть бути причиною активації NF-κB, оцінювали за допомогою імуноблот-аналізів у клітинах Caco2-BBE, оброблених IL-1β ± KPV. Ми виявили високий рівень деградації IκB-α через 20 хвилин після стимуляції IL-1β, тоді як у присутності KPV деградація IκB-α в цей час була зменшена (Рисунок 1B). Потім рівень IκB-α повернувся до базового рівня через 180 хвилин стимуляції IL-1β, тоді як у присутності KPV базові рівні IκB-α були досягнуті протягом 90 хвилин після стимуляції (рис. 1В). Крім того, IκB-α все ще фосфорилювався через 45 хвилин стимуляції IL1-β, але не в присутності KPV (рис. 1С). У сукупності наші результати показують, що KPV затримує активацію NF-κB, а також скорочує затримку відновлення IκB-α, припускаючи, що KPV зменшує тривалість активації NF-κB. Зниження активності NF-κB, опосередковане KPV, також було підтверджено EMSA (додаткові результати, рисунок 1).
Відомо, що активація шляхів MAPK та NF-κB в IEC індукує продукцію прозапальних цитокінів, які відіграють роль у рекрутингу імунних клітин, таких як IL-8 (25). Щоб вивчити, чи впливає KPV на експресію та секрецію IL-8 клітинами Caco2-BBE, рівень мРНК IL-8 та білка оцінювали за допомогою RT-PCR та ІФА в реальному часі. Ми виявили, що IL-1β індукував a
200-кратне збільшення мРНК IL-8 після 3 годин стимуляції порівняно з необробленими клітинами (Фігура 1E). Однак у присутності KPV підвищення IL-8 мРНК, індуковане IL-1β, було значно зменшене (на
35%) (Малюнок 1E). Відповідно, збільшення концентрації IL-8 у живильному середовищі клітин Caco2-BBE, оброблених IL-1β протягом 3 або 5 годин, суттєво зменшилось шляхом спільної інкубації з KPV (рис. 1F).
Разом ці результати показують, що KPV знижує активацію NF-κB та MAPK, які становлять класичні сигнальні шляхи, що беруть участь у секреції цитокінів запаленою IEC.
Протизапальний ефект KPV опосередковується hPepT1 в клітинах епітелію кишечника
- Часткова кишкова непрохідність після ковтання саморозширювальної губки для зменшення ваги -
- Овес, житні висівки можуть зменшити збільшення ваги, запалення печінки
- Старий препарат пропонує нову надію для дітей з руйнівним розладом. Фенфлурамін зменшує судоми
- Структуровані аеробні вправи зменшують жирову масу і частково компенсуються за рахунок споживання енергії
- Гастректомія рукавів зменшує ризик переломів HCPLive