Оцінка мережевих змін на основі вимірювань тривалості життя за допомогою економної моделі генної мережі клітинного старіння
Анотація
Передумови
Клітинне старіння найкраще вивчати на початкових дріжджах Saccharomyces cerevisiae. Як приклад плейотропної ознаки, на тривалість життя дріжджів впливають сотні взаємопов’язаних генів. Однак наразі не існує кількісних методів, щоб визначити зміни на рівні системи в генних мережах під час клітинного старіння.
Результати
Висновки
Наша теоретична модель забезпечує економну інтерпретацію експериментальних даних про тривалість життя з точки зору генних мереж. Ми сподіваємось, що наша робота стимулюватиме більший інтерес до розробки мережевих моделей для вивчення старіння як плейотропної риси.
Передумови
Розуміння клітинного старіння має вирішальне значення для нашого розуміння старіння в цілому [1]. На молекулярному рівні шляхи, які, як відомо, впливають на тривалість життя, часто виконують важливі та збережені функції всередині клітин [2]. Молекулярні механізми клітинного старіння найкраще зрозумілі в початкових дріжджах Saccharomyces cerevisiae, одноклітинний модельний організм [3–6]. Ефект продовження тривалості життя сиртуїнів та шляхів TOR широко вивчався у відростаючих дріжджах, і було встановлено, що він зберігається у інших видів [2, 7–9].
Старіння дріжджових клітин можна виміряти за реплікативною тривалістю життя - кількістю клітинних поділів, які клітини можуть здійснити до старіння, та хронологічною тривалістю життя - як довго клітини можуть зберігати свою проліферативну здатність у стаціонарній фазі [5]. Реплікативна тривалість життя дріжджових клітин аналогічна обмеженій здатності до реплікації клітин первинної культури, яка вперше спостерігалася в клітинах людини [10]. Криві виживання реплікативно зістарених клітин дріжджів, як правило, сигмоподібні і можуть бути описані моделлю Гомперца [11]. Загальногеномні експериментальні дослідження продемонстрували зміни на рівні генної мережі в процесі старіння дріжджів [12]. Клітинне старіння дріжджів - це стохастичний процес, оскільки популяція генотипово однорідних клітин може дожити до різного віку. Спадковість реплікативного життя дріжджів у широкому розумінні, за оцінками, становить близько 22% [11].
Загалом старіння кількісно визначається рівнем смертності μ(т), що є нормованою швидкістю зниження життєздатності S(т):
де т час. Смертність μ(т) описує ймовірність смерті з віком, а старіння відбувається, коли рівень смертності є позитивною і зростаючою функцією часу. Рівень смертності також відомий як сила смертності, коефіцієнт відмов, рівень небезпеки та функція інтенсивності в різних контекстах [13–15]. Смертність μ(т) часто є експоненціальною функцією часу для біологічного старіння, відома як модель Гомперца [16, 17].
У моделі Гомперца, Р. - початковий рівень смертності, коли т дорівнює нулю, і G - коефіцієнт Гомперца. Початковий рівень смертності Р. можна трактувати як потенціал тривалості життя при народженні. Коефіцієнт Гомперца G має одиницю 1/час, описує прискорення смертності μ з часом, а отже, є мірою для швидкості старіння. Враховуючи роль генних мереж у клітинному старінні, було б інформативно оцінити зміни генної мережі під час старіння дріжджів. Неясно, як класичну модель старіння Гомперца можна використовувати для інтерпретації молекулярних механізмів на основі даних експериментального старіння дріжджів.
Теорія надійності є усталеною галуззю техніки [14, 15], і її застосування в біологічному старінні було визнано десятки років тому [18–24]. Мерфі запропонував модель Бінго в 1978 р. І розглядав організм як послідовну конфігурацію підсистем [18]. Подібним чином Скурнік і Кемені в 1978 році змоделювали організм як ряд послідовних ланок і визнали, що найслабша ланка визначає вік організму [19]. У 1985 р. Віттен доводив, що організм може бути змодельований як графік, і досліджував шляхи регенерації моделі Гомперца за допомогою послідовної конфігурації компонентів [20]. Гаврилов та Гаврилова визнали важливість нестаріючих компонентів та розробили складну модель надійності старіння [23, 24]. Усі ці попередні моделі надійності базуються на послідовно підключених підсистемах, аналогічних послідовно підключеним блокам запобіжників. Ці попередні моделі не враховували закономірностей взаємодії в молекулярних мережах і, отже, не стали ефективними інструментами для сприяння молекулярним дослідженням старіння - проблеми, яку ми прагнемо вирішити.
У наступних розділах ми спочатку пропонуємо економну мережеву модель для клітинного старіння, потім розробляємо підхід з максимальною правдоподібністю для оцінки параметрів і, нарешті, застосовуємо модель для виведення глобальних параметрів генної мережі з реплікативних даних тривалості життя початкових дріжджів Saccharomyces cerevisiae.
Модель
Першим кроком у розробці нашої моделі генної мережі для клітинного старіння є моделювання фенотипу клітинної смерті. Потім ми модифікували класичну модель надійності старіння в стохастичну модель мережі.
Моделювання фенотипу клітинної смерті
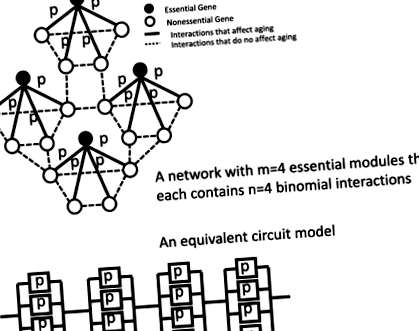
Запропонована економна модель генної мережі для клітинного старіння. Ми припускаємо, що вони є n кількість взаємодій, пов'язаних зі старінням, на один важливий вузол, і що ці взаємодії активні в клітинах з імовірністю стор в нульовий момент часу. Існує м кількість важливих вузлів у мережі. Ця запропонована модель мережі еквівалентна класичній моделі блоку надійності
і рівень смертності основного модуля, μм є
Якщо зосередитись на тривалості життя т ≪ 1 /λ, наведене вище рівняння можна спростити до
В емпіричних мережах, таких як мережі взаємодії білків дріжджів, основні гени/білки часто взаємодіють з багатьма іншими генами. Наша модель передбачає, що серед цих взаємодій лише n взаємодії в середньому мають значення для виживання клітин після видалення цього найважливішого вузла. Іншими словами, ця мережева модель передбачає, що в середньому є n кількість взаємодій, які мають відношення до сутності кожного важливого вузла. Ми хочемо підкреслити, що пропонована експоненціальна зміна сили взаємодії генів є обов’язковим припущенням для нульової гіпотези. Іншими словами, ми стверджуємо, що мережеві моделі з неекспоненціальними змінами генних взаємодій є альтернативними гіпотезами і повинні використовуватися лише тоді, коли вони пропонують значно кращу відповідність експериментальним даним, ніж нульова мережева модель з нестаріючими генними взаємодіями.
Економна модель стохастичної генної мережі для клітинного старіння
Тепер ми можемо побудувати стохастичну модель генної мережі за допомогою основних мережевих модулів. Ми припускаємо, що вони є м кількість основних модулів для побудови мережевої моделі старіння, як на рис. 1. Ми припускаємо, що вихід з ладу будь-якого основного модуля призводить до виходу з ладу всієї мережі і, отже, загибелі клітин. Це є обґрунтованим припущенням, оскільки відсутність будь-якого одного важливого гена призводить до життєздатності дріжджових клітин [27]. Ми припускаємо, що основні гени не взаємодіють один з одним і що їхні збої є незалежними. З урахуванням цих припущень, мережева модель математично еквівалентна послідовній побудові блоків у схемі моделі, запропонованій Гавриловим та Гавриловою [23, 24].
Ми припускаємо, що взаємодія генів є стохастичною і що ймовірність активної взаємодії генів є стор вчасно т= 0 (рис. 1). У внутрішньоклітинних генних мережах взаємодія генів за своєю суттю є стохастичною через обмежену кількість генних продуктів, шум у експресії білка та скупченість внутрішньоклітинних просторів [28–30]. Крім того, шуми транскрипції можуть посилюватися в шуми на рівні білка [31]. Ця стохастична модель мережі математично еквівалентна класичній схемі з біноміально активними компонентами [24]. Якщо мережа містить м необхідні модулі, і кожен важливий ген стохастично взаємодіє n несуттєвих генів, на основі Додатку С у посиланні [24], рівень смертності всієї мережі становить
і де c є нормуючою константою, \ (c = \ frac> \). Доцільно наблизити модульний рівень смертності як підсумок можливих закономірностей зв’язку в рівнянні. 6, якщо зосередитись на діапазоні тривалості життя т ≪ 1 /λ [24, 32]. Термін підсумовування в рівнянні 6 - біноміальна формула [(1−стор)+сторλт] n-1, що призводить до наступних перестановок:
Параметр т0 має одиницю часу і називається початковим віртуальним віком системи (IVAS). Параметр Р. еквівалентно початковому рівню смертності в класичній моделі Гомперца [23, 24].
Трипараметрична функція смертності в рівнянні 8 можна використовувати для підбору експериментального набору даних про тривалість життя, який може виявити т0 (початкова віртуальна тривалість життя) та n (кількість взаємодій, що впливають на тривалість життя, на один важливий вузол).
Функція виживання мережі, заснована на функції смертності в рівнянні 8 виявляється
і виявлено, що функція щільності ймовірності старіння мережі становить
Максимум перетвореної в журнал вірогідності, підсумований за всією сукупністю експериментальних даних, дасть оцінки параметрів моделі. Ми застосували ці числові процедури в кодах R.
З огляду на наші прості припущення, важливо перевірити корисність цієї запропонованої економної моделі для клітинного старіння. Отже, ми застосували цю мережеву модель клітинного старіння до реплікативного старіння бутонів-дріжджів завдяки наявності багатьох експериментальних наборів даних, отриманих у контрольованих умовах. Ми припускаємо, що кошторисна n з експериментальних наборів даних про тривалість життя можна назвати очевидною середньою кількістю взаємодій, що впливають на тривалість життя на важливий вузол.
Результати і обговорення
Застосування в дріжджових мутантах з відомими ефектами на реплікативну тривалість життя
Для подальшої демонстрації корисності запропонованої нами моделі ми застосували її до експериментальних реплікативних вимірювань тривалості життя дріжджових мутантів з відомими ефектами на старіння [33]. Ми оцінили параметри моделі з реплікативних тривалостей життя, використовуючи методи максимальної вірогідності. Реплікативні тривалості життя були завантажені для зменшення потенційних помилок встановлення.
SIR2 є NAD-залежною деацетилазою, яка бере участь у приглушенні хромосом, сегрегації хромосом та рекомбінації ДНК. Видалення SIR2 скорочує реплікативну тривалість життя дріжджів і надмірне вираження SIR2 поширює його [33, 34]. Як показано в таблиці 1, результати нашої моделі відповідають різкому зниженню т0 оцінка в сер2 Δ —Мутант видалення SIR2 і помірно підвищений т0 оцінка в SIR2OX—Мутант надмірної експресії SIR2 порівняно з контролем дикого типу BY4742. На основі рівняння 9, т0 обернено пов'язаний із швидкістю затухання взаємодії λ. Нижні значення λ вказують на більш високу надійність білкових взаємодій. Отже, зменшилось значення т0 припускає, що видалення SIR2 знижує надійність взаємодії генів, тоді як надмірна експресія SIR2 збільшує його.
Також були вивчені мутанти двох інших дріжджових генів. FOB1 регулює кількість копій рДНК у клітинах дріжджів, а її делеція продовжує реплікативну тривалість життя дріжджів [33]. HXK2, гексокіназа, обмежує введення глюкози для гліколізу, а мутант її делеції вважається генетичною моделлю для обмеження калорій [33]. Наші результати показують, що в обох мутантах одноразового видалення FOB1 і HXK2, оцінки т0 збільшення та оцінки n залишаються в тому ж діапазоні. У мутантах подвійного видалення де обидва FOB1 і HXK2 відсутні, т0 збільшується з найбільшими середніми значеннями, хоча n зменшується помірно.
Як показано в таблиці 1, ми виявили, що передбачуваний IVAS т0, як правило, набагато більше середньої тривалості життя у цих штамів дріжджів. У всіх досліджуваних штамах тенденції цих змін залишалися, коли ми завантажували експериментальні вимірювання, вказуючи на ці зміни т0 є надійними для встановлення коливань під час повторних експериментів тривалості життя.
Коли т ≪ т0, рівень смертності від біноміальної мережі μчистий наблизиться до класичної двопараметричної моделі старіння Гомперца [24] та коефіцієнта Гомперца, G, виявляється
Отже, запропонована мережева модель старіння може розглядатися як розширення двопараметричної моделі Гомперца і забезпечує альтернативну модель для використання при вивченні клітинного старіння.
Відповідно до нашого погляду, що запропонована модель є продовженням моделі Гомперца, запропонована модель старіння мережі працює аналогічно моделі Гомперца під час підгонки на основі інформаційного критерію Акакайке (AIC) (Таблиця 1). Діапазони оцінюваних AIC з використанням мережевої моделі здебільшого збігаються з діапазонами, що використовують модель Гомперца. Ці спостереження додатково підтверджувались накладанням кривих щільності прилягання протягом гістограм тривалості життя у цих штамів дріжджів (рис. 2). Як правило, коли модель старіння Гомперца добре підходить для експериментальної тривалості життя - наприклад, для дикого типу BY4742, мутантів делеції сер2Δ,hxk2Δ, і fob1Δ—Пропонована модель старіння мережі також є досить придатною. Коли розподіл тривалості життя стає асиметричним у мутанта із надмірною експресією SIR2OX, як модель Гомперца, так і біноміальна модель стають проблематичними.
Накладання відповідних кривих з гістограмами тривалості життя у дріжджових мутантів. Червоні криві підгонки представляють біноміальну форму моделі старіння мережі, а сині криві підгонки представляють двопараметричну модель Гомперца. a BY4742. b fob1Δ. c hxk2Δ. d fob1Δhxk2Δ. e сер2Δ. f Пані2ОХ
Застосовуючи цю просту ощадливу модель для аналізу експериментальних даних, ми пропонуємо оцінити n, що називається очевидною середньою кількістю взаємодій, що впливають на тривалість життя на суттєвий вузол, є подібним до інших теоретичних концепцій, таких як ефективний розмір популяції в генетиці популяцій. Ефективний розмір популяції, хоча часто і значно менший, ніж очевидний розмір біологічних популяцій, може допомогти нам оцінити різні моделі в популяційній генетиці. Інший приклад - ефективна швидкість передачі вірусів в епідеміології. На практиці корисність запропонованої моделі старіння мережі полягає в її здатності допомогти оцінити потенційні зміни генної мережі за результатами експериментального життя. Отже, ми в даний час розробляємо підходи до тестування вкладених моделей на основі правдоподібності для порівняння параметрів моделі старіння мережі з різних експериментів.
Крім того, наша мережева модель пропонує цікаві перспективи старіння бактеріальних фагів [25]. Коли G наближається до нуля, значення т0 підходить до нескінченного на основі рівняння 13, що в свою чергу свідчить про те, що значення λ наближається до нуля на основі рівняння 9. Надзвичайно мала величина λ—Розпад генної взаємодії вказує на те, що сила генних взаємодій може залишатися сильною протягом дуже довгого часу під час старіння. Отже, наша мережева модель передбачає, що сила взаємодії генів надзвичайно надійна у бактеріальних фагах.
Застосування в диких дріжджових ізолятах та значення для кореляції Стрехера-Мулдівана
Ми застосували запропоновану мережеву модель клітинного старіння з використанням реплікативних наборів даних про тривалість життя диких ізолятів Saccharomyces cerevisiae [11]. Як показано в таблиці 2, діапазони значень AIC для мережевої моделі, як правило, перекривають такі для моделі Гомперца, що узгоджується з нашими висновками з використанням лабораторних штамів. Ми виявили, що розрахунковий IVAS (т0) становить від 30,6 до 74,0 із середнім значенням 45,4 у нашій колекції ізолятів диких дріжджів, що знаходиться в тому ж діапазоні BY4742 (т0 = 56,2). Орієнтовний n становить від 6,1 до 8,0 із середнім значенням 7,0, дещо нижчим за показники, оцінені на фоні лабораторного штаму.
Ми виявили, що припущення про т ≪ 1 /λ можна обґрунтовано задовольнити. Якщо припустити активацію взаємодії генів з стор= 0,7, діапазон 1 /λ становить 73–173 клітинні поділи із середнім значенням 106. Якщо припустити стор= 0,9, діапазон 1 /λ становить 283–666 поділів клітин із середнім значенням 408. Середня тривалість реплікативного життя цих природних ізолятів становить 31. Отже, ці результати підтверджують, що припущення про т ≪ 1 /λ для нашого підходу до моделювання можна задовольнити, доки існує ймовірність активації взаємодії стор більше 0,5. Іншими словами, неоднорідність генної мережі повинна бути помірною. Для дріжджових генних/білкових мереж з понад тисячею основних генів стан т ≪ 1 /λ вказує на те, що коли клітина гине у віці т завдяки особливому слабкому суттєвому модулю, інші взаємодії генів залишаються в основному функціональними.
Роль потенційного посередника т0 в кореляції Штрелера-Мілдвана в природних ізолятах дріжджів. a Кореляція Штрелера-Мілдвана у досліджуваних природних дріжджових ізолятах. Розмір кожної точки даних представляє значення т0. b Позитивна кореляція між журнал10Р. і т0. Розмір кожної точки даних представляє значення G. Тести на посередництво показують це т0 опосередковує кореляцію між журнал10Р. і G
Висновки
Ми представляємо імовірнісну модель генної мережі клітинного старіння, яка може служити економною моделлю для інтерпретації експериментального вимірювання тривалості життя. Наша модель старіння мережі перетворює класичний коефіцієнт Гомперца на два параметри: n (середня кількість взаємодій, що впливають на тривалість життя, на один важливий вузол) та т0 (початковий віртуальний вік). Параметр n є інформативним щодо конфігурації мережі та параметра т0 є інформативним щодо надійності взаємодії та неоднорідності мережі. Застосування нашої моделі у старінні дріжджів показало, що наша модель настільки ж застосовна, як і класична двопараметрична модель Гомперца. Загалом, ми показали, що запропонована модель старіння мережі може допомогти молекулярному вивченню клітинного старіння. З огляду на плейотропну природу старіння, ми сподіваємось, що ця робота може стимулювати більший інтерес до розробки більш досконалих мережевих моделей для дослідження старіння.
- Розпізнавання їжі за допомогою нейромережевого класифікатора та множинної гіпотези сегментації зображень
- Зміни в експресії гена FTO та IRX3 у підлітків чоловіків із ожирінням та надмірною вагою, які перенесли
- Фітнес-трекер за допомогою POV-дисплея - Центр проекту Arduino
- Внесок соціальної ізоляції, стриманості та розвантаження задніх кінцівок до змін у гемодинаміці
- Усунути проблеми зсередини за допомогою духовного очищення; Блог Mindvalley