Лікування лугом
Обробка лугом може бути використана для гідролізу матеріалу клітинної стінки мікробів за умови, що бажаний продукт буде переносити рН 10,5–12,5 протягом 30 хв.
Пов’язані терміни:
- Геміцелюлоза
- Ферменти
- Попередня обробка
- Білки
- Амінокислоти
- ДНК
- Лікування кислотою
- Лігнін
- Каррагінан
- Целюлоза
Завантажити у форматі PDF
Про цю сторінку
d-амінокислоти та зшиті амінокислоти у їжі
12.3.6 Харчування та безпека: засвоюваність, використання та токсичні властивості лізиноаланіну та лантіоніну
Обробка лугами білковмісної їжі знижує якість харчування майже всіх видів з причин, описаних у розділі 12.2. Однак нижча засвоюваність LAL-вмісних соєвих білків знижувала швидкість деградації модифікованих білків у рубці великої рогатої худоби бактеріальними ферментами. Це зменшення деградації харчового білка мікроорганізмами жуйних тварин є корисним для жуйних тварин, оскільки воно збільшує кількість перетравленого та всмоктуваного в кишечнику білка і, таким чином, покращує затримку азоту та харчову цінність білка, споживаного великою рогатою худобою та вівцями (Friedman et al. ., 1982; Nishino and Uchida, 1995; Nishino et al., 1996). Обробка лугами покращує засвоюваність та біологічну цінність насіння квасолі звичайної (Phaseolus vulgaris), яку годують щурами, швидше за все, через вилучення або інактивацію дубильних речовин, фітатів та інгібіторів трипсину та вивільнення зв’язаних вітамінів ніацину та рибофлавіну (Jyothi та Sumathi, 1995 ).
Хоча деякі мікроорганізми мають здатність використовувати LAL як джерело Lys, виявлено, що LAL пригнічує ріст у мишей (Sternberg and Kim, 1979). В аналізі росту миші (Friedman et al., 1982), повна заміна Lys на LAL показала, що LAL був на 3,8% настільки ж потужним, як лізин. Для щурів результати суперечливі (Sternberg and Kim, 1979; Robbins et al., 1980). Перетравність LAL, випробуваного у міні-свиней, становила близько 35% (de Vrese et al., 2000; див. Таблиці 12.3 та 12.4). Шкідливі харчові ефекти обробленого лугом казеїну (0,1 або 0,2 N NaOH при 80 ° C протягом 1 год), оцінені за допомогою PER (коефіцієнт ефективності білка: збільшення ваги/споживання білка), можуть бути зведені нанівець додаванням цистеїну (6,1 г/100 г казеїну ), таким чином запобігаючи утворенню LAL під час лікування (Possompes et al., 1989). На відміну від цього, додавання обробленого лугом казеїну цистеїном або метіоніном після лікування не впливало на харчові якості. Очевидно, низька харчова цінність обробленого казеїну обумовлена утворенням DHA, LAL та DAA, а не через відсутність сірчаних АА (Friedman, 1999b). Харчові якості (PER) нативних та ацетильованих казеїну та соєвих білків (які не утворюють LAL) були однаковими. Нічого не відомо про харчову цінність окремих чотирьох ізомерів LAL як джерела l-Lys.
Встановлено, що LAL діє як потужний іон-хелатуючий засіб металу з найбільшим спорідненістю до міді in vitro та in vivo. Щури, яких годували LAL, виявляли посилене ниркове всмоктування та виведення міді, що було менш вираженим щодо заліза, кобальту та цинку (Friedman, 1999b). Чотири ізомери LAL відрізняються своєю здатністю хелатувати іони металів. Пряма залежність між спостережуваною спорідненістю двох ізомерів LAL (ld та ll) до іонів Cu 2+ in vitro та їх відносним токсичним проявом у нирках щурів свідчить про те, що LAL проявляє свою токсичну дію через хелатування Cu в рідинах та тканинах організму ( Фрідман і Левін, 2011).
Masri and Friedman (1982) виявили, що вміст DHA становив 0,33 г/16 г N у лузі, обробленому казеїном, і 1,39 г/16 г N у ацетильованому лугом ацетильованому казеїні. DHA може, в принципі, діяти як біологічний алкілуючий агент, подібний до запропонованого для індукованого процесом акриламіду (Friedman and Levin, 2008).
АМІНОКИСЛОТИ | Рішучість
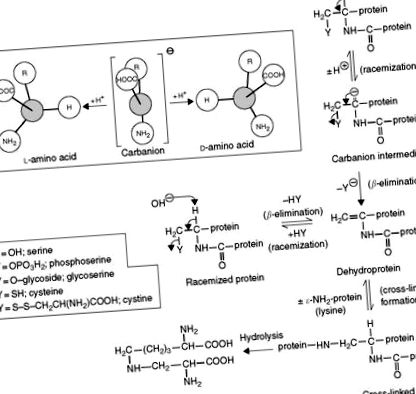
D- і L-амінокислоти
Під час лужної або термічної обробки l -амінокислоти в білках рацемізуються до їх d-ізомерів. Оскільки більшість d -амінокислот не можуть бути використані людиною, а деякі токсичні, їх визначення представляє значний інтерес. D - і l-ізомери мають однакові хімічні властивості і спочатку їх слід перетворити в діастереомерні дипептиди шляхом реакції з хіральними (оптично активними) реагентами перед хроматографією або розділити хіральними нерухомими або рухливими фазами. Дипептиди лейцил-dl-аспарагінової кислоти отримують шляхом сполучення аспарагінової кислоти з 1-лейциновим ангідридом N-карбокси (NCA). Основні амінокислоти поєднуються з l -глютаміном NCA. N-t-бутоксикарбоніл-1-цистеїн та OPA - інші хіральні агенти, які використовувались. Поділ 21 енантіомерів за 40 хв може бути досягнуто за допомогою RPC та детектування флуоресценції. Дериватизації передколонки можна уникнути, використовуючи хіральну рухому фазу, комплекс мідь-пролін (Cu-Pro), з IEC. Діастереомерні комплекси Cu – амінокислоти утворюються на колонці та виявляються шляхом дериватизації після колонки за допомогою OPA. В якості альтернативи може бути використаний метод RPC з використанням хіральної нерухомої фази, в якій комплекс Cu – Pro або Cu – гідроксипролін зв’язаний із стаціонарною фазою діоксиду кремнію.
d - і l -амінокислоти також можуть бути визначені методом GLC із введенням другого, оптично чистого, асиметричного центру в молекулу для отримання діастереоізомерів, які можна розділити на звичайних упакованих колонах. Найкращим методом виявляється використання (+) - бутан-2-олу для утворення (+) - 2-бутилових ефірів. Альтернативно, енантіомери, перетворені у звичайні похідні, наприклад, ізопропілові ефіри транс-жирних кислот, можуть бути розділені на капілярних колонках, покритих хіральними нерухомими фазами, наприклад, N-транс-жирна кислота-1-валіл-1-валін-циклогексильний ефір.
Харчування | Ефекти переробки їжі
Лізиноаланін та споріднені амінокислоти
Теплова та лужна обробка харчових продуктів, широко застосовувана в харчовій промисловості, призводить до утворення дегідро- та зшитих амінокислот, таких як дегідроаланін, метилдегідроаланін, β-аміноаланін, лізиноланін (LAL), орнітиноаланін, гістидиноаланін (HAL), фенілетиламіноаланін лантіонін (LAN) та метиллантіонін, присутні в білках ( Малюнок 8 ). Наявність залишків LAL вздовж білкового ланцюга знижує харчову якість щурів ( Таблиця 6 ) і приматів, але покращує харчові якості жуйних. LAL, HAL та LAN також зустрічаються в пептидних антибіотиках (циннаміцин, дураміцин, нізин та субтилін) та в органах та тканинах тіла (аорта, кістка, колаген, дентин, очна катаракта), де їх утворення може бути функцією процес старіння.
Детальні дослідження показали, що каталізований базою синтез лізиноаланіну протікає шляхом додавання ε-NH2-групи лізину до подвійного зв’язку залишку дегідроаланіну. Цей залишок отримують з цистеїну та/або серину ( Малюнок 9 ). З поживної точки зору утворення лізиноланіну призводить до зменшення незамінної амінокислоти лізину та напівсуттєвої амінокислоти цистину, а також до зменшення засвоюваності модифікованого білка.
Малюнок 9. Механізм каталізованої гідроксидом іонної рацемізації та утворення лізиноаланіну в їжі та інших білках.
Дослідження на щурах виявили гістологічні зміни в нирках, пов’язані з впливом цієї речовини в їжу, або ізольованою, або у складі інтактних білків. Ураження розташовані в епітеліальних клітинах прямої частини проксимальних ниркових канальців і характеризуються збільшенням ядра та цитоплазми, збільшенням вмісту нуклеопротеїнів та порушеннями синтезу та мітозу ДНК.
Через ці спостереження виникло занепокоєння щодо безпеки харчових продуктів, що містять лізиноаланін та споріднені з ним демідроаланінові амінокислоти, які, як відомо, викликають подібні ураження. Однак, оскільки механізм, за допомогою якого ці сполуки пошкоджують нирку щурів, невідомий, важко оцінити ризик для здоров'я людини, спричинений їхньою присутністю в раціоні.
Лізиноаланін має два асиметричні атоми вуглецю, завдяки чому можливі чотири окремі діастереоізомерні форми: ll, ld, dl та dd. Його структура свідчить про те, що він повинен мати чудовий хелатний потенціал для іонів металів, властивість, яка може мати значення для його токсичної дії. Відповідно, досліджено його спорідненість до ряду іонів металів, з яких найсильніше хелатована мідь (II) ( Малюнок 6 ). На цій підставі було висловлено припущення, що можливий механізм пошкодження нирок у щурів, що включає взаємодію лізиноланіну з міддю в епітеліальних клітинах проксимальних канальців.
Явна пряма залежність між спостережуваною спорідненістю двох ізомерів лізиноаланіну до іонів міді (II) in vitro та їх відносним токсичним проявом у нирках щурів відповідає гіпотезі про те, що лізиноаланін здійснює свій біологічний ефект завдяки хелатуванню міді в рідинах та тканинах організму . Обмежені дослідження щодо зв’язування ll - і ld-лізиноаланінів із іонами кобальту (II), цинку (II) та інших металів свідчать про те, що лізиноаланін також може впливати на використання кобальту in vivo.
До факторів, які мінімізують утворення лізиноаланіну, належать наявність цистеїну, N-ацетилцистеїну та відновленого глутатіону, сульфіту натрію, аміаку, біогенних амінів, аскорбінової, лимонної та яблучної кислот, глюкози, дефосфорилювання ефірів О-фосфорилу та ацилювання е -NH2 групи лізину.
Токсикологічна патологія систем
Токсичність амінокислот
Лізіноаланін, амінокислота, що утворюється під час обробки білка лугом, може міститися в оброблених харчових продуктах для споживання людиною. Лізиноаланін індукує нефроцитомегалію та/або каріомегалію у парсі прямо щура та миші (рис. 47.10 В), але цей ефект не спостерігався у хом'яків, мавп чи кроликів. Зміни здаються в основному оборотними. Крім того, довготривалі дослідження з лізиноаланіном не призвели до визнання утворення ниркової пухлини або будь-яких інших несприятливих змін. Лізин, компонент деяких методів парентерального харчування, та ін’єкція D-серину щурам викликають некроз проксимальних канальців. У разі D-серину індукований некроз обмежений pars recta. Серин також зазвичай синтезується in vivo у щурів, а також у нирках людини.
Фосфатази та полінуклеотидкіназа
(а) Метильований залишок G.
Коли рибозне кільце відкрито лужною обробкою, 7-метил-3′-dGMP стійкий до 3′-фосфатазної активності нуклеази PI, але є хорошим субстратом для 5′-кіназної активності T4 PNK (16). Продукт, що відкрився в кільці, насправді фосфорилюється T4 PNK зі швидкістю ~ 10 разів повільнішою, ніж інтактний 7-метил-dGMP (17). Реакція дефосфорилювання, каталізована нуклеазою PI, кільцево розкритих алкільованих продуктів та 3′-dNMP (нормальних продуктів перетравлення ДНК стафілококової нуклеази) надає збагачувальну дію на алкільовані продукти, які є ефективними субстратами для T4 PNK у наступних 32 P після маркування. Ці диференціальні реакційні здатності нуклеотидних субстратів по відношенню до нуклеаз PI та T4 PNK можуть бути використані для аналізу метильованих гуанінів у ДНК (також див. “Застосування”).
Нирки та нижні сечовивідні шляхи
Токсичність амінокислот
Лізіноаланін, амінокислота, що утворюється під час обробки білка лугом, може міститися в оброблених харчових продуктах для споживання людиною. Лізиноаланін представляє інтерес, оскільки він індукує цитомегалію або каріомегалію в нирках щурів та мишей. Цей ефект не спостерігався у хом'яків, мавп або кроликів. Ця зміна здається в основному оборотною. Крім того, довготривалі дослідження не призвели до утворення пухлини нирок або будь-яких інших несприятливих змін. Ця каріомегалія розвивається в парс прямо. Каріомегалія також спонтанно розвивається у РСТ щурів (див. Малюнок 11.6B).
Лізин, компонент деяких методів парентерального харчування, та ін’єкція D-серину щурам викликають некроз проксимальних канальців. D-серин представляє інтерес, оскільки викликає некроз, обмежений pars recta. Серин також зазвичай синтезується in vivo у щурів, а також у нирках людини.
Желатин, колаген та одноклітинні білки як природні та нові харчові інгредієнти
Шармін Султана,. Мохаммад Насір Уддін Ахамад, у підготовці та переробці релігійних та культурних продуктів, 2018
11.2.2 Лужний процес (желатин типу В)
Рис. 11.2. Детальний процес виробництва желатину зі свинячої шкіри та кісток великої рогатої худоби.
Клітинна стінка, відділ клітин та ріст клітин
3.1.1.2.2. Геміцелюлози
Геміцелюлози являють собою нейтральну фракцію цукру, вилучену зі стінок обробкою лугом, після вилучення пектинів. У рослинних тканинах, що складаються з клітин лише з первинними стінками (а не з вторинними стінками, такими як деревина), вони представлені здебільшого ксиланами, ксилоглюканами (XG) та змішаними зв’язувальними глюканами. (Відомо багато інших геміцелюлоз, таких як глюкоманнани у вторинних стінках хвойних порід, а також маннани та галактоманнани в тканинах зберігання деяких насіння. Вони тут не розглядаються.) Ці полімери не екстрагуються водними розчинами хелатуючих агентів або розведеною кислотою, вони міцно зв’язані воднем з фібрилами целюлози і потребують міцного лугу, щоб розірвати ці зв’язки.
Відносна пропорція ксиланів і XG варіюється в первинних стінках різних таксонів. У клітинних стінках хвойних, дводольних та багатьох однодольних рослин XG зустрічається в достатку лише з невеликою кількістю ксиланів. Зворотне стосується первинних стінок інших однодольних рослин, зокрема трав, які також демонструють значну кількість змішаних ланок глюканів.
Рекомендовані публікації:
- Промислові культури та продукти
- Про ScienceDirect
- Віддалений доступ
- Магазинний візок
- Рекламуйте
- Зв'язок та підтримка
- Правила та умови
- Політика конфіденційності
Ми використовуємо файли cookie, щоб допомогти забезпечити та покращити наші послуги та адаптувати вміст та рекламу. Продовжуючи, ви погоджуєтесь із використання печива .
- Склад тіла - огляд тем ScienceDirect
- Білок тіла - огляд тем ScienceDirect
- Бензойна кислота - огляд тем ScienceDirect
- Дихальні вправи - огляд тем ScienceDirect
- Beta 1 Adrenergic Receptor Blocking Agent - огляд тем ScienceDirect