Останні досягнення у розумінні фіброзу печінки: поєднання базової науки та індивідуальних концепцій лікування
Ральф Вейскірхен
1 Інститут молекулярної патобіохімії, експериментальної генної терапії та клінічної хімії (IFMPEGKC), Університетська лікарня RWTH, Аахен, Паувельштрассе 30, Німеччина
Сабіне Вайскірхен
1 Інститут молекулярної патобіохімії, експериментальної генної терапії та клінічної хімії (IFMPEGKC), Університетська лікарня RWTH, Аахен, Паувельштрассе 30, Німеччина
Френк Так
2 Кафедра медицини III, Університетська лікарня RWTH Аахен, D-52074 Аахен, Паувельштрассе 30, Німеччина
Анотація
Вступ
Патогенез фіброзу печінки
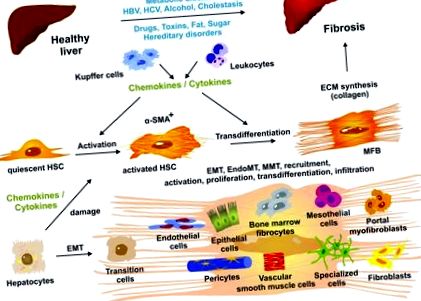
Фігура 1.
Тривале пошкодження печінки призводить до змін печінкової архітектури та розвитку фіброзу. На клітинному рівні спокійні печінкові зірчасті клітини (ГСК) викликаються розчинними медіаторами (хемокінами та цитокінами), що виділяються печінковими макрофагами (клітини Купфера), інфільтруючими лейкоцитами та іншими типами клітин, включаючи пошкоджені гепатоцити. Як активовані HSC, так і трансдиференційовані міофібробласти (MFB) є позитивними для α-актину гладких м’язів (α-SMA). МФБ є переважним джерелом синтезу та осадження колагену. Пул продукуючих позаклітинний матрикс (ЕКМ) МФБ додатково збільшується за рахунок різних типів клітин, таких як резидентні фібробласти, мезотеліальні клітини, циркулюючі (кістковий мозок) фіброцити, епітеліальні клітини, ендотеліальні клітини, перицити, судинні клітини гладких м’язів та інші спеціалізовані клітини типи, які набувають профіброгенну активність і стають здатними експресувати компоненти ECM. Відповідні молекулярні та клітинні механізми, включаючи перехід епітелію в мезенхіму (ЕМТ), перехід ендотелію в мезенхіму (ЕндоМТ), перехід мезотелію в мезенхіму (ММТ), вербування, активація, проліферація, трансдиференціація та інфільтрація вивчається в даний час. Більш детально див. 2, 15. ВГВ, вірус гепатиту В; ВГС, вірус гепатиту С.
Малюнок 2.
У печінці генетичні зміни, порушення обміну речовин, холестаз, вірусні інфекції, паразити, наркотики, токсини, алкоголь, що призводить до алкогольної хвороби печінки (АЛД), а також широкий спектр інших шкідливих сполук та факторів навколишнього середовища можуть призвести до ініціювання та прогресування фіброз. AIH, аутоімунний гепатит; CXCR3, C-X-C мотив рецептора хемокінів 3; ВГВ, вірус гепатиту В; ВГС, вірус гепатиту С; IL28B, інтерлейкін 28B; NASH, безалкогольний стеатогепатит; PNPLA3, пататин-подібний фосфоліпазний домен, що містить білок 3; RNF7, білок безіменного пальця 7; TGF-β, трансформуючий фактор росту-β.
Генетичні порушення
Таблиця 1.
| Хвороба Вільсона | ATP7B | 606882/13q14.3 | 1–9: 100 000 | АТФ-аза, плазматична мембрана-мідь-транспорт білка | 8 |
| Спадкові гемохроматоз | HFE | 613609/6п22.2 | 3–5: 1000 | Мембранний білок подібний до основного білки комплексу гістосумісності I класу; асоціюється з рецептором трансферину | 7 |
| Спадкові не-HFE гемохроматоз Ферропортин |
Рецептор трансферину 2
16. Більше того, пряма механічна обструкція потоку жовчі з печінки в дванадцятипалу кишку, що називається позапечінковим холестазом, спричинена неопластичною інвазією біліарного дерева (наприклад, рак позапечінкових жовчних проток, жовчного міхура або ампули Ватера), кісти, камені в загальному жовчна протока, панкреатит або звуження жовчної протоки може спровокувати порушення відтоку жовчі та викликати фіброз печінки 17 .
Алкоголь
Переважна кількість пацієнтів із надмірним споживанням алкоголю та алкогольним гепатитом, що мають виражений фіброз 18. При алкогольних захворюваннях печінки фіброгенна реакція в печінці після вживання алкоголю обумовлюється ацетальдегідом. Ацетальдегід є першим метаболітом під час детоксикації етанолу, який може прямо і опосередковано регулювати транскрипцію колагену I, запускаючи синтез трансформуючого фактора росту -β1 (TGF-β1) 19. Більше того, хронічний прийом алкоголю провокує утворення АФК, збільшує розмноження кишкових бактерій і змінює проникність кишечника до макромолекул, збільшуючи тим самим ендотоксини, що походять з кишечника, в портальній циркуляції та активуючи клітини Купфера за допомогою рецепторних шляхів, подібних до Толла 20 .
Інфекція вірусом гепатиту
Інфекції вірусами гепатиту В або С є глобальною проблемою охорони здоров’я, пов’язаною зі значною смертністю, що становить понад 1,3 мільйона смертей на рік та дуже мінливі регіональні показники захворюваності та гендерної чутливості до наслідків ускладнень 21–23. Обидві інфекції характеризуються стійким запаленням печінки, що є важливим фактором для встановлення фіброзу та цирозу. Попередні дослідження підрахували, що у всьому світі 57% випадків цирозу та 78% випадків гепатоцелюлярної карциноми пояснюються хронічною інфекцією гепатитом В або гепатитом С 24. Стратегії противірусного лікування та загальне впровадження ефективної вакцинації проти гепатиту В зменшили тягар гепатиту В 25, тоді як введення прямих противірусних засобів проти вірусу гепатиту С пропонує можливість вилікувати хворобу у всьому світі 26 .
Наркотики
Медикаментозне ураження печінки (DILI) є однією з провідних причин гострої печінкової недостатності в західному світі, причому парацетамол (ацетамінофен [APAP]) є найпоширенішим збудником, а потім антимікробними засобами 27. Характер гепатотоксичності, пов'язаної з DILI, класифікується як гепатоцелюлярний, холестатичний або змішаний тип. DILI може в рідкісних випадках також призвести до фіброзу або інших типів хронічних травм, таких як вузлова регенеративна гіперплазія, синдром зникаючої жовчної протоки або навіть цироз 27 .
Аутоімунні розлади
Харчові та метаболічні захворювання
Мікробіота кишечника
Цілісність кишкового бар’єру є надзвичайно важливою для функції осі кишечник – печінка. Негерметична кишка і патологічна транслокація бактерій або бактеріальних компонентів в результаті кількісних або якісних змін мікробіоти кишечника (дисбіоз) призводять до активації резидентних макрофагів печінки (тобто клітин Купфера), що виділяють прозапальні цитокіни та стимулюють синтез матриксу за допомогою HSC через Toll-подібні рецептори 45. Зміни мікробіому кишечника, виявлені в неінвазивних тестах на основі стільця, нещодавно виявились клінічно корисними для діагностики метаболічних захворювань та запущеного фіброзу у пацієнтів з НАЖХП 46. Крім того, існує кореляція між складом мікробіоти кишечника, алкоголем та утворенням АФК (див. Вище).
Венозна обструкція
Обструкція портального венозного потоку може бути наслідком внутрішньопечінкового або позапечінкового тромбозу ворітної вени або портальної каверноми. Загальними факторами ризику тромбозу ворітної вени є знижена швидкість потоку в порталі, тенденція до гіперкоагуляції, пошкодження судин та злоякісна інвазія судин 47. Обструкція печінкового венозного відтоку зазвичай провокує синусоїдальну застійну реакцію і некроз клітин паренхіми, переважно в перинулярних ділянках печінкових ацинусів, що може призвести до утворення мостовидного фіброзу між сусідніми центральними венами 48. Хвороба є складною, і обструкція може виникати в малих венах печінки (вено-оклюзійна хвороба) або в дренуючих венах печінки (синдром Бадда-Кіарі) або є результатом підвищення тиску в піддолькових гілках печінкових вен через хронічна серцева недостатність (застійна гепатопатія). При неправильному лікуванні хронічна обструкція призводить до ішемічного некрозу, подальшого накопичення колагену та ремоделювання стінок регіонарних вен.
Паразити
Найважливішими паразитарними захворюваннями, пов’язаними з фіброзом печінки, є шистосомоз та ехінококоз. Гідатидні кісти, що виникають із Echinococcus granulosus або Echinococcus multilocularis та гранульоми, що утворюються навколо захоплених яєць під час зараження Schistosoma mansoni та Schistosoma japonicum, спричиняють фіброз навколо захопленого паразитичного інвазійного компонента в результаті імунної відповіді господаря 49. Експериментальні дослідження показали, що печінковий гідатидоз, спричинений інфекцією E. granulosus, призводить до збільшення експресії мРНК TGF-β1 та білка на середній та пізній стадіях інфекції та стимулює розвиток фіброзу печінки 50. Подібним чином, дослідження, яке аналізувало 39 пацієнтів з муковісцидозним ехінококозом, показало, що TGF-β-рецептор II, що займає центральну роль у трансдукції сигналів TGF-β1, був значно підвищений в зонах, інфікованих E. granulosus, порівняно з прилеглими нормальними тканинами печінки 51 .
Криптогенні та вроджені захворювання печінки
Як правило, криптогенний розвиток фіброзу та цирозу печінки відбувається в середині та пізньому зрілому віці внаслідок спадкових порушень. У деяких випадках мутації певних білків цитокератину (кератин 18 і кератин 8) пов'язані з патогенезом криптогенних та вроджених захворювань печінки. У зв'язку з цим консервативні амінокислоти, розташовані в місцях з'єднання між окремими структурними мотивами в межах кератинів, є найбільш ефективними у виробленні печінкового фіброзу та цирозу, заважаючи нормальній реорганізації кератинових ниток 52. Інші звіти припускають криптогенну хворобу печінки як наслідок неідентифікованої мутації транспортерів ABC, залучених до обмеження кишкової абсорбції та сприяння жовчовиділенню стеролів, таких як гени ABCG5 (стеролін-1) та ABCG8 (стеролін-2) 53 .
Існуючі та нові методи лікування фіброзу печінки
Існує велика кількість обґрунтованих рекомендацій та рекомендацій клінічної практики щодо лікування пацієнтів із фіброзом печінки відповідно до різних типів захворювань печінки. Природно, що ці рекомендації зосереджені на етіологічних втручаннях або на лікуванні ускладнень захворювання, але не рекомендують загальних «антифібротичних» методів лікування (Таблиця 2). Керівні принципи клінічного лікування від професійних асоціацій, таких як Американська асоціація з вивчення захворювань печінки (AASLD) або Європейська асоціація з вивчення печінки (EASL), мають важливе значення для поліпшення послідовності та якості надання допомоги пацієнтам. На додаток до цих стандартизованих рекомендацій, додаткові та альтернативні методи лікування, рослинні продукти, вітаміни та інші дієтичні добавки широко застосовуються у пацієнтів, які страждають на хронічні захворювання печінки (рисунок 3). Далі ми коротко підведемо поточні схеми лікування та патогенні основи антифіброзних властивостей конкретних методів лікування фіброзу печінки на основі експериментальних даних або, у деяких випадках, клінічних даних.
Таблиця 2.
Малюнок 3.
Поточний печінковий фіброз може бути зупинений або вирішений за допомогою специфічної терапії, викорінення або обмеження дієтології патогенної причини, способу життя та дієти. Крім того, виявилося, що деякі нехтувані особливості способу життя, такі як фізичні вправи, перебування на сонці, добавки вітамінів, а також покращення тривалості та ритму сну є корисними для лікування печінкового фіброзу. Детальніші пояснення див. У тексті. ACC, ацетил-КоА карбоксилаза; АПФ, ангіотензинперетворюючий фермент; ALD, алкогольна хвороба печінки; ASK1, сигналізуюча кіназа 1 апоптозу; CCL2, C-C мотив хемокінового ліганду 2; CCR2/CCR5, C-C мотив рецептора хемокінів 2/5; FXR, рецептор фарнезоїду X; GLP-1, глюкагоноподібний пептид-1; LOXL2, лізил-оксидазоподібний 2; NASH, безалкогольний стеатогепатит; PPAR, рецептор, що активується проліфератором пероксисоми; TGR5, G-білковий мембранний рецептор 5; THR-β, рецептор гормону щитовидної залози-β; ПОРАДИ, трансгугулярний внутрішньопечінковий портосистемний шунт.
Антиоксиданти
Інгібування ураження печінки
Орієнтація на запалення
Дезактивація та елімінація клітин, що продукують позаклітинний матрикс
Головною проблемою у зменшенні фіброзу печінки є зниження кількості клітин та активності клітин, що продукують матрикс, у пошкодженій тканині. Цільова індукція апоптозу та старіння або дезактивація відповідного пулу клітин експериментально досягається різними способами. Експресія білків, що діють як пусковий механізм клітинного старіння, змогла зменшити вироблення колагену I типу як на рівні мРНК, так і на рівні білка в HSC та портальних MFB за допомогою індукції АФК та послабленої сигналізації TGF-β 87, 88. Крім того, модуляція запального середовища може спричинити дезактивацію MFB, що продукують матрикс 89 .
Інгібітори передачі сигналів цитокінів
Виробництво та деградація позаклітинного матриксу
Лікування вірусів, виведення паразитів та виведення наркотиків/токсинів
Численні дослідження підтвердили, що просте скасування або придушення шкідливого подразника може призвести до мимовільного вирішення фіброзу із відновленням до нормальної архітектури печінки 95. Всі ці дослідження демонструють, що фіброз печінки є динамічним двонаправленим процесом, що дозволяє регресувати та одужувати навіть тоді, коли фіброз прогресує 96. Отже, очевидно, що усунення або зменшення вірусного навантаження при хронічному вірусному гепатиті за допомогою противірусних препаратів (або їх комбінацій), виведення паразитів печінки або виведення будь-якого препарату чи токсину, що призводить до пошкодження паренхіми, все ще є першим варіантом при лікуванні всіх фіброзних уражень печінки. У більшості випадків паразитарних інфекцій доступні адекватні ліки (наприклад, празиквантел для всіх видів Schistosoma).
Відновлення еубіозу кишечника та гомеостазу
Відновлення кровотоку
Тромбоз портальної вени та венозна обструкція є загальними ускладненнями при запущеному фіброзі печінки та цирозі печінки. У пацієнтів із стійким задокументованим протромботичним станом показано, що антикоагулянт (наприклад, з низькомолекулярним гепарином) запобігає прогресуванню обструкції ворітної вени, що виникає через тромбоз 47. Експериментальні моделі дали різні результати щодо того, чи зменшує терапевтична антикоагуляція (наприклад, еноксапарин) фіброз та судинний опір 99, 100. У проспективному рандомізованому дослідженні еноксапарин запобігав тромбозу ворітної вени, декомпенсації печінки та смертності у пацієнтів із розвиненим цирозом печінки 101 .
Лікування безалкогольного стеатогепатиту та неалкогольної жирової хвороби печінки
Висновки
Скорочення
ABC, касета, що зв'язує АТФ; AIH, аутоімунний гепатит; CVC, ценікривірок; DILI, медикаментозне ураження печінки; GLP-1, глюкагоноподібний пептид-1; GLP-1R, глюкагоноподібний пептид-1 рецептор; HCC, гепатоцелюлярна карцинома; HSC, печінкова зірчаста клітина; LOXL2, лізил-оксидазоподібний 2; MFB, міофібробласт; ММР, матрична металопротеїназа; НАЖХП, неалкогольна жирова хвороба печінки; NASH, безалкогольний стеатогепатит; PBC, первинний жовчний холангіт; PDGF, фактор росту, що походить від тромбоцитів; PSC, первинний склерозуючий холангіт; АФК, активні форми кисню; TGF-β, трансформуючий фактор росту-β; TIMP, тканинні інгібітори металопротеїнази.
Подяки
Ми щиро дякуємо усім членам наших лабораторій та науковцям, що співпрацюють, за корисні обговорення.
Примітки
[версія 1; судді: 2 затверджені]
Заява про фінансування
Ця робота була підтримана Німецьким дослідницьким фондом (DFG, SFB/TRR57) та грантами Міждисциплінарного центру клінічних досліджень (проекти O3-1, O3-2) в рамках медичного факультету Ахенського університету RWTH.
Фінансисти не мали жодної ролі у розробці досліджень, зборі та аналізі даних, прийнятті рішення про публікацію чи підготовці рукопису.
Примітки
Редакційна примітка щодо процесу рецензування
Огляди факультету F1000 замовляються у членів престижного факультету F1000 і редагуються як послуга для читачів. Для того, щоб зробити ці огляди якомога вичерпнішими та доступнішими, арбітри надають інформацію перед публікацією, і публікується лише остаточна, переглянута версія. Арбітри, які схвалили остаточну версію, перераховані зі своїми іменами та приналежностями, але без звітності про попередні версії (будь-які коментарі вже будуть розглянуті в опублікованій версії).
Суддями, які схвалили цю статтю, є:
Наум Мендес-Санчес, відділ дослідження печінки. Клініка та фонд Medica Sur, Мехіко, Мексика
Лео ван Грансвен, Відділ основних біомедичних наук, Лабораторія біології клітин печінки, Vrije Universiteit Brussel, Брюссель, Бельгія
- Останні розробки технологій смаження, що застосовуються до свіжих продуктів, Тенденції в харчовій науці;
- Патофізіологія муковісцидозу Хвороба печінки Каннелопатія, що веде до змін вроджених
- Харчова біологія нехтується базовою дисципліною харчової науки
- Натуральна сполука в овочах допомагає боротися з жировою хворобою печінки EurekAlert! Новини науки
- Наука або зміїна олія може детоксикувати насправді очистити вашу печінку