Нанотехнологічні стратегії доставки білка
Марія Росіо Віллегас
1 Departamento de Química en Ciencias Farmacéuticas, Facultad de Farmacia, UCM, 28040 Мадрид, Іспанія; [email protected]
2 Centro de Investigación Biomédica en Red de Bioingeniería, Biomateriales y Nanomedicina (CIBER-BBN), 28029 Мадрид, Іспанія
Алехандро Баеса
1 Departamento de Química en Ciencias Farmacéuticas, Facultad de Farmacia, UCM, 28040 Мадрид, Іспанія; [email protected]
2 Centro de Investigación Biomédica en Red de Bioingeniería, Biomateriales y Nanomedicina (CIBER-BBN), 28029 Мадрид, Іспанія
Марія Валлет-Регі
1 Departamento de Química en Ciencias Farmacéuticas, Facultad de Farmacia, UCM, 28040 Мадрид, Іспанія; [email protected]
2 Centro de Investigación Biomédica en Red de Bioingeniería, Biomateriales y Nanomedicina (CIBER-BBN), 28029 Мадрид, Іспанія
Анотація
Застосування терапевтичних білків відіграє фундаментальну роль у лікуванні численних захворювань. Низька фізико-хімічна стабільність білків у фізіологічних умовах ставить під загрозу їх функцію в організмі людини, поки вони не досягнуть своєї мети. Більше того, кілька білків не здатні проходити через клітинну мембрану. Всі ці факти сильно перешкоджають їх терапевтичному ефекту. Наномедицина виникла як потужний інструмент, який може запропонувати рішення для вирішення цих обмежень та поліпшення ефективності лікування на основі введення білка. Цей огляд обговорює переваги та обмеження різних типів стратегій, що застосовуються для доставки білка, таких як ПЕГилирование, транспорт в ліпосомах або неорганічних наночастинках або їх інкапсуляція in situ.
1. Вступ
Перехід пребіотика на біотичну Землю визначався появою самоутримуваного, самовідтворюваного та самостійно зібраного життя. Живі організми - це складні біореакторні системи, де одночасно відбуваються численні біохімічні реакції, що дозволяє їх структурам самостійно збиратися, повторюватися і передаватися. Одним із прикладів структур, які самостійно збираються з точністю та надійністю, є білки. Усі клітини людини мають однакову генетичну інформацію, яка міститься в його дезоксирибонуклеїновій кислоті (ДНК) і кодує білки.
Білки - це амінокислотні ланцюги, які складені в характерні тривимірні структури, що визначаються амінокислотною послідовністю та мікросередовищем. Ці ланцюги утворюють вторинну структуру, що характеризується альфа-спіралями та бета-листами, стабілізованими внутрішньомолекулярними водневими зв’язками. Потім вторинна структура складається в третинну структуру, яка регулюється гідрофобними та гідрофільними взаємодіями, так що гідрофобні зони білка знаходяться в його ядрі, а гідрофільні частини залишаються підданими впливу водного середовища на поверхні білка. Високоспецифічні структури, що утворюються при згортанні білка, та їх точні амінокислотні послідовності визначають функцію білка. Величезна різноманітність високоспецифічних хімічних процесів, необхідних для життя, виходить завдяки великій універсальності потенційних білкових структур і конформацій.
Білки виконують такі основні функції, як каталізація біохімічних реакцій [1], передача сигналу [2], захисні функції [3], регуляторні функції [4,5], контроль долі клітин [6], забезпечуючи клітинну та тканинну структуру [7,8 ], як молекулярних носіїв [9,10,11], і підтримуючи тонкий баланс між виживанням клітин та запрограмованою смертю. З цієї причини білки називають «двигунами життя».
Еукаріотичні клітини містять тисячі білків, які беруть участь у нормальній клітинній функції [12]. Їх правильна функція життєво необхідна для підтримки гомеостазу в організмі. Білкова дисфункція пов’язана з численними захворюваннями, такими як діабет, який складається з незбалансованої регуляції інсуліну, гемофілії, яка є дефектом рівня згортання білка, неврологічних розладів (хвороба Альцгеймера [13] та хвороба Паркінсона [14]), муковісцидозу, який пов’язаний з дефектне згортання та експорт білків з ендоплазматичного ретикулуму [15] та рак (приблизно 50% всіх пухлин людини мають мутантний білок p53) серед інших [16].
Отже, використання білків як терапевтичних молекул представляється привабливою та перспективною терапією для раку [17], аутоімунітету/запалення [18], інфекції [19] та генетичних порушень, і воно показало високу ефективність для лікування численних захворювань [20]., 21]. Білкові терапевтичні засоби включають, зокрема, антитіла, цитокіни, фактори транскрипції та ферменти.
Більше того, білки можуть страждати від протеолізу через протеази, присутні в крові та в живих тканинах, які спричиняють незворотні зміни в їх структурі та, отже, втрату біологічної функції. На додаток до низької стабільності білків, доставка білка створює додаткові проблеми. Сторонні білки, що вводяться внутрішньовенно, часто можна розпізнати за допомогою опсонінів та багатьох рецепторів поглиначів. Опсонізація ліпопротеїнами призводить до накопичення їх у гепатоцитах та інших тканинах, багатих ліпопротеїновими рецепторами. Більше того, приєднання білків комплементу призводить до негайного виведення з крові макрофагами, які утворюють фагоцитарну систему макрофагів (MPS) [26,27]. Таким чином, введені білки часто швидко очищаються селезінкою, печінкою або нирками, де вони можуть бути небажано накопичені та активувати імунні відповіді.
Клінічне використання білків обмежується їх низькою стабільністю [22] проти температури, змін розчинника, зміни рН, сироваткових протеаз, циклів заморожування та зберігання. Крім того, білки, як правило, не здатні перетинати клітинні мембрани [28], вони можуть активувати імунні відповіді та накопичуватися в тканинах, і вони демонструють швидкий кліренс після внутрішньовенного введення [29]. Усі ці проблеми породили розвиток рекомбінантних білків, які намагаються послабити ці обмеження. Рекомбінантний інсулін був першим комерційно доступним рекомбінантним білком, затвердженим FDA США в 1982 р. [30,31,32,33,34]. В останні роки, між 2011–2016 рр., Центр оцінки та огляду лікарських засобів (CDER) та Центр оцінки та огляду біологічних препаратів (CBER) затвердили 62 терапевтичні білки [35].
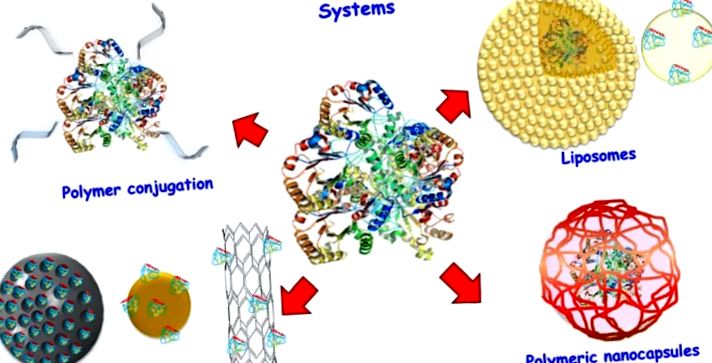
Схема різних систем доставки білка.
2. ПЕГІЛУВАННЯ
На жаль, було встановлено, що приблизно у 25% пацієнтів присутні або розвиваються анти-PEG-антитіла раніше або відразу після першого введення кон'югатів PEG-білка [42,51,52]. Цей факт передбачає швидке очищення від крові введених білків і зводить нанівець їх ефективність для системного лікування.
Іншим гідрофільним полімером, який використовується для одержання ферментних кон'югатів, є полі (вінілпіролідон) (PVP). Після його використання як розширювача плазми під час Другої світової війни [53], PVP був першим полімером, який повідомляв про утворення кон'югатів полімер-лікарський засіб [54]. PVP вважається нешкідливою сполукою [55], а також покращує час циркуляції ферментів [56]. На жаль, кон’югати PVP можуть підвищувати антигенність порівняно із вільними ферментами, як це має місце для урікази [57]. Як альтернатива гідрофільним полімерам, цвіттеріонні полімери також використовувались за здатність координувати молекули води за допомогою водневого зв'язку. Цвіттеріонні полімерні кон'югати показали фармакокінетичні профілі, подібні до систем ПЕГільованого [58]. Іншим варіантом є кон'югація з декстраном, який є полісахаридом, який також продовжує час циркуляції крові [59]. Однак внутрішньовенне введення декстрану може призвести до небезпечної для життя анафілаксії [60,61].
Оскільки кон'югація полімерів є простим і популярним методом, вона застосовується для багатьох комерційних рецептур. Однак кон'югація полімерів часто блокує активні центри ферментів. Таким чином, фермент частково або повністю втрачає свою каталітичну активність [62]. Цей факт, поряд із зазначеними вище, становлять сильні обмеження полімер-білкових кон'югатів.
Як приклад, комерційним способом доставки білка є так звані системи колісниць. Вони складаються з пептиду 2843 Da, здатного утворювати нековалентний комплекс з білком, що дозволяє транспортувати біологічно активні білки в клітини з ефективністю 60–95% [63].
3. Ліпосоми
Один цікавий підхід до доставки білка передбачає їх транспортування в ліпосомах. Ліпосоми складаються з концентричних ліпідних двошарових пухирців, що оточують водні відділи. Везикули утворені фосфоліпідами, і їх структура схожа на структуру клітинної мембрани. Білки можна переносити всередину водної серцевини ліпосоми або прищеплювати на поверхню ліпідів.
Технології ліпосом, функціоналізованих білками, включають завантаження ліпосом у серцевину та на поверхню. Як приклади, Szoka et al. [64] повідомив про технічну процедуру приготування ліпосом з великими водними просторами. Цей метод дозволив їм інкапсулювати водорозчинні матеріали, такі як білки, з високою ефективністю. Цей процес полягає у формуванні ліпідних пухирців, коли водний буфер вводять у суміш фосфоліпідів в органічних розчинниках. Автори повідомляють, що, незважаючи на те, що органічний розчинник виробляє денатуралізацію білка, зберігається значна кількість активності (41%). З іншого боку, широко повідомлялося про завантаження білків на поверхню ліпосом. Шао та ін. [65] синтезовані ліпосоми, включаючи порфіїн-фосфоліпід. Цей фосфоліпід, який здатний хелатувати кобальт, дозволив ефективно захоплювати білки, мічені His. Як додатковий приклад, Blenke et al. [66] розробляють ліпосоми, здатні кон’югувати азид-білок за допомогою хімічної хімії, що дозволяє отримати більше контролю в місці кон’югації, ніж звичайно використовувані хімічні сполуки.
Крім того, потенційною проблемою ліпосом як носіїв білка є їх швидке очищення MPS [74]. Цю проблему можна частково полегшити кон'югацією з ланцюгами ПЕГ на ліпідній поверхні. Насправді було показано, що ПЕГилирование ліпосом подовжує період напіввиведення їх циркуляції з 30 хв до 5 год [75]. Цей тривалий час циркуляції зумовлений збільшенням гідродинамічного об'єму системи та здатністю ПЕГ уникати імунної відповіді стеричною перешкодою. Однак високий ступінь функціоналізації за допомогою ПЕГ призводить до зниження температури плавлення ліпосом, що тягне за собою їх дестабілізацію, тоді як низька функціоналізація зменшує досяжний час циркуляції [76]. Більше того, багаторазове введення ПЕГільованих ліпосом призводить до прискореного очищення крові [77]. Крім того, природа ліпосом обмежує їх клінічне використання, оскільки ліпосоми не є надійними і можуть вивільняти вантажний білок, перебуваючи в середовищі з високою концентрацією ліпопротеїдів, як це відбувається в крові [67,78,79].
Незважаючи на всі ці обмеження, існують комерційні набори для доставки білка на основі ліпосом, як у випадку з ліпофектаміном, який є катіонною ліпосомою, здатною переносити ДНК, siRNA та білки в клітини швидким, простим і відтворюваним методом [80].
4. Неорганічні наночастинки
Неорганічні наночастинки досліджувались як цікаві наноприлади завдяки тому, що вони надійні та легко модулюються. Білки можуть нестись на поверхні наноносіїв або всередині їх структур, у разі пористих наночастинок. Однак застосування таких матеріалів вимагає хімічної та/або біологічної модифікації, щоб задовольнити вимоги до клітинної доставки, такі як біосумісність та тривалий час циркуляції [81].
4.1. Мезопористі наночастинки кремнезему
Прикладом неорганічних наночастинок є мезопористі наночастинки кремнезему (MSN). Ці наночастинки також досліджувались як білкові носії. Вони характеризуються високою площею поверхні та регульованим розміром пор [82], що забезпечує високу вантажопідйомність та дозволяє доставляти найрізноманітніші білки [83]. Ту та його колеги [84] нещодавно запропонували цей тип наночастинок для доставки білків з різною молекулярною масою (12,4-250 кДа), розміром (2,3 × 2,6 × 4 до 7 × 8 × 10 нм) та ізоелектричними точками (4,5–11,35) . Функціоналізація чи відсутність пір наночастинок з амінними групами сприяє електростатичній взаємодії з білками, що несуть негативно або позитивно заряджені групи. Більше того, їх поверхню можна легко модифікувати за допомогою нікелевих фрагментів, щоб хелатувати протеасоми, мічені полігістидином. Клітини, оброблені екзогенними протеасомами, здатні значно погіршити агрегати тау, що є патологічною ознакою хвороби Альцгеймера, порівняно із вільними протеасомами [85]. Ці наночастинки покращили внутрішньоклітинну доставку непроникних мембран білків [83]. Наприклад, продемонстровані MSN здатні внутрішньоклітинно доставляти цитохром С у клітини раку шийки матки людини (HeLa), викликаючи значну загибель клітин [86,87].
4.2. Наночастинки золота
- Помилки щодо білкової та баріатричної хірургії - баріатричні біти
- Білковий порошок з низьким вмістом вуглеводів для ванільного саду для схуднення
- Іонний сироватковий білок
- Як кулька для пологів може допомогти вагітності, пологам і пологам
- Як перестати бути ледачим і невмотивованим 10 швидких стратегій