Нанодетоксикація: нова роль наноматеріалів у лікуванні наркотичної інтоксикації
Лорен М. Грем
1 Кафедра хімії та біохімії, Університет штату Меріленд, Колледж-Парк, MD 20742, США
Тао М Нгуєн
1 Кафедра хімії та біохімії, Університет штату Меріленд, Колледж-Парк, MD 20742, США
Санг Бок Лі
1 Кафедра хімії та біохімії, Університет штату Меріленд, Колледж-Парк, MD 20742, США
2 Вища школа нанонаук та технологій (WCU), Корейський інститут науки та технологій (KAIST), Daejeon 305-701, Корея
Анотація
Лікування інтоксикації передбачає нейтралізацію або очищення отруйної сполуки, але сучасні методи лікування обмежені в їх здатності безпечно та ефективно детоксикувати пацієнта. Нові дослідження були зосереджені на використанні наночастинок як парентеральних детоксикаційних агентів для циркуляції по організму та захоплення токсинів. Змінні склади цих наночастинок контролюють механізм захоплення та видалення конкретних сполук. Як обговорювалося в цій статті, останні методи використання наночастинок для детоксикації демонструють великий потенціал для лікування інтоксикації. Однак перед тим, як універсальний метод детоксикації наночастинок стане доступним для клінічного використання, необхідно подолати кілька проблем.
За останні кілька десятиліть було проведено велике розслідування використання наночастинок при доставці ліків, націлюванні, маркуванні та біовізуванні. Для таких застосувань розроблено численні типи наноматеріалів, такі як ліпосоми, мікроемульсії, наночастинки та нанотрубки [1–12]. Переваги методу, що базується на наночастинках, порівняно із звичайними методами в основному зумовлені їх фізіохімічними властивостями. Наночастинки, синтезовані для біологічних застосувань, складаються з жирних кислот, неорганіки, органіки та оксидів металів. Велике відношення площі поверхні до об'єму, регульований розподіл розміру, простота модифікації поверхні та питома навантажувальна здатність роблять наночастинки оптимальним вибором для застосувань in vivo, таких як цілеспрямована доставка та контрольоване вивільнення ліків [5,6,11–14]. Притаманна універсальність і багатофункціональність наночастинок забезпечує прогрес порівняно із звичайними методами за рахунок поліпшення біосумісності, часу циркуляції та націлювання. Зовсім недавно з’явився новий напрямок досліджень, який використовує ці досягнення для розробки наночастинок спеціально для детоксикації [1,15–18].
Наноматеріали, що використовуються як детоксикаційні агенти
Три основні класи наноматеріалів досліджувались як нанодетоксиканти: міцелярні наноносії, ліпосоми та наночастинки на основі ліганду (табл. 1). Ці частинки слід вводити пацієнтові, циркулювати по крові та захоплювати токсичні сполуки шляхом адсорбції токсину на поверхню матеріалу або інтерналізації токсину матеріалом [24–33].
Таблиця 1
Досліджувані наноматеріали як нанодетоксиканти.
| Мікроемульсія | Полоксамер/этилбутират/жирні кислоти | Адсорбція | [30] |
| Brij 97/гексадекан/октадецилтриметоксисилан Твін-80/етилабурат/жирні кислоти/октадецилтриметоксисилан | Перегородка | [28,33] | |
| Ліпідна нанокапсула | Фосфатидилхолін/тригліцерид | Розділ | [34] |
| Ліпосоми | Диміристоїлфосфатидилгліцерин/діолеоїлгліцерофосфогліцерин | Електростатичні взаємодії | [27,37] |
| Фосфатидилхолін/дистеароїлфосфатидилетаноламін-ПЕГ | Градієнт рН | [24,25,35] | |
| Пальмітоілолеоїлгліцерофосфохолін / діолеоїлгліцерофосфохолін/дипальмітоїлгліцерофосфохолін / дипальмітоїлгліцерофосфоетаноеламін-ПЕГ/роданан | Ферментативна деградація | [38] | |
| Полімери | Олігохітозан/динітробензолсульфоніл | π – π взаємодії | [42,43] |
| N-ізопропілакриламід/N, N′-метиленбісакриламід / бутилакриламід/акрилова кислота | Гідрофобний/водневий зв'язок / електростатичні взаємодії | [31] | |
| Наночастинки | Магнітні наночастинки з карбіду заліза із вуглецевим покриттям, дигоксин антиімунний FAB | Взаємодія антитіло – антиген | [40] |
| Карбід заліза/діетилентріамінпентаоцтова кислота з вуглецевим покриттям | Хелатування | [40] | |
| Наночастинки магнітного латексу, стрептавідин | Взаємодія білок-ліганд | [32] |
FAB: Антигензв’язуючий фрагмент; ПЕГ: поліетиленгліколь.
Міцелярні наноносії
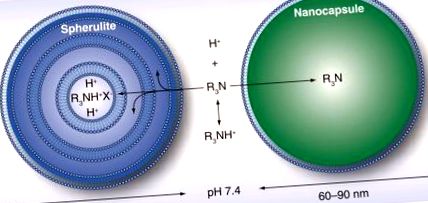
Адаптовано з дозволу [35].
Адаптовано з дозволу [30].
Ліпосоми
Наночастинки на основі ліганду
MIPNP: полімерна наночастинка з молекулярним відбитком.
Адаптовано з дозволу [55].
Сучасні обмеження систем нанодетоксикації
Хоча ці методи детоксикації за допомогою наночастинок продемонстрували здатність захоплювати цільові сполуки, існує кілька недоліків, які обмежують їх застосування. Як згадувалося вище, екстракція мікроемульсіями та наночастинками на основі ліганду відбувається шляхом адсорбції молекул лікарського засобу на зовнішній поверхні частинки. Однак ефективність екстракції значно знижується in vivo через наявність великої кількості сироваткових білків, до яких ліки мають високу спорідненість [15,27]. У присутності цих білків нанодетоксикант повинен агресивно конкурувати за зв'язування молекул ліків. Крім того, через низьку ефективність захоплення, для досягнення терапевтичного рівня лікування необхідно вводити більш високу концентрацію наночастинок. Експерименти in vivo з модифікованим хітозаном та MIP вимагали дозувань відповідно 33 та 30 мг/кг [31,42].
Хоча конкурентне зв'язування не є обмеженням ліпідних нанокапсул та ліпосом, захоплені токсини все одно повинні пройти крізь фосфоліпідну мембрану перед тим, як розподілятися в ядро. Для цього токсин повинен мати спорідненість до мембранних компонентів. Як результат, ліпідні нанокапсули та ліпосоми, як правило, ефективні для видалення переважно амфіфільних та гідрофобних сполук. Інше обмеження пов’язане з тим, що аніонні ліпосоми можуть захоплювати молекули в мембранному бішарі, що може порушити впорядкування фосфоліпідів і призвести до витоку основних компонентів [37].
Наночастинки на основі лігандів обмежені тим же обмеженням, що і звичайне антидотальне лікування. В даний час кожен відомий токсин не має відповідного ліганду; отже, метод застосовний лише до невеликого класу ліків. Як було зазначено раніше, MIP можна синтезувати з широким спектром мономерів, щоб пристосувати сайти зв'язування для захоплення будь-якої сполуки. Вони можуть бути виготовлені для захоплення конкретної мішені шляхом оптимізації типів і співвідношень конкретних мономерів. Однак цей процес трудомісткий і витратний.
Основною проблемою запропонованих методів є їх нездатність врахувати різноманітність доступних ліків та інших токсинів. В ідеалі, успішний метод детоксикації повинен бути зосереджений на інактивації токсинів, а не на їх виведенні. З цієї точки зору, вивчення метаболізму ксенобіотиків людини може дати розуміння досягнення цього методу детоксикації.
Система детоксикації, що імітує біотрансформацію
Майбутня перспектива: нова платформа для нанодетоксикації
Кілька досліджень, що підтверджують концепцію, демонструють різноманітність та вибірковість функціоналізованих СНТ. Лі та ін. приєднував анти-бичачий IgG до одного набору нанотрубок, а антигуманний IgG - до іншого, використовуючи альдегідний силан та хімічну основу Шиффа [6]. Зовнішні поверхні всіх нанотрубок були функціоналізовані поліетиленгліколем (ПЕГ) для обмеження неспецифічної адсорбції. Коли їх поміщали в розчин, що містить IgG людини, лише нанотрубки, функціоналізовані протилюдським IgG, змогли захопити антиген. Що ще важливіше, Мітчелл та ін. показали, що ферменти залишаються активними та функціонують належним чином, прикріплюючись до поверхні нанотрубки [3]. Функціоновані ферментом нанотрубки у розчині використовувались для вимірювання активності глюкозооксидази. На додаток до специфічного націлювання та контрольованої ферментативної активності, група Лі також вивчала швидкість селективного поглинання та вивільнення 4-нітрофенолу, фторурацилу та ібупрофену за допомогою СНТ [6]. Внутрішня поверхня нанотрубок спочатку була функціоналізована аміносиланом, потім SNT додавали до розчину гексану або етанолу, що містить один із препаратів. Ліки накопичуються в нанотрубках завдяки іонній взаємодії між молекулами та поверхневими амінами СНТ.
- Ризики відмови від зловживання кодеїном та Центр лікування наркотиків та алкоголю Detox Novo Detox
- Не їжа, але все-таки судовий процес щодо дієтичних добавок та роль FDA - Їжа, наркотики,
- Російський активіст, розробник додатків утримується в Єкатеринбурзі за володіння наркотиками
- Програма харчової терапії Психічне здоров'я Лікування Нью-Джерсі
- Фізіологічні ознаки під час лікування зубів у дітей із надмірною вагою та нормальною вагою - PubMed