Надмірна вага та ожиріння до, під час та після вагітності
Й. Х. Ступін
1 Фонд Клари Анджели, Віттен, Берлін
2 Клініка акушерства, Charité-Universitätsmedizin Berlin, Берлін
Б. Арабін
1 Фонд Клари Анджели, Віттен, Берлін
2 Клініка акушерства, Charité-Universitätsmedizin Berlin, Берлін
3 Центр матері та дитини, Філіпс-Університет Марбурга, Марбург
Пов’язані дані
Анотація
Анотація
Zusammenfassung
Вступ
Поширеність надмірної ваги та ожиріння різко зросла за останні 20 років, включаючи жінок дітородного віку. За даними німецького національного дослідження споживання, у 2005 та 2006 роках 29% німецьких жінок від 20 до 29 років мали надлишкову вагу та 8,7% страждали ожирінням. У жінок від 30 до 39 років навіть 35,3% мали надлишкову вагу і, крім того, 14,3% страждали ожирінням 1. Все ще спостерігається тенденція до зростання, яка представляє виклик для майбутніх поколінь.
Надмірна вага та ожиріння впливають на різноманітні фізіологічні зміни та молекулярно-біологічні процеси під час вагітності. У частині 1 наших двох публікацій ми зосереджуємось на патофізіологічних та молекулярних механізмах високого ІМТ та його впливах на материнський метаболізм та епігенетичний вплив на плід. Ми повинні знати про пов'язані з цим короткострокові та довгострокові ризики.
У частині 2 ми оцінюємо науково обґрунтовані дослідження та міжнародні рекомендації, щоб задокументувати етапи діагностики, профілактики та зменшення ризику. Класифікація ВООЗ надмірної ваги та ожиріння пояснюється у частині 2, табл. 2. Експериментальні та епідеміологічні дані можуть доповнювати одне одного і відображати реальність.
Надмірна вага та ожиріння під час вагітності
Вагітність, надмірна вага та ожиріння спричиняють підвищену резистентність до інсуліну, початковий гіперінсулінізм та знижену секрецію інсуліну бета-клітинами підшлункової залози, що призводить до діабету 2 типу (T2D) 2, 3. Під час вагітності легкі зміни можуть бути фізіологічними. 4. При надмірній вазі та вагітних із ожирінням існує високий ризик того, що фізіологічні зміни перетворюються на патологічний стан гестаційного діабету (GDM). 5. У спостережних дослідженнях було виявлено тісну кореляцію між надмірною вагою (ІМТ 25–29,9 кг/м 2) або ожирінням (ІМТ ≥ 30 кг/м 2) та ризик ГДМ 6, 7. ГДМ присутній лише у 2,3% вагітних жінок із ІМТ від 18,5 до 24,9 кг/м 2, але у 9,5% пацієнтів із ожирінням 8. Мета-аналіз виявили 3,76-кратний підвищений ризик ГДМ у людей із ожирінням порівняно з вагітними, які не страждають ожирінням, із збільшенням поширеності на 0,82% на приріст ІМТ у 1 кг/м 2 9.
Інсулінорезистентність при ожирінні пов'язана з (про) запальними процесами та субклінічним запаленням 10, 11. Вони пов'язані з судинною дисфункцією, що пояснює підвищений ризик прееклампсії у вагітних із ожирінням 12, 13, 14.
Молекулярно-біологічні механізми
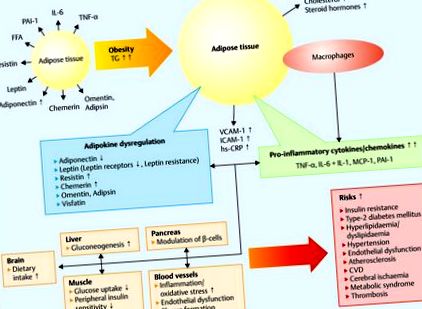
Молекулярна основа ендокринних змін пояснюється тим, що жирова тканина зберігає тригліцериди і являє собою метаболічно високоактивну тканину 15, 16, 17, 18, 19, 20. Збільшення жирової тканини пов'язане із запальною реакцією, що викликає резистентність до інсуліну та серцево-судинні розлади 18 (рис. 1).
Адипокіни, ожиріння та фактори ризику. Жирні кислоти зберігаються у вигляді тригліцеридів (ТГ) адипоцитами. Гіпертрофія адипоцитів призводить до ожиріння. Це збільшує секрецію хемотаксичного білка 1 моноцитів (MCP-1) та накопичення макрофагів, що призводить до прозапального статусу зі збільшенням адипокінів, що секретуються макрофагами (TNF-α, IL-6 та -1). Наслідком є хронічне запалення з високим ектопічним рівнем м’язових ліпідів, порушенням β-окислення мітохондрій та стимульованим інсуліном транспортуванням глюкози. Адипокіни збільшують продукцію молекул адгезії ендотелію, таких як молекула міжклітинної адгезії-1 (ICAM-1), молекула адгезії судин-1 (VCAM-1) та С-реактивного білка (hs CRP), що сприяє дисфункції ендотелію та атеросклерозу відповідно до 18).
Жирова тканина складається з адипоцитів (жирових клітин) та сполучнотканинних клітин строми, до яких належать ендотеліальні клітини, фібробласти та гематопоетичні клітини. Незріла жирова тканина розвивається у плода між 14 та 16 гестаційним тижнем. Попередньо адипоцити поступово диференціюються від скупчень мезенхімальних клітин, перетворюючись у жирові часточки з характерними вакуолями ліпідів у цитоплазмі. Ці жирові часточки оточені щільними перегородками перилобулярної мезенхімальної тканини 21, 22.
Жирова тканина плода починає бути видно в голові та горлі, а пізніше як частина тіла плода та верхніх та нижніх кінцівок 23. Приблизно на 28 гестаційному тижні формування жирової тканини завершується, включаючи кількість часточок жиру. Після цього жирові часточки збільшуються в розмірі (гіпертрофія). Однак, якщо ожиріння в дитинстві розвивається, навіть кількість жирових клітин (гіперплазія) може зрости 24. Тільки при екстремальному ожирінні в зрілому віці кількість жирових клітин все одно може збільшитися 25.
Можна виділити два типи жирової тканини: білу та коричневу жирові тканини, які виконують специфічні функції щодо накопичення жиру, метаболічної активності та термогенезу відповідно 26. У людини утворюється вісцеральна (ПДВ) та підшкірна жирова тканини (САТ). ПДВ відіграє ключову роль у розвитку метаболічного синдрому 16, 17, 21, 27.
TNF альфа, IL-6, IL-10, лептин та адипонектин є частиною більш ніж 50 різних "адипокінів", пептидів, які виробляються з білої жирової тканини. Вони циркулюють у материнській крові та відіграють важливу роль у специфічній для ожиріння захворюваності 16, 17, 28, 31, 39 (табл. 1).
Таблиця 1 Фізіологічні та патофізіологічні ефекти відібраних адипокінів 16, 18, 39).
| TNF-альфа | Запалення, апоптоз, вплив на резистентність до інсуліну, стимуляція дисфункції ендотелію та атерогенез |
| Іл-6 | Запалення, імунна регуляція (модуляція рецептора інсуліну), інсулінорезистентність, атерогенез |
| Адипонектин | Стимуляція секреції інсуліну, підвищення чутливості до інсуліну, стимуляція всмоктування глюкози в м’язи, зменшення запалення, зменшення ліпідів у плазмі, атеропротективний ефект |
| Лептин | Насичення, збільшення використання енергії, контроль ваги, модуляція чутливості до інсуліну, зменшення секреції інсуліну, ангіогенез |
Плацента виробляє адипокіни, подібні до білої жирової тканини, лише не маючи адипонектину, маркера для підвищення чутливості до інсуліну 40, 41. Challier et al. 42 продемонстрували, що кількість макрофагів CD14 + та CD68 + у плаценті жінок із ожирінням збільшилась утричі порівняно з жінками із нормальною вагою. Ці макрофаги продукують прозапальні цитокіни як TNF-альфа та IL-6. Місцеві запальні зміни у вагітних із ожирінням також відображаються на підвищеній концентрації С-реактивного пептиду (CrP) та IL-6 у плазмі крові. Цікаво, що макрофаги CD14 + мали материнське, але не фетальне походження 43.
Дотепер лише кілька досліджень досліджували вплив надмірної ваги та ожиріння на запалення під час вагітності. Рамсей та ін. 13 виявили більш високі концентрації лептину, CrP та IL-6 у сироватці крові у людей із ожирінням у порівнянні із нормальною вагою жінок. Ці циркуліруючі запальні цитокіни також корелювали з більш високим рівнем TNF-альфа- та IL-6-мРНК, що виробляються периферичними мононуклеарними клітинами матері 42. Однак вторгнення макрофагів у ПДВ дотепер було продемонстровано лише у не вагітні ожирілі дорослі 44, 45. У повних павіанів Фарлі та співавт. продемонстрували помітну інфільтрацію макрофагів у жирову тканину 46. Зі збільшенням ступеня ожиріння макрофаги все частіше виробляють фактори транскрипції, адипокіни та запальні молекули 47, що також призводить до резистентності до інсуліну 44.
Вісцеральне ожиріння, пов’язане з непереносимістю глюкози та резистентністю до інсуліну 13, 48, може призвести до ГРМ у жінок із ожирінням 20. На жаль, досліджень, пов’язаних з біохімічними шляхами ГДМ у вагітних, недостатньо. За даними Kirwan та співавт. 49 Рівень TNF-альфа у вагітних із нормальною вагою може передбачити резистентність до інсуліну на пізніх термінах вагітності. Порушення сигнального каскаду інсуліну у вагітних із ожирінням із нормальною толерантністю до глюкози можна продемонструвати як у жировій тканині, так і в скелетних м’язах 50. Негативні наслідки зайвої ваги та ожиріння стають більш очевидними при непереносимості глюкози та інсулінорезистентності 21, 51, 52. Запальні процеси тісно пов’язані з поширеністю гіпертензії, спричиненої вагітністю, або прееклампсії у вагітних із ожирінням 53.
Ожиріння матері, пов’язане із ГРМ та гіпертонічною хворобою, пов’язане, таким чином, із запальною реакцією білої жирової тканини, плазми та плаценти. Цей «прозапальний стан» повинен бути основним механізмом, що лежить в основі інсулінорезистентності та гіпертонії у вагітних жінок із ожирінням 20.
Перинатальне програмування зайвої ваги та ожиріння
Тим часом “перинатальне програмування” було створено як поле досліджень для вивчення впливу внутрішньоутробного та раннього постнатального середовища на основні механізми здоров’я та хвороб 54, 55, 56, 57, 58, 59 (рис. 2). Основна увага приділяється явищу епігенетичної передачі набутих станів матері та плоду.
Патогенетичні механізми та наслідки перинатального неправильного програмування. Етіологія пере- та новонародженого перегодовування та гіперінсулінізму при надмірному наборі ваги, надмірній вазі/ожирінні, цукровому діабеті типу 2 та наступних серцево-судинних захворюваннях у подальшому житті (змінено відповідно до 58).
Результати епідеміологічних, клінічних та експериментальних досліджень на тваринах вказують на вплив харчування під час внутрішньоутробного та раннього постнатального розвитку та його вплив на виникнення надмірної ваги, ожиріння, захворювань на серцево-судинну систему та серцево-судинні захворювання в подальшому житті 60, 61. Метаболічний стан під час вагітності та тип харчування в період новонародженості (наприклад, годування груддю та його довгостроковий ефект) можуть мати негативні або позитивні наслідки для зростаючої дитини до дорослого віку 62, 63, 64, 65.
Гюнтер Дернер з Шаріту в 1970-х роках постулював, що T2D "передається" частіше з материнської лінії, ніж з батьківської. 66. Він розробив концепцію "перинатального програмування" і створив "функціональну тератологію" 67. У 1990-х групах Хейлза і Баркера описали концепцію "пренатального походження хвороби дорослих" у плодів із затримкою росту та новонароджених 68.
Окрім генетичних факторів, дієта матері та стан харчування під час вагітності мають критичний вплив на внутрішньоутробний ріст та вагу при народженні. У розвинених країнах загальна вага при народженні зросла на 126 г за останні 20-30 років. Відповідно, частота макросомії зростала на 25% за декаду 69, 70, 71, 72, внаслідок чого епігенетичні причини повинні бути основним механізмом.
Ризик макросомії (вага при народженні> 4000 г) більш ніж подвоєний або навіть потроєний у дітей із ожирінням або хворими на ожиріння жінок 73, і в основному поєднується із надмірним збільшенням ваги 69, 76. У частині 2 ми пояснюємо клінічні наслідки та ускладнення 74 Незалежно від ваги до зачаття, збільшення ваги матері під час вагітності позитивно корелює з вагою при народженні 69, 75.
Епідеміологічні дослідження показали позитивну кореляцію між масою тіла при народженні та масою тіла в зрілому віці, що свідчить про те, що макросомія плода, пов'язана з ожирінням матері, асоціюється з ожирінням у подальшому житті 77, 78. Метааналіз загальної кількості 643 902 особи від 1 до 75 років вік з 26 країн виявив позитивний лінійний зв'язок між вагою при народженні та пізньою надмірною вагою в 59/66 (89,4%) дослідженнях. У чотирьох дослідженнях (6,1%) кореляції не спостерігалося. У трьох дослідженнях (4,5%) було описано U-подібне відношення, тобто подібне збільшення ризику низької та високої ваги при народженні. Однак не було описано жодного лінійного зворотного відношення. На основі скоригованої оцінки було показано, що ризик надмірної ваги у подальшому житті у дітей з високою вагою при народженні майже вдвічі (АБО 1,96, 95% ДІ 1,43–2,67) порівняно з дітьми з нормальною вагою при народженні (2500–4000 г) 78.
Метааналіз кореляції між вагою при народженні та подальшим ризиком розвитку T2D, відповідно, виявив U-подібну залежність у всіх опублікованих дослідженнях, що пояснюють, що діти з низьким рівнем народження та високою вагою при народженні мають підвищений ризик розвитку T2D в подальшому житті 79.
Здається, порочне коло полягає в тому, що ожиріння під час вагітності спричиняє GDM у матері та збільшену масу тіла та ожиріння у нащадків, які потім розвивають пов'язані з цим діабетичні метаболічні порушення, наприклад, GDM у жінок 80, 81, 82, 83, 84.
Подібним чином, дослідження на тваринах показали, що не тільки надмірна вага та ожиріння матері, але і харчування під час вагітності впливають на потомство: вагітні самки японських макак, які отримували або жир (35% жиру), або звичайну дієту (13% жиру) під час вагітності показали відмінності в юнацькому мікробіомі шлунково-кишкового тракту протягом першого року життя 85. Кампілобактер не був виявлений у юнацькому мікробіомі після дієти з високим вмістом жиру. Ці зміни були дуже стабільними і навіть нормальним харчуванням не могли бути виправлені після пологів.
Перинатальне неправильне програмування може також залучати центральні нервові регуляторні центри обміну речовин і контролю маси тіла. Таким чином, надмірна вага матері та/або діабет матері (гіперглікемія) під час вагітності та раннє перенапруження після пологів призводять до підвищення рівня інсуліну, глюкози, білка та/або лептину на критичних стадіях розвитку (наприклад, гіперінсулінізм плода). Неправильне програмування за допомогою епігенетичних механізмів призводить до пожиттєвої схильності до надмірної ваги, ожиріння та діабетичних метаболічних розладів у поколіннях 54, 58, 63, 89, 90.
Епігенетичними механізмами є метилювання ДНК, модифікація гістонів та регуляція мікроРНК. Досліджено метилювання основ цитидину в димерах цитозин-гуанозинових нуклеотидів (CpG) (метилювання ДНК) 91. Високометильована ДНК (особливо так звані промоторні області) знижує експресію гена 91. Лише деякі дослідження досліджували внесок епігенетичні механізми метаболічного програмування плоду на молекулярному рівні 92, 93, 94, 95, 96. У плацентах жінок із гестаційним діабетом виявлено модифікації метилювання генів лептину та адипонектину (LEP та ADIPOQ). LEP і ADIPOQ класифікуються як гени-кандидати ожиріння та GDM 93, 96. Крім того, було показано, що загальне метилювання в плацентах жінок із ожирінням значно вище, ніж у жінок із нормальною вагою 97. Ці зміни мають тривалий вплив на регуляцію метаболізм нащадків, якщо вони відображають метилювання ДНК в інших тканинах, що викликає розвиток хронічних метаболічних порушень.
При ожирінні матері без непереносимості глюкози експресія мікроРНК залишається незмінною. У дослідженні на 16 вагітних жінок із ожирінням та 20 із нормальною вагою з нормальною толерантністю до глюкози експресія мікроРНК у пуповинній крові істотно не відрізнялася 98. Автори дійшли висновку, що при програмуванні плода інші механізми є більш доречними.
Майбутня профілактика повинна розпочатися ще до зачаття, щоб уникнути ожиріння матері, ГДМ та епігенетичних модифікацій. У вагітних щурів було продемонстровано, що програма фізичних вправ під час вагітності може мати позитивний вплив на метаболічний фенотип потомства 99. Відсоток знежиреної маси тіла у нащадків чоловічої статі був збільшений, а жирова маса зменшена. Втручання та лонгітюдні дослідження можуть допомогти виявити, чи можемо ми також змінити епігенетику та перинатальне програмування GDM, зайвої ваги чи ожиріння.
Висновки
Надмірна вага та ожиріння призводять до збільшення материнської та перинатальної захворюваності та смертності. Молекулярно-біологічні механізми, як гестаційний діабет або метаболічний синдром, ще недостатньо досліджені. Місцеві та системні запальні процеси, спричинені жировою тканиною, схоже, відіграють ключову роль. Незважаючи на зростаючу поширеність надмірної ваги та ожиріння у вагітних жінок у західних країнах, включаючи Німеччину, клінічні дослідження механізмів та втручань є мізерними, хоча діагностика є простою. Необхідні подальші дослідження біології жирової тканини та її асоціації з резистентністю до інсуліну, утворенням адипокінів та дисфункцією ендотелію.
Слід впровадити програми первинної профілактики. Уникнення надмірної ваги та ожиріння в дитинстві та підлітковому віці та належне збільшення ваги під час вагітності 100 мають важливе значення. Важливими є освітні програми до зачаття. Слід також розглянути питання про стимулювання грудного вигодовування для новонароджених.
Виноски
Конфлікт інтересів Жоден.
- Визнання та управління надмірною вагою та ожирінням на первинному рівні в Німеччині - PubMed
- PPT - Управління вагою Надмірна вага, ожиріння та недостатня вага Презентація PowerPoint - ID 3359245
- Метаболічний еквівалент (MET) при надмірній вазі та ожирінні Короткий реферат
- Надмірна вага та ожиріння у хворих на муковісцидоз Аналіз на основі центру - Ганна - 2015 -
- Надмірна вага, ожиріння та втрата ваги впливають на функцію мозку - Інститут харчування Гербалайф -