Надмірна стимуляція передачі сигналів інсуліну/IGF-1 західною дієтою може сприяти цивілізаційним захворюванням: уроки, отримані від синдрому Ларона
Анотація
Шлях інсулін/інсуліноподібний фактор росту-1 (IGF-1) керує еволюційно збереженою мережею, яка регулює тривалість життя та тривалість життя. Особи з синдромом Ларона, які мають мутації в рецепторі гормону росту (GHR), які призводять до важкого вродженого дефіциту IGF-1 із зниженою передачею сигналу про інсулін/IGF-1 (IIS), демонструють знижений рівень поширеності вугрів, діабету та раку. Західна дієта з високим споживанням гіперглікемічних вуглеводів та інсулінотропних молочних продуктів надмірно стимулює IIS. Скорочення IIS у суб'єктів Ларона розкриває потенційну роль стійкої гіперактивної IIS, опосередкованої західною дієтою, у розвитку цивілізаційних захворювань та пропонує раціональну перспективу для коригування дієти з менш інсулінотропними дієтами, такими як палеолітична дієта.
Вступ
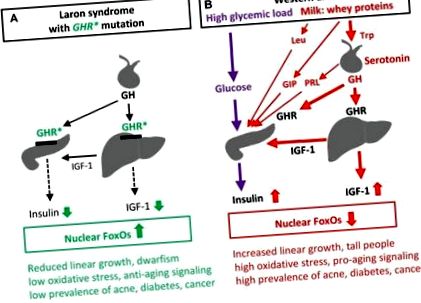
Нещодавно Гевара-Агірре та ін повідомлялося про 99 еквадорських осіб із синдромом Ларона через рецептор гормону росту (GHR) дефіцит та вроджена недостатність інсуліноподібного фактора росту 1 (IGF-1), у яких не розвинувся діабет 2 типу (T2D) і майже не було раку, на відміну від їх здорових родичів із нормальним сигналом інсуліну/IGF-1 ) [1]. Нещодавнє всесвітнє опитування Штюрмана та ін продемонстрували, що жоден із 230 осіб із синдромом Ларона не страждав на рак [2]. Синдром Ларона є дуже інформативним природним експериментом і розкриває зв'язок між низьким рівнем IIS та пов'язаним із ним захистом від цивілізаційних хвороб, на відміну від перебільшених IIS, спричинених західною дієтою, як показано на малюнку 1.
Вплив сигналізації інсуліну/IGF-1 при синдромі Ларона (A) та західній дієті (B) на FoxO-опосередковану регуляцію генів та супутні патології. GHR *, мутація втрати функції рецептора гормону росту при синдромі Ларона; GIP, глюкозозалежний інсулінотропний поліпептид, інкретин, індукований білком сироватки, який стимулює проліферацію β-клітин та секрецію інсуліну; PRL, пролактин; Секреція PRL індукується серотонінергічним сигналом гіпоталамуса; Trp, триптофан та Leu, лейцин, незамінні амінокислоти, збагачені сироватковим білком α-лактальбуміну; Trp через синтез серотоніну стимулює секрецію GH і PRL гіпофіза, а Leu стимулює проліферацію β-клітин та секрецію інсуліну.
Сигналізація про інсулін/IGF-1/FoxO у нелюдських організмів
Патогенез вікових захворювань був пов'язаний з порушенням здатності протидіяти клітинним пошкодженням, викликаним окислювальним стресом. У T2D деякими наслідками окисного середовища є розвиток резистентності до інсуліну, дисфункція β-клітин, порушення толерантності до глюкози та дисфункція мітохондрій [8]. Окислювальний стрес, пов'язаний з етіологією раку, є наслідком дисбалансу у виробництві активних форм кисню (АФК) та власного антиоксидантного захисту клітини. АФК дерегулюють окисно-відновний гомеостаз та сприяють утворенню пухлини, ініціюючи абераційну індукцію сигнальних мереж, що викликають пухлиноутворення [9]. Білки FoxO є головними регуляторами стійкості до окислювального стресу та активують експресію супероксиддисмутази та каталази марганцю [5]. Більше того, FoxO1 на рівні промотору індукує експресію Hmox1 (гемоксигеназа 1), зменшуючи тим самим мітохондріальне дихання та утворення АФК [5]. Таким чином, підвищений рівень IIS з регульованим ядерним рівнем FoxO погіршує адекватну елімінацію АФК, найважливішого механізму, що сприяє розвитку вугрів, T2D та раку.
Сигналізація про інсулін/IGF-1/FoxO та діабет 2 типу
FoxO1 інгібує проліферацію β-клітин [10]. Харчові зміни транскрипційної активності β-клітин FoxO1 переважно опосередковуються за допомогою стимульованої глюкозою секреції інсуліну та сигналізації рецепторів інсуліну. Нещодавно концепція "метаболічної діапаузи" була запропонована для змін, викликаних FoxO1, для захисту β-клітин від окисного стресу, що лежить в основі концепції відпочинку β-клітин як цілі лікування при T2D [11]. Таким чином, FoxO1, точка зближення IIS, організовує проліферацію β-клітин та апоптоз, які обидва збільшуються при T2D [12].
Інсулін/IGF-1/FoxO сигналізація та рак
GH, IGF-1 та інсулін впливають на розвиток раку, а підвищений рівень IGF-1 у сироватці крові асоціюється із підвищеним ризиком раку передміхурової залози, молочної залози та прямої кишки [13]. Стюерман та ін провели велике всесвітнє опитування щодо поширеності раку у пацієнтів з різними причинами вторинного вродженого дефіциту IGF-1 і підтвердили, що суб'єкти із синдромом Ларона з вродженим дефіцитом IGF-1, здається, захищені від розвитку раку [2]. IIS регулює ядерний розподіл білків FoxO, які все частіше вважаються унікальними клітинними мішенями, спрямованими проти раку людини, з огляду на їх проапоптотичні ефекти та здатність призводити до зупинки клітинного циклу [5, 14]. FoxOs беруть участь у контролі ангіогенезу, проліферації стовбурових клітин, адгезії клітин, реакції на окислювальний стрес, а також вродженого та набутого імунітету. Таким чином, постійно збільшений рівень IIS з послідовним зниженням рівня ядерного FoxO може сприяти розвитку раку [14].
Сигналізація про інсулін/IGF-1/FoxO та вугрі
Західна дієта посилює передачу сигналів про інсулін/IGF-1
Їжа на основі зерна, цукор та молочні продукти є основними харчовими продуктами західної дієти. Дієти з високим глікемічним навантаженням були визнані обтяжуючими факторами прищів, тоді як дієта з низьким глікемічним навантаженням покращила прищі та знизила біодоступність вільного IGF-1 у плазмі [21].
Молоко та кисломолочні продукти, що містять сироваткові білки, демонструють високий вміст інсулінемічний індекс порівняно з низьким вмістом вуглеводів [22]. Це явище є секретом IIS молока ссавців - еволюційно передбаченої програми сприяння росту новонароджених [16]. Споживання коров’ячого молока у людей зміщує соматотропну вісь на більш високі рівні і значно підвищує рівні GH та IGF-1 у сироватці [23] (Малюнок 1B). Встановлено, що пероральний прийом сироваткового білка α-лактальбуміну збільшує соматотропну вісь у здорових жінок. Існують вагомі епідеміологічні докази того, що споживання молочних продуктів значно підвищує рівень IGF-1 у сироватці крові у людей [24]. Це пояснює, чому велике споживання молока збільшує лінійний приріст [25]. На відміну від них, низький зріст є характерною рисою вродженого дефіциту IGF-1 при синдромі Ларона. Таким чином, західна дієта зміщує вісь GH/IGF-1 до аномально високих рівнів, якраз у протилежному напрямку низького рівня IIS, який спостерігається при синдромі Ларона [1, 2] (рис. 1).
Перебільшена передача сигналів про інсулін/IGF-1 західною дієтою та діабетом 2 типу
Інсулінорезистентність та гіперінсулінемія є характерними рисами метаболічного синдрому. Широке вживання гіперглікемічної їжі з посиленою передачею глюкози передачею сигналу до β-клітин підшлункової залози є основним фактором проліферації β-клітин, що опосередковується глюкозою/FoxO1, та порушенням реакцій окисного стресу на β-клітини [8–11].
Споживання молока після періоду відлучення підтримує високий рівень IIS, що постійно стимулює проліферацію β-клітин підшлункової залози [26]. Продовження надмірної стимуляції β-клітин підшлункової залози IIS, що керується сироватковим білком, після періоду відлучення може постійно знижувати рівень ядерного FoxO, сприяючи тим самим пошкодженню β-клітин окислювальним стресом, що нарешті призводить до раннього настання β-клітинного клітинного старіння та апоптозу [26]. Дійсно, підвищена проліферація та апоптоз β-клітин протягом життя є ознаками T2D [12].
Перебільшений інсулін/IGF-1 сигналізує про західну дієту та рак
Підвищений рівень IIS був причетний до того, що він відіграє важливу роль у більшості типів епітеліальної неоплазії [13, 27]. Більш високий рівень IGF-1 у сироватці крові асоціювався з підвищеним ризиком смерті від раку у літніх чоловіків, що мешкають у громаді [28]. З іншого боку, суб'єкти із синдромом Ларона ілюструють, що низький рівень ІІС пов'язаний з низьким рівнем поширеності раку [1, 2]. Однак слід зазначити, що випробовувані Лароном живуть довше, ніж звичайні випробовувані, які харчуються західною дієтою, і якщо вони не лікуються належним чином, помирають від серцево-судинних захворювань.
Висновок та перспективи на майбутнє
Синдром Ларона із зменшенням IIS асоціюється із зменшенням поширеності вугрів, T2D та раку. На відміну від цього, регульований ІІС західним харчуванням сприяє розвитку хронічних захворювань цивілізації. Палеолітична дієта, яка виключає гіперглікемічні вуглеводи та інсулінотропні молочні продукти, успішно запроваджена для профілактики та лікування вугрів, T2D та серцево-судинних захворювань [16, 29]. Подальші зусилля повинні бути спрямовані на зниження високого інсулінемічного індексу молока (I.I. 140) та інших молочних продуктів на основі сироватки, щоб досягти значень яловичини (I.I. 51) або сиру (I.I. 45) [16, 29]. Крім того, комбінації гіперглікемічних вуглеводів та інсулінотропних молочних продуктів з посилюючим впливом на IIS повинні бути обмежені.
Особи з генетичними однонуклеотидними поліморфізмами (ОНП), що призводять до гіперактивної IIS, можуть зазнати особливого ризику для розвитку вікових захворювань, переважно, коли їх високий внутрішній IIS замінюється перебільшеними IIS західної дієти. Що цікаво, генетичні варіації зі зниженою IIS внаслідок SNP взаємодіючих компонентів каскадів IIS (GH1, IGF1, IGF1R, IRS1, FoxO1A, FoxO3A) та були пов’язані із збільшенням тривалості життя [30, 31]. Таким чином, майбутні дослідження повинні розглянути вплив взаємодіючих власних генетичних, а також зовнішніх дієтичних факторів, що беруть участь у регуляції IIS.
Доступ до більшої кількості інсулінотропних продуктів та продуктів, що піднімають IGF-1 (цукор, зернові та молочні продукти), стався близько 10 000 років тому під час Неолітична революція і було додатково доповнено Промислова революція. Однак геном людини, можливо, не пристосувався до цього "недавнього переходу" на вищий рівень IIS, зумовлений західною дієтою. За даними мітохондріальної ДНК, сучасні люди з майже подібною геномною структурою жили приблизно 200 000 років тому і споживали менш інсулінотропну палеолітичну дієту. У зв'язку з цим пропонується адаптувати наше харчування до корисних характеристик наших досільськогосподарських дієт [32]. Часовий момент запровадження збалансованої палеолітичної дієти може бути особливим питанням, що викликає занепокоєння, оскільки правильний ІІС важливий для функції репродуктивної та центральної нервової системи. Однак у зрілому віці обмеження дієти, що зменшують IIS, може зменшити ризик вікової патології, такої як протеотоксичність, як нещодавно було продемонстровано на мишачій моделі хвороби Альцгеймера [33].
Скорочення
каталітична субодиниця PI3K оф C. elegans
- STORRE Західна дієта на горилах Синтез із шести місць
- Цукор зараз є ворогом номер один у західному раціоні - Business Insider
- Перехід на здорову дієту запобігає згубним наслідкам західної дієти в
- Шокер Західний світ; s Дієта робить всіх по-науковому "дурнішими"
- Ротові бактерії можуть спричинити захворювання кишечника, їжте дієту, яка сприяє кишечнику, щоб зменшити ризик