mTOR регулює ендоцитоз та транспорт поживних речовин у проксимальних трубчастих клітинах
Флоріан Гремхаммер
* Кафедра медицини IV, Медичний центр - Університет Фрайбурга, Медичний факультет, Фрайбурзький університет, Фрайбург, Німеччина;
Суреш К. Рамакрішнан
† Інститут анатомії, Медичний факультет, Університет Фрібурга, Фрібур, Швейцарія;
Маркус М. Ріншен
‡ Департамент внутрішніх хвороб та Центр молекулярної медицини Кельн, Кельнський університет, Кельн, Німеччина;
Олексій Олександрович Ларіонов
† Інститут анатомії, Медичний факультет, Фрібурзький університет, Фрібур, Швейцарія;
Мар’ям Сайєд
† Інститут анатомії, Медичний факультет, Фрібурзький університет, Фрібур, Швейцарія;
Хазім Хатиб
§ Медичний факультет IV, Sektion Nieren- und Hochdruckkrankheiten, Тюбінгенський університет, Тюбінген, Німеччина;
Мальте Рерден
§ Медичний факультет IV, Sektion Nieren- und Hochdruckkrankheiten, Тюбінгенський університет, Тюбінген, Німеччина;
Йорн Олівер Сасс
‖ Біоаналітика та біохімія, Департамент природничих наук, Університет прикладних наук Бонн Рейн Зіг, Рейнбах, Німеччина;
¶ Відділ клінічної хімії та біохімії та Центр досліджень дітей, Університетська дитяча лікарня Цюріх, Цюріх, Швейцарія;
Мартін Гельмштадтер
* Кафедра медицини IV, Медичний центр - Університет Фрайбурга, Медичний факультет, Фрайбурзький університет, Фрайбург, Німеччина;
Доротея Осенберг
* Кафедра медицини IV, Медичний центр - Університет Фрайбурга, Медичний факультет, Фрайбурзький університет, Фрайбург, Німеччина;
Лукас Кюне
* Кафедра медицини IV, Медичний центр - Університет Фрайбурга, Медичний факультет, Фрайбурзький університет, Фрайбург, Німеччина;
Олівер Крец
* Кафедра медицини IV, Медичний центр - Університет Фрайбурга, Медичний факультет, Фрайбурзький університет, Фрайбург, Німеччина;
Нікола Ваннер
* Кафедра медицини IV, Медичний центр - Університет Фрайбурга, Медичний факультет, Фрайбурзький університет, Фрайбург, Німеччина;
Франсуа Журе
** Groupe Interdisciplinaire de Génoprotéomique Appliquée, Серцево-судинні науки, Університет Льєжу, Льєж, Бельгія; і
Томас Бензінг
‡ Департамент внутрішніх хвороб та Центр молекулярної медицини Кельн, Кельнський університет, Кельн, Німеччина;
Ферру Артунк
§ Медичний факультет IV, Sektion Nieren- und Hochdruckkrankheiten, Тюбінгенський університет, Тюбінген, Німеччина;
Тобіас Б. Губер
* Кафедра медицини IV, Медичний центр - Університет Фрайбурга, Медичний факультет, Фрайбурзький університет, Фрайбург, Німеччина;
†† BIOSS, Центр досліджень біологічних сигналів та
‡‡ FRIAS, Фрайбурзький інститут перспективних досліджень та ZBSA, Центр аналізу біологічних систем, Фрайбурзький університет імені Альберта Людвігса, Фрайбург, Німеччина
Франциска Тейліг
† Інститут анатомії, Медичний факультет, Фрібурзький університет, Фрібур, Швейцарія;
Пов’язані дані
Анотація
Проксимальні канальцеві клітини нирок постійно переробляють поживні речовини, щоб забезпечити мінімальну втрату життєво важливих субстратів у сечі. Хоча більшість транспортних механізмів були відкриті на молекулярному рівні, мало відомо про фактори, що регулюють ці процеси. Тут ми показуємо, що mTORC1 та mTORC2 спеціально та синергічно регулюють ендоцитоз та транспортні процеси PTC. Використовуючи умовний генетичний підхід миші для вимкнення непотрібних субодиниць mTORC1, mTORC2 або обох, ми показали, що у мишей, у яких бракує mTORC1 або mTORC1/mTORC2, але не лише mTORC2, розвивається фанконіподібний синдром глюкозурії, фосфатурії, аміноацидурії, низькомолекулярної протеїнурії, та альбумінурія. Цікаво, що протеоміка та фосфопротеомія свіжоізольованої кори нирок виявляли або знижену експресію, або втрату фосфорилювання при критичних залишках різних класів специфічних транспортних білків. Функціонально це призвело до зменшення транспорту поживних речовин та глибокого збурення ендоцитарного механізму, незважаючи на збережену абсолютну експресію основних рецепторів поглинача, МЕГАЛІНУ та КУБІЛІНУ. Наші висновки підкреслюють нову залежну від mTOR регуляторну мережу транспорту поживних речовин у проксимальних канальцевих клітинах нирок.
Гомологи ссавців TOR1 (mTORC1) і mTORC2 є внутрішньоклітинними багатобілковими комплексами, що регулюють тканиноспецифічні клітинні функції. 10 Регулюючий асоційований білок ссавців-мішеней рапаміцину (RAPTOR) є важливим для складання мішені рапаміцину (mTOR) комплексу 1 у ссавців, і його функція може блокуватися рапаміцином. На відміну від цього, mTORC2, що містить нечутливий до рапаміцину супутник мішені рапаміцину (РІКТОР) у ссавців як білок для риштування, здається, нечутливий до короткочасного лікування рапаміцином. 11 mTORC1 інтегрує широкий спектр сигналів, включаючи фактори росту, амінокислоти, вміст клітинної енергії та стільниковий стрес, щоб регулювати клітинний ріст та поділ, а також біогенез ліпідів та мітохондрій. 12, 13 Широкий діапазон цілей фосфорилювання mTORC1 все ще не визначений повністю, але, схоже, змінюється в залежності від клітин. І навпаки, mTORC2, здається, активується інсуліном та супутніми шляхами і контролює кілька нижніх кіназ AGC, фосфорилюючи їх гідрофобний мотив. 14, 15 Таким чином, mTORC2 може відігравати важливу роль у виживанні клітин та організації цитоскелета.
Щоб дослідити ефект сигналізації, керованого mTOR, у функції PT, ми генерували індуцибельних умовних мишей Raptor, Rictor або Double Nockout у канальцевих ниркових клітинах уздовж нефрона.
Результати
Втрата mTOR в клітинах PT призводить до фанокоподібного фенотипу
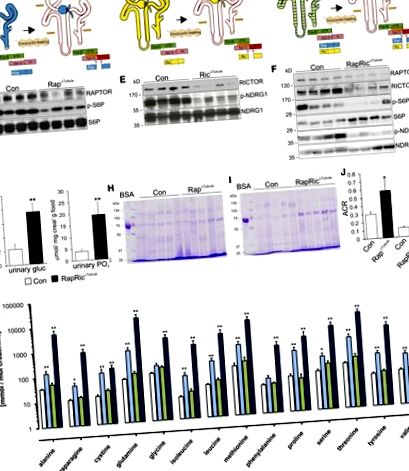
Порівняно з контрольними мишами тварини Rap Δ Tubule та RapRic Δ Tubule демонстрували значно більший прийом їжі та рідини, що було пов’язано із збільшенням об’єму сечі та виведенням натрію (Додаткова таблиця 1). Жодних змін не було виявлено у тварин Ric Δ Tubule. Разом ці дані свідчать про значний mTORC1-залежний дефект канальцевої реабсорбції глюкози, фосфатів, амінокислот, білків LMW та альбуміну.
mTOR регулює ендоцитоз PTC та внутрішньоклітинний обіг In Vivo
Втрата результатів mTOR у зміненій топології апікальної плазматичної мембрани зі зменшеною поверхнею реабсорбції In Vivo
Проводили аналізи світлової та електронної мікроскопії для кореляції зниженої функції ПТ із змінами в морфології. Періодичне фарбування кислотою – Шиффом на парафінових зрізах виявило зменшення мікроворсинок меж мембрани кисті (ВВМ) у всіх трансгенних мишей-нокаутів, що було найбільш очевидним у канальцях Rap Δ та Tubule RapRic у порівнянні з контрольними тваринами (рис. 3А). Однак загальна загальна морфологія залишалася незмінною, як показано на забруднених метиленовим синім напівтинових зрізах (Малюнок 3B). Аналіз субклітинної електронної мікроскопії сегментів PT S1 у мишей Rap Δ Tubule та RapRic Δ Tubule показав зменшену довжину мікроворсинок та утворення ендосомних пухирців у порівнянні з контрольними тваринами, а також зменшення кількості мітохондрій у тварин RapRic Δ Tubule (Рисунок 3C, Додаткова таблиця 2). Крім того, у мишей Rap Δ Tubule та RapRic Δ Tubule спостерігали значно завищені ранні та пізні ендосоми та цистерни Гольджі.
Делеція mTOR призводить до ультраструктурних змін у клітинах PT. (A) Періодичні зафарбовані за Шиффом ділянки контролю (Con), трубочки Rap Δ, трубочки Ric Δ та трубочки RapRic Δ, що демонструють зменшену довжину BBM у мутантів порівняно з контрольними мишами. (B) Семітинові зрізи, забарвлені метиленовим синім від Con, Rap Δ Tubule, Ric Δ Tubule та RapRic Δ Tubule, демонструючи інтактну морфологію епітеліальних клітин. (C) Електронна мікроскопія зображень Con, Rap Δ Tubule, Ric Δ Tubule та RapRic Δ Tubule, що показує зменшену кількість та довжину мікроворсинок BBM та зменшену кількість покритих клатрином пухирців, а також рециркуляцію ендосом у нормальних клітинних структурах у мутантів у порівнянні з контрольними тваринами. Зверніть увагу на збільшення ранніх та пізніх ендосом у мутантних клітинах порівняно з Con у C. Шкала шкали, 20 мкм та 2 мкм.
Знижений ендоцитоз спричинений зменшеним утворенням везикул, покритих клатрином
Протеомічний та фосфопротеомічний аналізи кори нирок виявляють сильну білкову мережу регуляторного білка, що залежить від mTOR -
Для подальшого з'ясування молекулярних причин спостережуваного зниження транспортної функції ПТ ми провели детальний протеомний та фосфопротеомічний аналіз кори нирок у трубочці Rap Δ та відповідних контрольних тварин. Незважаючи на те, що загальні відмінності між контрольними тваринами та тваринами з трубочками Rap Δ були досить тонкими (рис. 4А), кілька транспортерів амінокислот, такі як SLC6A19 (B 0 AT1), SLC7A7 (y + LAT1) та SLC3A2 (4F2hc), а також пов'язані з білками до полярності та ендоцитозу (наприклад, DOCK8, Bcl2-подібний 1 [BCL-xL], Ras-пов'язаний білок Rab-10 [RAB10] та сортувальний нексин 8 [SNX8]) були зменшені (рисунок 4B, Додаткова таблиця 3). Використовуючи модель мозаїчної експресії клітин, дефіцитних RAPTOR, у трубочці Rap Δ, ми могли б підтвердити за допомогою імуногістохімії знижену експресію B 0 AT1, y + LAT1, 4F2hc, DOCK8 та BCL-xL у клітинах із дефіцитом RAPTOR у порівнянні з клітини дикого типу (рис. 5, А – Е). Це було підтверджено аналізом Вестерн-блот із ізольованих мембран кортикальної нирки (рис. 5F), який підтвердив наші протеомічні висновки.
На відміну від цього, у декількох мішень mTORC2, особливо NDRG1, виявлено підвищений статус фосфорилювання (T328 та S342). Подібно аналізу збагачення генної онтології на рівні білка, трансмембранна транспортна активність, а також мембранні компоненти були найбільш суттєво регульовані (рис. 4G). Цікаво, що при інтеграції як протеомних, так і фосфопротеомічних наборів даних, стало очевидним, що зміни у фосфорилюванні не були простим наслідком зміни кількості білків (рис. 4Н). Нарешті, ми проаналізували фосфомотиви, які регулюються вгору або вниз. Нижче регульовані сайти фосфорилювання в основному містили мотив, спрямований на пролін ([S/T] –P), мотив, який відповідає фосфорилюванню mTOR, але також інші кінази, спрямовані на пролін (Малюнок 4I). 18 місць фосфорилювання, що містять мотив AGC кінази RxxS, було збільшено.
Обговорення
Хоча плейотропні функції mTOR кіназ останнім часом стали очевидними, про їхню складну роль у регулюванні транспорту білка епітелію та ендоцитозу відомо дуже мало. Цікаво, що набори даних реєстру після трансплантації нирок знизили рівень калію та фосфору в сироватці крові у пацієнтів, які отримували сиролімус, 19 - 21, вказуючи на регуляторну функцію mTOR для транспорту електролітів та гомеостазу. Використовуючи індуцибельні, генно-орієнтовані, специфічні порушення mTORC1, mTORC2 або обох комплексів mTOR в клітинах PT, тепер ми можемо з безпрецедентною деталізацією окреслити вплив сигналізації mTOR на фізіологію PT, транспорт білка та ендоцитоз (рис. 6). Насправді порушення сигналізації mTORC1 призводить до фанконіподібного синдрому, який проявляється фосфатурією, глюкозурією, аміноацидурією та протеїнурією НМГ. На молекулярному рівні як рідинно-фазова, так і опосередкована рецепторами ендоцитоз порушується і збігається зі зміною довжини ВВМ та утворенням пухирців у ПТ.
Путативна mTORC1-залежна регуляція проксимального канальцевого транспорту та ендоцитоз. (A) mTORC1, здається, регулює апікальний та базолатеральний транспортні білки PT. mTORC1 міг безпосередньо фосфорилювати SGLT2 та NBC1 для збільшення реабсорбції глюкози та натрію та виведення натрію та бікарбонату. mTORC1 може позитивно впливати на рівень експресії транспортера амінокислот B 0 AT1 та y + LAT-4F2hc та статус фосфорилювання b 0, + AT1-rBAT для реабсорбції відфільтрованих амінокислот та секреції їх у кров. (B) mTORC1 може регулювати ендоцитоз ПТ, біогенез мембрани, торгівлю везикулами та полярність клітин. mTORC1, ймовірно, контролює біогенез апікальної мембрани та полярність клітин, впливаючи на рівень експресії DOCK8, покриті апікальним клатрином ямки та утворення пухирців та ендоцитоз, впливаючи на рівні експресії BCL-xL, SNX8 та RAB10 та рівень фосфорилювання GBF-1. Крім того, він знову контролює належну функцію ендоплазматичного ретикулуму (ER) та цілісність Гольджі, впливаючи на експресію та рівень фосфорилювання RAB10 та GBF-1 відповідно.
mTOR регулює механізм ендоцитозу в епітеліальних клітинах PT
На додаток до порушення початкових стадій ендоцитозу, ми також спостерігали порушену торгівлю ендоцитами, на що вказує збільшена кількість ендоцитозованого альбуміну у тваринах Rap Δ Tubule та RapRic Δ Tubule. Крім того, протеомічний аналіз трубочки Rap Δ виявив підвищену внутрішньоклітинну кількість білків LMW, таких як ангіотензиноген, білок, що зв’язує ретинол, білок, що зв’язує вітамін D, і β2-мікроглобулін. Ці білки фізіологічно ендоцитуються клітинами PT і надалі обробляються для деградації або трансцитозу. 26 Внутрішньоклітинна торгівля є необхідною умовою обох процесів, і, отже, її порушення можуть призвести до внутрішньоклітинних накопичень, як це спостерігається на наших моделях тварин (Рисунок 2).
mTOR регулює специфічні апікальні трубчасті транспортні білки
На багатьох транспортерів ВВМ впливала делеція Raptor, що призводило до фанконіподібного синдрому. SGLT2 (SLC5A2) є основним апікальним транспортером глюкози в сегментах PT S1 та S2, з ексклюзивною локалізацією до BBM. 35 Діяльність транспортера рішуче регулюється фосфорилюванням. 36 Фосфопротеомія мишей Rap Δ Tubule вказувала на знижене фосфорилювання SGLT2 при S623 у порівнянні з контрольними тваринами. Цей залишок є високозберігаючим фосфозитом між видами, включаючи людський SGLT2 (S624). Показано, що посилене фосфорилювання в цьому місці посилює транспорт глюкози за рахунок збільшення вставки мембрани SGLT2. 36 Втрата mTORC1-індукованого фосфорилювання на S623 може, отже, сприяти глюкозурії у трубочках Rap Δ і Tubul RapRic.
Фосфопротеомічний аналіз кори нирок Rap Δ Tubule виявив значне зниження рівня фосфорилювання трьох місць фосфорилювання на SLC4A4 (NBC1). Повідомлялося, що інактивуючі мутації цього гена призводять до ниркового ПТ-ацидозу, ще однієї особливості, що часто спостерігається при синдромі Фанконі. 6 Чи впливають виявлені фосфозити на транспорт NBC1, потребує додаткового визначення на молекулярному рівні. 38, 39 Відповідно до інших звітів із використанням рапаміцину, незважаючи на подібну експресію основних переносників фосфатів PT (NaPi-IIa, NaPi-IIc та Pit-2), ми виявили фосфатурію у тварин канальців Rap Δ та RapRic Δ Tubule. 40, 41 Вплив mTORC1 на поки що невстановлені партнери по взаємодії може бути відповідальним за цю загадкову знахідку.
Таким чином, делеція mTORC1 призводить до генералізованої дисфункції ПТ, імітуючи клінічний діагноз синдрому Фанконі (рис. 6). Наш поглиблений аналіз виявляє ймовірні молекулярні шляхи, які зазнають впливу на орган. Крім того, ми визначили новий головний регулятор кінази функції ПТ, відкривши нові шляхи для подальших досліджень з розкриття кіназних мереж, що регулюють транспорт ПТ в галузі охорони здоров'я та хвороб.
Стислі методи
Тварини та лікування
Усі експерименти на тваринах проводились відповідно до керівництва Національного інституту охорони здоров’я щодо догляду та використання лабораторних тварин, а також німецького закону про добробут тварин, і вони були затверджені місцевими органами влади (G-13/07, M-9/11 та М-4/13). Мишей утримували у приміщенні SPF із вільним доступом до чау та води та 12-годинним денно-нічним циклом. Розведення та генотипування проводили за стандартними процедурами. Миші Raptorfl/fl та Rictorfl/fl були описані раніше 42 і були схрещені до тварин Pax8rtTA 43 та TetOCre 44. У віці 5 тижнів індуцибельні тварини та відповідні контролі (в яких відсутній TetOCre або Pax8rtTA) отримували гідрохлорид доксицикліну (Fagron, Barsbuettel, Німеччина) через питну воду (2 мг/мл із 5% захищеною від світла сахарозою) загалом 14 днів. Щоб оцінити ефективність рекомбінації та ідентифікувати клітинні мозаїцизми, ми схрестили штам миші-репортера mT/mG з деякими мишами Raptorfl/fl × Pax8rtTA × TetOCre (додатковий матеріал). 45
Презентація даних та статистичний аналіз
Кількісні дані представлені як середні значення ± SEM. Статистичне порівняння проводили за допомогою програмного забезпечення GraphPad Prism Software Package 6 (GraphPad Software, La Jolla, CA). Для статистичного порівняння використовували U-тест Манна – Уітні, двосторонній t-тест та, де це було доречно, ANOVA. Значення P Сміта HW: від риби до філософа, Бостон, Літтл, Браун, 1953 [Google Scholar]
- Нейтрацевтики надають харчові добавки, користь для здоров’я, енергію
- Основне живлення для всіх клітин організму - манекени
- Мавпи, що страждають ожирінням, втрачають вагу препарату, який атакує кровопостачання жирових клітин, Центр раку доктора медицини Андерсона
- Контроль поживних речовин перекладу мРНК Щорічний огляд харчування
- Композиція поживних речовин у воротах SF здорового харчування кешью