Мозкова регуляція апетиту та ситості
Анотація
Інтерес до контрольного годування збільшився внаслідок епідемії ожиріння та зростання захворюваності на метаболічні захворювання. Мозок виявляє зміни в запасах енергії та запускає метаболічні та поведінкові реакції, призначені для підтримки енергетичного балансу. Енергетичний гомеостаз контролюється головним чином нейрональними ланцюгами в гіпоталамусі та стовбурі мозку, тоді як аспекти винагороди та мотивації харчової поведінки контролюються нейронами в лімбічних областях та корі головного мозку. У цій статті наводиться інтегрований погляд на те, як метаболічні сигнали, що надходять із шлунково-кишкового тракту, жирової тканини та інших периферичних органів, спрямовують мозок на регулювання харчування, витрат енергії та гормонів. Знання цих складних шляхів має вирішальне значення для патогенезу та лікування ожиріння та порушень обміну глюкози та ліпідів.
Історична перспектива
Зв’язок кишечник-мозок
Нейронний зв’язок між кишечником та мозку досліджували за допомогою хірургічного та хімічного підходів [11]. Стимуляція шлункового шлунка або роздуття повітряних куль викликає насичення. Вливання розчинів, багатих жиром, вуглеводами та білками, в проксимальний відділ тонкої кишки зменшує обсяг подальшого прийому їжі. Цей ефект блокується нанесенням сенсорного нейротоксину капсацину на блукаючий засіб або хірургічною денервацією [11-13]. Хірургічне порушення сенсорних волокон блукаючого кишечника збільшує розмір і тривалість прийому їжі [12]. Блокада аферентної передачі блукаючого стовбура мозку за допомогою антагоніста рецептора N-метил-d-аспартату MK801 також збільшує розмір їжі [14]. Разом ці дослідження демонструють потужний контроль негативного зворотного зв'язку вагусної аферентної іннервації під час годування [11-13].
Шлунково-кишковий тракт виділяє гормони, які контролюють годування. Ці пептиди отримують доступ до мозку частково через область постреми, навколошлуночковий орган, розташований у даху 4-го шлуночка. Область постреми розташована над НТС, що дозволяє нейронам реагувати безпосередньо на циркулюючі гормони кишечника і передавати ці сигнали нейрональним ланцюгам в стовбурі мозку і передньому мозку.
Холецистокінін (CCK) був першим секретованим кишечником пептидом, який був визначений як фактор насичення [15]. CCK зменшує кількість їжі [15, 16]. Антагоністи рецепторів CCK1 блокують ефекти ситості вливань поживних речовин у кишечник та стимулюють годування у годуваних тварин [17]. Блукаючий нерв в кишечнику експресує рецептори CCK1 і стимулюється CCK. Хімічна чи хірургічна сенсорна ваготомія усувала ефекти насичення CCK у гризунів [12, 15, 16]. Порівняно з нежирними контрольними щурами Long-Evans Tokushima Otsuka (LETO), миші Otsuka Long-Evans Tokushima Fatty (OLETF), у яких відсутні функціональні рецептори CCK1, надмірно споживали дієту з високим вмістом жиру, що призвело до ожиріння та діабету [17]. Гіперфагія у цієї тварини була пов'язана з вищою експресією нейропептиду Y (NPY) у дорсомедіальному ядрі гіпоталамуса [17]. На відміну від цих результатів у щурів OLETF, дієта з високим вмістом жиру збільшила споживання їжі та спричинила ожиріння в однаковій мірі як у мишей, що нокаутували дикий тип, так і у рецепторів CCK1 [17, 18]. Більше того, на відміну від щурів OLETF, експресія гена NPY не збільшувалась у дорсомедіальному ядрі у мишей з дефіцитом рецептора CCK1 [17]. Таким чином, рецептори CCK1 по-різному впливають на споживання їжі та вагу у видів гризунів.
Глюкагоноподібний пептид (GLP) -1 відщеплюється від проглюкагону і виділяється з L-клітин кишечника у відповідь на прийом їжі [19]. Агоністи GLP-1 та рецепторів GLP-1 більш тривалої дії, такі як екзендін-4, зменшують споживання їжі гризунами, коли їх вводять у мозок або периферично [19, 20]. Імовірно, ці сполуки націлені на область постреми, НТС та ядро паравентрикулярного гіпоталамусу [19, 20]. GLP-1 має сильну інкретинову дію на секрецію інсуліну, тому міметичний ексенатид GLP-1 використовується як протидіабетичний засіб [19, 20]. Більше того, ексенатид викликає нудоту у деяких пацієнтів. Оскільки GLP-1 швидко інактивується дипептидилпептидазою (DPP) у циркуляції, розроблені інгібітори DPP-IV для продовження активності GLP-1 [19, 20]. В даний час ситагліптин використовується для лікування діабету. На відміну від ексенатиду, інгібування DPP-IV суттєво не впливає на споживання їжі та вагу. Оксинтомодулін також отримують з проглюкагону і спільно секретується з GLP-1 кишковими L-клітинами після прийому поживних речовин [19, 20]. Оксинтомодулін викликає ситість, збільшує витрати енергії та зменшує вагу [20].
Пептид YY (PYY) 3-36 є основною формою циркуляції PYY [20, 21]. PYY3−36 спільно секретується з GLP-1 та оксинтомодуліном. У ранніх дослідженнях повідомлялося, що PYY3−36 зменшує споживання їжі шляхом інгібування нейронів NPY/AGRP в дугоподібному ядрі гіпоталамусу через рецептори NPY-Y2 [21, 22]. Однак ефект ситості PYY-36 може бути мінімізований стресом і не підтверджений іншими [23, 24].
Амілін ко-секретується з інсуліном з β-клітин підшлункової залози і надає потужний протидіабетичний ефект [20]. Прамлінтид, аналог аміліну, покращує рівень глюкози в крові, а також зменшує апетит і вагу [20].
Грелін - це 28-амінокислотний пептид, що синтезується переважно в шлунку [25, 26]. Біоактивний пептид має бічну групу, пов’язану з О-октаноїлом, на 3-му сериновому залишку. Ця модифікація необхідна для впливу греліну на годування. Рівень греліну підвищується під час позбавлення їжі у тварин і до їжі у людей, і може служити критичним сигналом для викликання голоду під час посту. Периферичне або безпосереднє введення греліну в мозок стимулює харчування [26]. Вважається, що місцем дії греліну на годування є гіпоталамус, де рецептор секретагогу гормону росту, який опосередковує клітинну дію греліну, знаходиться у вентромедіальних та дугоподібних ядрах, зокрема нейронах, що експресують NPY та AGRP [25, 26]. Грелін індукує синаптичну пластичність середнього мозку, а також гіпокампу, де грелін був залучений до навчання [27, 28]. Окрім стимулювання споживання їжі та сприяння набору ваги, грелін бере участь у метаболізмі глюкози [29, 30]. Делеція греліну у мишей підвищувала базальний рівень інсуліну, посилювала глюкозо-стимульовану секрецію інсуліну та покращувала периферичну чутливість до інсуліну [29, 30]. Так само антагоністи рецепторів секретагогу гормону росту посилювали секрецію інсуліну у гризунів [31].
Пептиди, отримані з кишечника, є привабливими мішенями для посилення ситості та обмеження розміру їжі, але потенціал для розробки ліків загрожує труднощами. Гормони кишечника мають короткий період напіввиведення, тому необхідні стабільні аналоги, як це має місце для ексенатиду та інгібіторів DPP-IV [20]. Гормони кишечника, напр. GLP-1 та CCK можуть спричинити нудоту та інші побічні ефекти з боку шлунково-кишкового тракту, що може обмежити їх терапевтичне застосування. Крім того, через надлишкові нейронні та гормональні механізми в кишечнику сумнівно, що націлювання на обмежену кількість пептидів є життєздатним терапевтичним підходом. Дійсно, генетичні маніпуляції з анорексигенними гормонами кишечника рідко спричиняють явні зміни у харчуванні, вазі та обміні речовин [29, 30, 32]. Однак зміни гормонів кишечника можуть пояснити швидкі наслідки шунтування шлункового шлунку Roux-en-Y для зменшення ваги та зворотного діабету [33, 34]. GLP-1 підвищується після шлункового шунтування та може пригнічувати апетит та посилювати секрецію інсуліну [34]. Зараз робляться зусилля, спрямовані на грелін для лікування анорексії та кахексії. Антагоністи Греліну мають потенціал для ожиріння та лікування діабету.
Взаємодія лептин-мозок
Значення нейропептидів гіпоталамусу в енергетичному гомеостазі було встановлено за допомогою методів абляції генів у мишей [37-42]. Абляція NPY/AGRP в дугоподібному ядрі у дорослих викликала швидке голодування [37, 38]. Делеція рецептора MCH або MCH-1 призвела до надмірно худих мишей [39, 40]. З іншого боку, відсутність POMC або функціонального рецептора меланокортину-4 спричинило гіперфагію та ожиріння [41, 42].
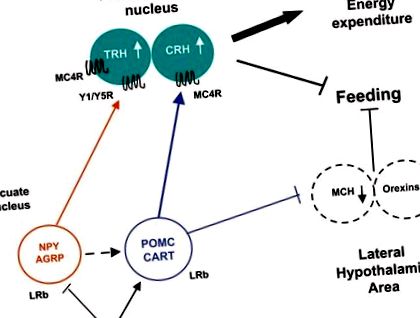
Лептин безпосередньо регулює дугоподібні нейрони гіпоталамусу, зв'язуючись з LRb, активуючи передачу сигналів JAK-STAT3 та регулюючи експресію нейропептидів (рис. 1). Падіння лептину під час голодування індукує гіперфагію та зменшує витрати енергії за рахунок збільшення NPY/AGRP та придушення α-MSH та КАРТИ [35, 36]. Знижений рівень лептину під час голодування також стимулює MCH та орексини в латеральній ділянці гіпоталамуса. І навпаки, підвищення рівня лептину в годівлі перешкоджає споживанню їжі, пригнічуючи NPY/AGRP і збільшуючи анорексигенні пептиди, наприклад α-MSH та CRH [35]. Подібно до голодування, дефіцит сигналізації лептину у мишей Lep ob/ob та мишей Lepr db/db спричиняє гіперфагію та порушення термогенезу, пов’язаний із збільшенням експресії NPY, AGRP та MCH та зниженням експресії POMC [35].
Передача сигналу гіпоталамічного лептину. Лептин інгібує NPY/AGRP і стимулює POMC/CART, що призводить до збільшення анорексигенного введення в паравентрикулярне ядро. Ці зміни в експресії нейропептидів завершуються насиченням, стимулюванням витрат енергії та втратою ваги.
Як і на інші складні захворювання, на ожиріння впливають полігенні фактори та фактори навколишнього середовища, особливо енергетична їжа та малорухливий спосіб життя. Люди з ожирінням, як правило, гіперлептинемічні, і невміння лептину запобігти збільшенню ваги призвело до припущення про «стійкість до лептину» [36]. Дієтичне ожиріння у гризунів характеризується підвищеним рівнем лептину, зниженим транспортом лептину через гематоенцефалічний бар’єр та порушенням сигналізації лептину в гіпоталамусі, пов’язаного з індукцією SOCS3 [35, 36]. Делеція SOCS3 у лептинових нейронах дугоподібного ядра посилює чутливість до лептину та захищає від ожиріння та діабету, спричиненого дієтою [43, 44].
Лептин чинить швидкий вплив на нейромедіацію [45]. Коли його застосовували до гіпоталамічних зрізів, лептин збільшував частоту потенціалу дії в анорексигенних нейронах POMC, деполяризуючи неспецифічний катіонний канал, зменшуючи інгібуючий тонус γ-аміномасляної кислоти (ГАМК), що виділяється з терміналів NPY в дугоподібному ядрі, та гіперполяризуючий Нейрони NPY [45]. Важливо, що лептин знижував частоту стрибків потенціалу дії у мишей дикого типу, що голодували, та мишей Lep ob/ob відповідно до його потужної анорексигенної дії [46]. Гіперфагічний фенотип мишей Lep ob/ob характеризується збільшенням співвідношення збудливих: гальмівних синапсів у гіпоталамусі [47]. Ця картина швидко була змінена шляхом лікування лептином протягом 6 годин, що припускає, що опосередкована лептином синаптична пластичність передувала ефекту пригнічення апетиту гормону [47]. На відміну від лептину, стимулюючий ефект греліну на споживання їжі був пов'язаний із чистим збільшенням синаптичної активності в гіпоталамусі [27]. Ці результати вказують на те, що периферичні метаболічні гормони можуть змінювати функції мозку завдяки модуляції синаптичної функції [27, 47].
Останні дослідження зосереджували увагу на дії лептину в мозку людини [48-50]. Розенбаум та ін. продемонстрував специфічні залежно від лептину зміни мозкової активності у відповідь на візуальні харчові подразники у пацієнтів із ожирінням, які зазнали зниження ваги [48]. Відновлення рівня лептину підтримувало зниження ваги, а також нормалізувало схему мозкової діяльності [48]. Вроджений дефіцит лептину пов’язаний зі зниженням мозкової активності в регіонах, пов’язаних з голодом, та підвищенням мозкової активності в регіонах, пов’язаних із насиченням [49, 50].
Інші периферичні фактори, що контролюють харчування та метаболізм
Перехресне спілкування між сигналами інсуліну та лептину в гіпоталамусі. Інсулін інгібує NPY/AGRP та індукує POMC/CART через активацію IRS та PI3 кінази. Лептин активує JAK2, який взаємодіє з інсуліном через IRS.
Ендоканабіноїдна система має значний вплив на апетит та метаболізм [57]. Ендоканабіноїди зв'язуються з каннабіноїдними рецепторами типу 1 і типу 2 (рецептори CB1 і CB2). Рецептор CB1, рецептор, пов'язаний з G-білком, широко експресується в мозку та периферичних тканинах і, як вважають, опосередковує метаболічні дії ендоканабіноїдів. Надмірне харчування активізує ендоканнабоїдну систему, що призводить до гіперфегії, зменшення витрат енергії та ожиріння [57]. Активація ендоканабіноїдної системи може сприяти розвитку «метаболічного синдрому», що характеризується абдомінальним ожирінням, резистентністю до інсуліну, діабетом 2 типу та підвищеним ризиком серцево-судинних захворювань. Стимуляція рецептора CB1 анандамідом збільшує споживання їжі та вагу гризунів. І навпаки, антагоністи рецепторів CB1 пригнічують годування та зменшують вагу [57]. Римонабант, блокатор рецепторів CB1, пригнічує апетит і зменшує вагу у пацієнтів із ожирінням [58]. Крім того, римонабант знижує рівень глюкози та ліпідів [58].
Надлишок глюкокортикоїдів збільшує годування, вагу та жир [67]. При введенні в мозок глюкокортикоїди надають дозвільну дію на транскрипцію NPY у гіпоталамусі, а також модулюють рівень моноамінів у мезолімбічних шляхах винагороди, щоб збільшити споживання смачної їжі [67]. Навпаки, адреналектомія зменшує споживання їжі та вагу, навіть при найважчій формі ожиріння внаслідок дефіциту лептину [68]. Статеві стероїди глибоко впливають на апетит. Лікування периферичного естрогену посилювало анорексигенну дію лептину та інсуліну у самки щурів, а також інтактних самців [69]. Введення естрадіолу безпосередньо в мозок самок щурів підвищувало чутливість до центрального лептину, одночасно знижуючи чутливість до інсуліну [69]. Естрадіол діяв у мозку, збільшуючи підшкірний жир [69]. Вплив естрадіолу на апетит та ожиріння відбувається за допомогою рецепторів естрогену (ER) -α (70).
Циліарний нейротрофічний фактор (CNTF) викликає втрату ваги. У гризунів CNTF пригнічує споживання їжі та збільшує витрати енергії, частково завдяки придушенню NPY [71]. Однак наслідки ситості та проти ожиріння CNTF зберігаються і після припинення лікування [71]. Не виключено, що CNTF змінює “задану точку” енергетичного балансу через довгострокові зміни синаптичної функції [71]. CNTF також індукує проліферацію клітин у мишачому гіпоталамусі, і декілька новоутворених клітин здатні реагувати на лептин [72]. Таким чином, індукований CNTF нейрогенез може впливати на поведінку годування [72]. Прозапальні цитокіни, такі як фактор некрозу пухлини (TNF) α та інтерлейкін (IL) -6, беруть участь у патогенезі кахексії, пов’язаної з раком та інфекціями. Ці цитокіни інгібують годування та індукують термогенез, частково модулюючи експресію гіпоталамічних нейромедіаторів [73, 74].
Гедонічні механізми, що регулюють апетит і ситість
Харчування забезпечує енергетичні субстрати для метаболізму, тому логічно, що харчова поведінка підлягає гомеостатичному контролю, описаному в попередніх розділах. Однак апетит також зумовлений факторами, що перевищують фізіологічні потреби. Їжа забезпечує потужні зорові, запашні та смакові сигнали, які можуть перекрити ситість та стимулювати годування. Ми, як правило, переїдаємо солодку та солону їжу і споживаємо менше їжі, яка є гіркою або кислою. Смак і запах їжі може глибоко змінити поведінку, так що смачна їжа шукається, тоді як неприємна їжа викликає огиду. Різноманітні смакові рецептори, включаючи класичні солодкі, солоні, кислі, гіркі смаки, виражаються смаковими клітинами в язиці та порожнині рота, які передають інформацію до NTS та парабрахіального ядра в стовбурі мозку. Потім відчуття смаку передається на таламус і бічну лобову кору головного мозку, центральне ядро мигдалини та бічну область гіпоталамуса. Нейропептиди, причетні до передачі смаку, включають речовину Р, холецистокінін (CCK) та опіоїди. Лептин здатний модулювати сприйняття смаку, про що свідчить посилена реакція на солодкий смак у мишей, у яких бракує лептину [75]. І навпаки, лікування лептином знижувало сигналізацію солодкого смаку у мишей Lep ob/ob [75].
Психотропні засоби впливають на годування та вагу [76]. Дослідження на тваринах показали, що винагороди за ліки та їжу мають подібні нейронні шляхи. Наприклад, здатність AGRP збільшувати годування блокується налоксоном, антагоністом опіоїдів [77]. Дефіцит енкефаліну або β-ендорфіну знижує мотивацію поведінки при натисканні на бар, щоб полегшити нагороду за їжу [78]. Ін’єкція μ та κ-антагоніста опіоїдів у ядро акумбенів пригнічує живлення [76]. Агоніст серотоніну (рецептора 5-НТ2С) інгібує вживання їжі частково, активуючи рецептори меланокортину 4 [79]. У мишей лептин пригнічує мотивацію годування, активуючи нейрони, що експресують допамін та ГАМК, у мезолімбічному шляху [80, 81]. Подібна дія спостерігалась у пацієнтів із вродженою недостатністю лептину, внаслідок чого активність мозку у вентральній смугастості посилювалась, і це було пов'язано зі збільшенням потягу до їжі, навіть коли пацієнти щойно їли [50]. Лікування лептином змінило "гедоністичну картину" мозкової діяльності [50].
Висновок
Харчова поведінка є критично важливою для придбання енергетичних субстратів. Як обговорювалось у цьому огляді, вісь кишечник-мозок контролює апетит та ситість за допомогою нейрональних та гормональних сигналів. Надходження поживних речовин у тонкий кишечник стимулює вивільнення пептидів, які діють як негативні сигнали зворотного зв’язку для зменшення розміру їжі та припинення годування. Гормони та цитокіни, що виділяються периферичними органами, довгостроково впливають на енергетичний баланс, контролюючи харчування та витрати енергії. Нейрони, що беруть участь в гомеостатичній регуляції харчування, знаходяться в основному в гіпоталамусі і стовбурі мозку. Крім того, нейронні ланцюги в лімбічній системі опосередковують мотиваційний та винагородний аспекти годування. Поняття про те, як периферійні метаболічні сигнали взаємодіють з мозку, буде отримано за допомогою візуалізації мозку та метаболічних досліджень у людей, а також доклінічних експериментів на моделях тварин, що використовують молекулярні, генетичні, фізіологічні та поведінкові інструменти. Знання нейробіологічних основ харчування сприятиме розумінню та раціональному лікуванню порушень енергетичного гомеостазу, таких як ожиріння та кахексія.
Подяка
Виноски
Заява видавця: Це PDF-файл нередагованого рукопису, який прийнято до друку. Як послуга для наших клієнтів ми надаємо цю ранню версію рукопису. Рукопис пройде копіювання, набір версій та перегляд отриманого доказу, перш ніж він буде опублікований у остаточній формі. Зверніть увагу, що під час виробничого процесу можуть бути виявлені помилки, які можуть вплинути на вміст, і всі юридичні застереження, що стосуються журналу, стосуються.
- 4 Продукти, що стимулюють мозок для роздумів
- 4 їжі для мозку для батьків дітей
- Калорійність щільної їжі для зниженого апетиту; Вижили; Таблиця
- 5 секретів ситості та схуднення - омолоджуючий спосіб життя
- 5 речей, які можуть спричинити втрату апетиту у собак CANIDAE®