Модель діатезу – епілепсії: як минулі події впливають на розвиток епілепсії та супутніх захворювань
Анотація
При епілепсії судоми та супутні захворювання (наприклад, когнітивні дефіцити та депресія) виникають, коли певні пороги перевищені. Ці пороги залежать від діатезу (або вразливості) даної людини. Діатез контролюється багатьма генетичними та екологічними факторами. Діатез змінюється протягом декількох масштабів: щодня та як частина процесів розвитку/старіння тощо. Введена тут модель діатезу та епілепсії забезпечує концептуальну базу для розуміння того, як минулі події (наприклад, дуже стресова подія) можуть безпосередньо впливати виникнення епілепсії та супутніх захворювань у подальшому житті. Експериментальні дані підтверджують цю модель, і існування біомаркерів, що передбачають стан вразливості, призвело до розробки профілактичних терапевтичних стратегій. Епігенетичні модифікації можуть стати ключовим фактором, що визначає діатез. Обговорюється їх роль.
Напад - це вид діяльності, який є ендогенним для більшості нейрональних мереж мозку. Все, що потрібно - це достатньо жорсткий поштовх до мережі. Наприклад, електросудомний шок спровокує напад у будь-якому «нормальному» мозку людини (Luttges and McGaugh 1967). Незалежно від того, чи відбувається це примусово в “нормальній” тканині, чи спонтанно відбувається в хронічних “епілептичних” мережах, динаміка судом з вогнищевим початком, як видається, відповідає універсальним правилам у всіх регіонах мозку та у різних видах (Jirsa et al. 2014) Зокрема, напади трапляються, коли мозкова діяльність переходить певний поріг (Jirsa et al. 2014). У “нормальній” тканині поріг високий, і напади важче викликати, ніж при хронічній епілепсії (Bankstahl et al., 2013). Таким чином, можна припустити, що поріг знижений при епілепсії (тобто ймовірність нападу збільшується у пацієнтів з епілепсією порівняно із загальною популяцією).
Тоді питання, яке ми повинні вирішити, полягає в наступному: Що визначає поріг у даного індивіда? Багато епілепсій можна простежити до оригінальної інсульту мозку, наприклад, генетичної мутації, стресу на початку життя, травми мозку, менінгіту тощо (Goldberg and Coulter 2013) Ця мозкова оскорблення спричинить зміни в схемі, що в кінцевому підсумку може знизити поріг та уможливити виникнення спонтанних судом. Відстеження механізмів, що лежать в основі модифікації порогу, є дуже складним завданням, оскільки епілепсія є багатофакторною, в тому сенсі, що дана образа не призведе до подібного результату у двох осіб. Найкращі приклади можна знайти в генетиці людини. Мутації сімейних форм епілепсії характеризуються неповною пенетрантністю та різними формами епілепсії у членів сім'ї, що мають однакову мутацію (Depienne et al. 2010; Scheffer 2011). Подібним чином, мозкові озлоблення, такі як черепно-мозкова травма або фебрильні судоми, лише збільшують ймовірність розвитку епілепсії в подальшому житті (тобто не у всіх постраждалих осіб розвиваються спонтанні напади) (Bolkvadze and Pitkanen 2012; Choy et al. 2014).
Важливо, що якщо внаслідок інсульту мозку можна знизити поріг судом, поріг також можна збільшити. Доказ концепції того, що порогом можна генетично маніпулювати, був наданий в експериментальних моделях раптової смерті при епілепсії (SUDEP) (Aiba 2015). У цих моделях хвиля поширення деполяризації (SD) в стовбурі мозку призводить до смерті. SD також є видом діяльності, який є ендогенним для більшості мозкових мереж, і він характеризується пороговим значенням (El Houssaini et al. 2015). Цей поріг можна підвищити за допомогою відповідної генетичної маніпуляції, таким чином збільшуючи тривалість життя моделей SUDEP (Aiba 2015), додатково розкриваючи полігенну природу епілепсії та її наслідки.
Попередні міркування стосуються успадкованих мутацій. Щоб зробити речі більш складними, соматичні мутації можуть виникати під час ембріонального розвитку (Подурі та ін., 2013), впливаючи на конкретні популяції нейронів у конкретних областях мозку. Ці мутації можуть бути пропущені загальними генетичними аналізами. У цьому випадку також соматичні мутації можуть призвести до патологічного стану або врівноважити спадкову мутацію. Соматичні мутації можуть не бути епіфеноменом, оскільки вважається, що вони поширені під час поділу клітин, хоча їх функціональний результат невідомий (Frumkin et al. 2005; Lynch 2010).
Ці дослідження безпосередньо показують, що генетичний фон може безпосередньо впливати на поріг патологічної діяльності. Іншим головним визначальним фактором є середовище, яке включає минулу історію людини. Дослідження асоціації/ретроспективи свідчать про те, що кілька факторів ризику збільшують ймовірність розвитку епілепсії. Наприклад, епізод депресії на початку життя може сприяти розвитку епілепсії (Hoppe and Elger 2011; Hesdorffer et al. 2012). Отже, минулий досвід людей може підштовхнути їх до розвитку епілепсії (Hoppe and Elger 2011; Hesdorffer et al. 2012). Цю проблему дуже важко дослідити клінічно та експериментально, оскільки минулі події можуть залишити слід у системі, не викликаючи очевидного фенотипу. Однак це параметр, який так само важливо враховувати, як і генетичне тло.
Який слід можуть залишити нейронні мережі внаслідок екологічних подій? Очевидні кандидати включають загибель клітин, хронічне запалення або окислювальний стрес, які можна порівняно легко ідентифікувати. Більш тонка зміна, але більш різка з точки зору функціональних наслідків, може бути здійснена епігенетичним перепрограмуванням. Широко кажучи, епігенетика відноситься до різних способів динамічно регулювати експресію генів, торкаючись ДНК-коду.
Стрес є найбільш вивченою подією у зв'язку з патологіями (McEwen 2013). Минулі стресові події можуть змінити епігенетичний ландшафт, викликаючи, таким чином, функціональну реорганізацію мереж (Klengel and Binder 2015). Існує також велика кількість літератури, що пов’язує стрес, епілепсію та депресію. Але тут основна увага буде приділятися впливу стресових подій минулого до епілептогенезу на подальший розвиток епілепсії та супутніх захворювань (Koutsogiannopoulos et al. 2009; Lanteaume et al. 2009), а також ролі можливого епігенетичного перепрограмування.
ВПЛИВ МИНУЛИХ СТРЕСНИХ ПОДІЙ: МОДЕЛЬ ДІАТЕЗ – ЕПІЛЕПСІЯ
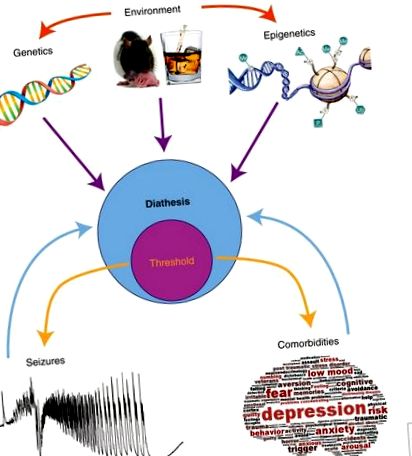
Модель діатезу – епілепсії. Діатез - це вразливість людини до судом та супутніх захворювань (наприклад, депресії та когнітивних дефіцитів). Вразливість до епілепсії та супутніх захворювань не обов'язково передбачає подібні механізми, хоча ймовірна перехресна розмова. Судоми та супутні захворювання виникають при перетині певного порогу (поріг є частиною діатезу, оскільки він визначається ним). Чисельні фактори контролюють діатез: наш генетичний фон, фактори навколишнього середовища та епігенетичні модифікації. Фактори навколишнього середовища можуть змінити наш генетичний фон (наприклад, мутації) та наш епігенетичний ландшафт (наприклад, турбота матері, вплив психоактивних речовин). Епігенетика охоплює різні способи зміни експресії генів (наприклад, зміна коду хвостів гістонів, стан метилювання ДНК тощо). Епігенетичні модифікації відбуваються природним чином протягом нічного/денного циклу, старіння тощо, але також і внаслідок екологічних проблем (наприклад, сильного стресу). Зниження порогів збільшить ймовірність виникнення судом та супутніх захворювань. Як тільки останні трапляються, вони можуть негативно відгукуватися про діатез, ще більше збільшуючи вразливість.
ТЕСТУВАННЯ МОДЕЛІ ДІАТЕЗ – ЕПІЛЕПСІЯ
Використовуючи подібну експериментальну процедуру, стало можливим перевірити модель діатезу – епілепсії (Becker et al. 2015). Щури, які зазнали соціальної поразки, розділилися на дві групи тварин, вразливих і невразливих, на основі рівня сироваткового вмісту BDNF. Вразливі тварини мали нижчий поріг для досягнення епілептичного статусу і мали значно прискорений епілептогенез порівняно з невразливими тваринами. Отже, минула, невирішена історія стресу змінила діатез у деяких тварин, зробивши їх більш сприйнятливими до розвитку епілепсії.
Просуваючись далі, оцінювали наявність когнітивних дефіцитів та депресії у тварин із спонтанними судомами (Becker et al. 2015). Депресивноподібний профіль та важкий когнітивний дефіцит були виявлені лише у вразливих верств населення (з низьким рівнем BDNF у сироватці після першого попадання). Важливо те, що тварини, що зазнали впливу лише епілептичного статусу, не виявляли ні депресії, ні когнітивних дефіцитів колись епілептичні. Це показує, що в цих експериментальних умовах мозкова інсульт, що викликає епілептогенез (епілептичний статус), виступав як викривач супутніх захворювань у вразливій популяції.
Нарешті, стан вразливості до депресії можна змінити за допомогою міметика BDNF (Becker et al. 2015). Отже, тут також порогом можна маніпулювати в іншому напрямку, щоб повернутися до “нормального” рівня діатезу. Однак лікування не нормалізувало прогресування епілептогенезу, припускаючи, що біологічні процеси, що контролюють вразливість до депресії та вразливість до епілепсії, не є однаковими (Becker et al. 2015).
Таким чином, модель діатезу та епілепсії забезпечує корисну концептуальну основу для розуміння того, чому епілепсія та супутні супутні захворювання розвиваються лише у деяких людей (хоча це одна з можливостей серед багатьох інших). У такій моделі поріг судом та супутніх захворювань може бути включений у діатез (рис. 1). Виявлення потенційних біомаркерів вразливості (BDNF та ЕЕГ у сироватці крові) робить можливими перспективні дослідження на людях. Як ми можемо пояснити таку вразливість? Як уже згадувалося раніше, все зводиться до генетики X факторів навколишнього середовища (в їх широкому розумінні). Епігенетика становить корисний зв'язок між генетикою та навколишнім середовищем.
ЕПІГЕНЕТИКА ЯК КЛЮЧОВИЙ ФІЗІОЛОГІЧНИЙ ПРОЦЕС
Тут використовується визначення, що використовується Національним інститутом охорони здоров’я (NIH) для Проекту епігеноміки «Дорожньої карти»: «Для цілей цієї програми епігенетика стосується як спадкових змін генної активності та експресії (у нащадках клітин або особин), так і також стабільні, довгострокові зміни транскрипційного потенціалу клітини, які не обов'язково успадковуються »(див. www.roadmapepigenomics.org/overview). В основному, епігенетика може включати все, що може регулювати експресію генів незалежно від генних послідовностей (тобто метилювання ДНК, модифікація гістону та мікро/довгі некодуючі РНК) (Kobow and Blumcke 2014). У разі модифікації гістонів (як приклад) існує безліч ферментів, які можуть переносити ацетильні групи, метильні групи або фосфор (серед інших) до хвостів гістону, що впливає на транскрипцію генів (рис. 1). На додаток до цих "пишучих" молекул, існують "гумки", які видаляють ці сигнали з хвостів гістонів, і, звичайно, є "зчитувачі", які повідомляють про код, залишений на гістонах (Borrelli et al. 2008). Отже, існує безліч ферментів, які можуть змінювати епігенетичний ландшафт і впливати на спосіб експресії генів чи ні.
ЕПІГЕНЕТИКА В ЕПІЛЕПСІЇ ТА КОМОРБІДИТИ
У попередньому розділі епігенетика розглядається як явище, яке впливає на всі моменти нашого життя, як частина звичайного програмованого процесу, що залежить від часу. Але фактори навколишнього середовища також можуть залишити глибокий епігенетичний слід, впливаючи на спосіб експресії генів. Деякі з них також є частиною нашого повсякденного життя, оскільки певні процеси пам’яті та навчання залежать від епігенетичних механізмів (Graff and Tsai 2013). Але деякі фактори навколишнього середовища можуть також мати згубні наслідки через епігенетичне перепрограмування. Це було добре встановлено під час розробки (Бейл 2015). Наприклад, материнський догляд (лизання/догляд) відіграє ключову роль у визначенні чутливості до стресу за допомогою епігенетичного механізму, який залишається стабільним після досягнення щенятами дорослого віку, але який можна скасувати за допомогою препаратів, що модифікують хроматин (Szyf 2009a, b ).
Епігенетика - відносно нове, але швидко розростається поле в епілепсії. Вже виявлено багато епігенетичних модифікацій (Kobow and Blumcke 2014). Але їх інтерпретація є складним завданням, оскільки зміна експресії генів і білків за допомогою епігенетики різко збільшить кількість можливостей для побудови функціональних та дисфункціональних клітин та мереж. Крім того, немає чіткого розділення між генетикою та епігенетикою, оскільки мутації, пов'язані з появою епілепсії, можуть включати прямі/непрямі епігенетичні фактори (наприклад, ARX та MeCP2) (Amir et al. 1999; Poeta et al. 2013; Kobow and Блумке 2014). Отже, епігенетичні механізми можуть бути центральними у певних формах спадкових епілепсій або патологій, пов'язаних з епілепсією.
У набутих формах епілепсії епігенетика також може відігравати ключову роль. Мозкова інсульт, що викликає епілептогенез (наприклад, епілептичний статус або черепно-мозкова травма), може змінити епігенетичний ландшафт, змінити діатез і знизити поріг судом (рис. 2). Численні гени регулюються вгору або вниз після інсульту мозку та в хронічних епілептогенних регіонах (Becker et al. 2002; Gorter et al. 2006). Епігенетичні механізми можуть лежати в основі таких змін у експресії генів (Qureshi and Mehler 2010). Одним із типових прикладів є BDNF, який регулюється при епілепсії за рахунок зменшення метилювання ДНК Bdnf (Ryley Parrish et al., 2013). У такому контексті широких модифікацій на рівні епігенома не дивно знайти серед антиепілептичних препаратів засоби, що модифікують хроматин. Наприклад, вальпроєва кислота має декілька способів дії, включаючи свою дію як інгібітор гістонової деацетилази (Monti et al. 2009).
Нарешті, щоб зробити речі ще більш складними, епілепсія характеризується модифікаціями, що залежать від часу після початкової інсульту мозку (включаючи спадкові мутації), що призвело до епілепсії. Деякі епігенетичні механізми, виявлені протягом певного періоду часу, можуть бути недійсними в інші моменти часу. Одним із ключових аспектів епігенетики є її динамічна природа, яка природно відбувається від розвитку мозку до старіння (рис. 2).
ЕПІГЕНЕТИКА ТА МОДЕЛЬ ДІАТЕЗУ – ЕПІЛЕПСІЯ
Епігенетика дає корисну основу для вивчення впливу минулих подій на розвиток епілепсії та її супутніх захворювань. Минулі події (наприклад, стресові ситуації [Becker et al. 2015] та вплив психоактивних препаратів під час розробки [Silva et al. 2013]), можливо, залишили епігенетичний слід, недостатній для того, щоб виробити фенотип сам по собі, але посилюючи діатез, роблячи цих осіб більш вразливими (фактично наближаючи їх до порогу). Таким чином, поява інсульту мозку буде діяти як пусковий механізм та сприятиме розвитку епілепсії та/або супутніх захворювань. Ймовірно, що діатез постійно змінюється в обидві сторони як функція різних позитивних/негативних життєвих подій (рис. 2). Але діатез залишається ключовим фактором, що визначає розвиток епілепсії та супутніх захворювань, які трапляються у деяких людей, а не у інших як функція їх генетичного фону та епігеномного ландшафту у будь-який момент часу.
Мабуть, найкращою, хоч і спекулятивною, ілюстрацією цієї концепції (та її складності) є той факт, що напади демонструють циркадний малюнок у мезіальних ТЛЕ та експериментальних моделях (Quigg et al. 1998). Оскільки поріг судом також регулюється циркадним способом, залежним від BMAL1 (Gerstner et al. 2014), можна запропонувати, як робочу гіпотезу, нормальні епігенетично-циркадні механізми на додаток до модифікацій, спричинених минулим життєвим досвідом та проепілептогенні мозкові вбивства, наближають нейронні мережі до порогу судом у певні моменти часу протягом нічного та денного циклу. Таким чином, діатез, швидше за все, регулюється в декількох часових масштабах (рис. 2).
ЗАКЛЮЧНІ ЗАУВАЖЕННЯ
Наш генетичний фон є ключовим фактором, що визначає нашу вразливість до епілепсії та супутніх захворювань. Таке тло можна “тонко налаштувати” за допомогою епігенетичних механізмів. Останні є фізіологічними процесами, які змінюють білковий ландшафт протягом декількох періодів часу (від годин до десятиліть), таким чином постійно змінюючи наш діатез і поріг на епілепсію та супутні захворювання. Фактори навколишнього середовища також можуть динамічно модулювати наш діатез, не обов'язково впливаючи на поріг (тобто вони діяли б як основні фактори). Для впливу на поріг можуть знадобитися інші звернення. Важливо зазначити, що порогові значення епілепсії та супутніх захворювань можуть бути різними, включаючи різні основні механізми, хоча очікується певне перетинання. Звичайно, судоми та супутні захворювання можуть повернутися до діатезу та порогу (як правило, додатково збільшуючи вразливість). Важливо також зазначити, що діатез також може бути зменшений (природно з позитивним життєвим досвідом або фармакологічно). На закінчення, напади та супутні захворювання виникають у постійно мінливому (динамічному) нервовому середовищі, критично залежно від минулого досвіду, що слід враховувати, щоб зрозуміти їх походження та спланувати майбутні терапевтичні стратегії.
ПОДЯКИ
Автор вдячний INSERM та Сьомій рамковій програмі Європейського Союзу (FP7/2007-2013) згідно з Грантовою угодою № 602102 (EPITARGET) та доктору П. П. Кілічіні за допомогу в рукописі та малюнках.
- Перевірка достовірності продуктів з «низькокалорійною їжею» за допомогою моделі рептилій
- Текстурна ефективність зшитих інгредієнтів молочного білка зі зниженим вмістом кальцію
- Вплив втрати ваги, спричиненого дієтою, на біомаркери для раку прямої кишки Дослідницьке дослідження
- Вплив ожиріння у дітей на зростаючі суглоби - ортопедія Тукахо
- Вплив кофеїну на настрій, когнітивні функції, працездатність та зволоження огляд переваг