Метаболізм і пам’ять: ожиріння, діабет та деменція
Коли Мішель Обама запустила свою програму «Рухаймось!» Кампанія проти ожиріння серед дітей у 2010 році, вона опинилася на підставі даних, які показують, що 36% дорослих США та 17% дітей та підлітків США страждають ожирінням (1). Супутні ризики для здоров’я, окреслені командою пані Обами, відображають консенсус Центрів з контролю та профілактики захворювань, який підкреслює безліч несприятливих наслідків - від раку до артриту до ішемічної хвороби серця. Серед цих повідомлень про громадське здоров’я нервово-психічні наслідки ожиріння в основному зосереджені на захворюваннях судин головного мозку, таких як інсульт, та психологічних наслідках стигми. Однак широкомасштабні дослідження, що показують зв'язок між ожирінням, діабетом та деменцією, вказують на те, що мозок страждає ширше (2,3).
Зв'язок деменції з ожирінням та діабетом є частиною історії, що розвивається, що змушує нас переглядати давню концептуалізацію розуму та тіла як окремих. Коли Рене Декарт знаменито писав про дуалізм розум і тіло в 17 столітті, він переформулював ідеї, що були для нього давніми. Зараз зрозуміло, що пізнання, афект, пам’ять та інші психічні процеси є проявами функції мозку. Незважаючи на те, що сучасна нейронаука значною мірою ліквідувала дихотомію Декарта, дуалізм мозок-тіло продовжує існувати, про що свідчать фактично окремі системи охорони здоров'я, присвячені психічному та фізичному здоров'ю.
Це має важливе значення для нашого підходу до, здавалося б, розрізнених, важко піддається лікуванню фізичних та психічних розладів. Взаємозв'язок між діабетом та деменцією є прекрасним прикладом. Застосування духу дуалізму мозок-тіло до цієї проблеми свідчить про те, що боротьба з ожирінням та діабетом залежить від лікарів-інтерністів та ендокринологів, тоді як психіатри та неврологи мають справу з нейрокогнітивними розладами. Однак наукове розуміння цих розладів свідчить про те, що руйнування цих елеваторів може призвести до важливих патологічних та терапевтичних відкриттів.
Отже, як ожиріння або діабет сприяють 50% -ному збільшенню ризику деменції? Який зв’язок між вагою, метаболізмом та здоров’ям мозку? Ключовою ланкою може бути вплив запалення та окисного стресу на мозок. Десятиліття досліджень широкого кола захворювань, включаючи рак та серцеві захворювання, продемонстрували, що запалення та окислювальний стрес відіграють головну роль у патології людини. Багато тих самих процесів, які впливають на коронарні артерії та вісцеральні органи, також впливають на мозок. Запалення призводить до активації мікроглії та астроцитів. Це спричиняє вивільнення цитокінів та реактивних окисників, що в кінцевому підсумку призводить до дисфункції нейронів або смерті. Критично важливо, що цей процес може розв’язати порочний кругообіг: відмираючі нейрони можуть спричинити більше запалення, створюючи тим самим каскад нейродегенерації (4).
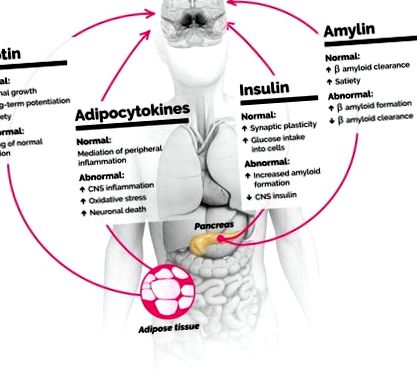
Як діабет, так і ожиріння системно посилюють запалення. Донедавна вважалося, що гематоенцефалічний бар’єр (ВГБ) захищає мозок від таких системних ефектів. Зараз ми знаємо, що запалення ожиріння/цукрового діабету на мозок суттєво впливає кількома шляхами. По-перше, багато системних медіаторів запалення - наприклад, цитокіни - насправді перетинають ВВВ за певних умов. По-друге, метаболічні медіатори, що виділяються жировою тканиною та підшлунковою залозою - лептин, інсулін та амілін - відіграють додаткову важливу роль у опосередкуванні запалення центральної нервової системи (ЦНС) та регулюванні здоров’я нейронів. Розбір деяких деталей того, що саме відбувається з мозком при цукровому діабеті та ожирінні (рис. 1), може забезпечити нові цілі для лікування деменції.
Медіатори метаболізму та запалення, що виділяються жировою тканиною та підшлунковою залозою, впливають на мозок як на здоров’я, так і на захворювання. Діабет та ожиріння можуть сприяти деменції через ці медіатори. ЦНС, центральна нервова система.
Хоча нас часто вважають інертними, ми тепер усвідомлюємо, що сам жир може зіграти важливу роль у регулюванні когнітивного здоров’я. Жирова тканина виконує ряд нейроендокринних функцій. Однією з найважливіших функцій є вироблення та вивільнення масиву поліпептидів, що називаються адипокінами. Вони мають широкий спектр ефектів, починаючи від модуляції метаболізму (через лептин), опосередковуючи згортання крові (за допомогою інгібіторів активації плазміногену) та регулюючи запальний шлях (включаючи інтерлейкіни та фактори некрозу пухлини) (5). У здорових людей із метаболічним процесом секреція адипокіну пристосована до фізіологічних потреб. Однак при ожирінні середовище адипокінів переходить у стан, який іноді називають адипосопатією, при якому запальні цитокіни, такі як інтерлейкін-6, секретуються на більш високих рівнях, а метаболічні медіатори, такі як лептин, перестають нормально функціонувати.
Дослідження показують, що патологічні зміни адипосопатії мають значний вплив на мозок. Периферичне запалення порушує ВВВ і може перешкоджати синаптичній пластичності та нейрогенезу в гіпокампі; цитокіни, такі як інтерлейкін-6, можуть призвести до зменшення обсягу сірої речовини гіпокампа (5). Цікаво, що переважання знахідок в гіпокампах на початку перебігу хвороби Альцгеймера може бути пов’язано з її чутливістю до порушень в ВВВ (6). Оскільки запалення пошкоджує структури, що відповідають за навчання, пам’ять і пізнання, позитивні нейрокогнітивні ефекти лептину зменшуються.
Лептин найбільш відомий завдяки регулюванню ситості та споживання енергії. Однак він також сприяє зростанню аксонів та посилює довгострокове потенціювання за рахунок модуляції функції N-метил-D-аспартату. Ці характеристики свідчать про його значення в пам’яті та навчанні. Стани ожиріння пов'язані з резистентністю до лептину. Стійкість до дії лептину не обмежується його здатністю регулювати харчування - вона також може притупити роль лептину в когнітивному посиленні (7).
Як і жирова тканина, пептиди підшлункової залози також відіграють важливу роль у мозку. Хоча інсулін найбільш відомий своєю роллю у споживанні клітинної глюкози, дослідження його ролі в пізнанні набирають обертів. Рецептори інсуліну беруть участь у навчанні та пам’яті, з високою концентрацією рецепторів у корі та гіпокампі. Крім того, інсулін (і інсуліноподібний фактор росту 1) діє як нейротрофічні фактори, що сприяють синаптичній пластичності (4).
При діабеті 2 типу організм стає стійким до інсуліну, змушуючи підшлункову залозу виробляти все більшу кількість інсуліну, що сприяє засвоєнню глюкози клітинами. Як і у випадку з лептином, системна резистентність до інсуліну притуплює прокогнітивні ефекти інсуліну в мозку: резистентність до інсуліну пов’язана зі зниженням мовної вільності, низьким об’ємом сірої речовини в скроневих частках та декларативними порушеннями пам’яті (4). Більше того, транспорт інсуліну в мозок може регулюватися периферичною резистентністю до інсуліну, і це може впливати на метаболізм глюкози в ЦНС, сприяти окисному стресу та гальмувати нейротрофічні ефекти інсуліну. У той же час, оскільки абсолютні кількості інсуліну все більше підвищуються (хоча ефект зменшується), гіперінсулінемія призводить до утворення периферичних та центральних амілоїд-β-бляшок, подібних до тих, що спостерігаються при невропатології хвороби Альцгеймера та інших нейродегенеративних розладах. Ці бляшки можуть активувати запалення в ЦНС, що призводить до подальшої загибелі нейронів та утворення бляшок (4).
Ще одна частина історії може походити від аміліну, гормону, який виробляється переважно підшлунковою залозою. Як і лептин, амілін функціонує для регулювання енергетичного обміну, зменшуючи споживання енергії/збільшуючи насичення. У цьому випуску "Біологічна психіатрія" Рейнер та співавт. (8) дослідити, як опосередковується цей ефект. Окреме дослідження 2014 року показало, що серед літніх людей амілін плазми позитивно корелював із когнітивним здоров’ям, навіть після контролю за іншими метаболічними факторами ризику, такими як діабет та гіперліпідемія (9). Крім того, попередні результати показують, що амілін може конкурувати з патологічними амілоїд-β-білками за місця зв'язування рецепторів і навіть сприяти очищенню амілоїду ЦНС (10). Ці дані свідчать про те, що порушення регуляції аміліну, як це спостерігається при ожирінні та діабеті, може сприяти накопиченню амілоїд-β-бляшок (і подальшому запаленню та смерті нейронів), яке спостерігається при хворобі Альцгеймера.
Подяка
Цей коментар було підготовлено у співпраці з Національною ініціативою з неврології з навчальних програм. Цю роботу підтримали Національні інститути охорони здоров’я грантів № R25 MH10107602S1 та R25 MH086466 07S1 (для MRA, у її ролі співголови Національної ініціативи навчальних програм з неврології).
Ми вдячні доктору Девіду Россу за його внесок як редактора Національної навчальної програми з нейронаук та Аманді Ван за її роль у розвитку фігури.
- Поліпшення дієтичних рекомендацій для пацієнтів з діабетом 2 типу та ожирінням в ендокринології
- Материнське середовище та цикл трансгенерації ожиріння та діабету
- Фахівець з гіпоглікемії - Модесто, Каліфорнія, Гопіка Гангупантула, доктор медичних наук, FAAFP, BC-ADM Діабет та ожиріння
- Гіпертонія та ожиріння посилюють втрату пам’яті у людей, які перебувають у групі ризику хвороби Альцгеймера
- Чи відповідає ваша вода за садибу монархів за ожиріння та діабет