MEHMO (Розумова відсталість, епілептичні напади, гіпогеніталізм, мікроцефалія, ожиріння): нове мітохондріальне розлад, пов’язане з Х
Анотація
MEHMO (розумова відсталість, епілептичні напади, гіпогеніталізм, мікроцефалія та ожиріння) - це Х-пов'язане розлад, що характеризується розумовою відсталістю, епілептичними нападами, гіпогеніталізмом, мікроцефалією та ожирінням. Нещодавно він був присвоєний локусу Xp21.1-p22.13. Ми описуємо дитину з МЕГМО та лактоацидозом, біопсія м’язів якої виявила помітно знижену активність комплексів 1,3 та 4 мітохондріального електронного транспортного ланцюга. Гістологічне фарбування показало проліферацію мітохондрій та зберігання ліпідів. Електронна мікроскопія виявила аномальні та збільшені мітохондрії з концентричними кристами та електронно-щільними тілами. Це перша ідентифікація MEHMO як мітохондріального розладу та одного з дуже небагатьох Х-зчеплених мітохондріальних синдромів.
Вступ
MEHMO (розумова відсталість, епілептичні напади, гіпогеніталізм, мікроцефалія, ожиріння) вперше був описаний як новий синдром Делозьє-Бланше та ін. 1, але його назвав Штайнмюллер та ін. 2 Характеризується глибокою розумовою відсталістю, мікроцефалією, гіпогонадизмом, епілепсією та ожирінням. Аналіз гаплотипів та зв'язків у великій родині трьох поколінь нещодавно присвоїв локус захворювання Xp21.1-Xp22.13 в регіоні, оточеному CYBB та DXS365. 2,3 Багатосистемна участь у цьому синдромі є типовою для мітохондріальних захворювань, дефект виробництва енергії може пошкодити всі органи. Хоча гіпогонадизм і ожиріння зазвичай не описуються при мітохондріальних захворюваннях, мікроцефалія, епілептичні напади, розумова відсталість дуже характерні.
Ми досліджували участь мітохондрій у дитини з МЕХМО та молочнокислою ацидемією. Морфологія мітохондрій (як за допомогою світлової, так і електронної мікроскопії) та біохімічна функція (активність дихальних ферментів) підтвердили, що MEHMO є мітохондріальним розладом.
Матеріал і методи
Звіт про справу
Пацієнтка була результатом нормальної 40-тижневої вагітності та доставки здоровим ефіопським євреям, які не є спорідненими. Його вага становила 2,710 кг, а окружність голови - 31,5 см.
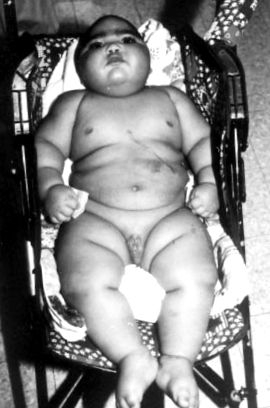
Вперше мікроцефалія була відзначена у віці 2 місяців, коли його госпіталізували з приводу запалення легенів. КТ голови була нормальною. У віці 11 місяців його госпіталізували через дитячі спазми. ЕЕГ виявила схему придушення спалаху. Лікувався вігабатріном та АКТГ. При метаболічному дослідженні виявлено підвищений вміст лактату в крові та 3-метилглутаконової кислоти в сечі. Його направили на біопсію м’язів та введення гастростомичної трубки у віці 12 місяців. Обстеження було важливим для немовляти з ожирінням з надзвичайною мікроцефалією (окружність голови 40 см), амфороподібною фацією, похилим чолом, довгими віями, великими губами, без зубів та мікропеніса (рис. 1).
Пацієнт у віці одного року. Зверніть увагу на гіпогеніталію, ожиріння та мікроцефалію.
Неврологічне обстеження виявило гіпотонічну дитину, яка не виправляла ситуацію та не стежила за нею, незважаючи на звичайний огляд очей. Не було ніяких рухів обличчя та постійних слин. У нього не було ні управління головою, ні спонтанних рухів. Жодних рефлексів виявлено не було. На біль він реагував лише рухом пальців.
Історія сім'ї
У батьків троє здорових синів. У матері матері було двоє синів, які померли на першому році життя.
Методи
Біохімічні дослідження
П’ятивідсотковий гомогенат м’язів у 0,25 М сахарозі, 20 м М Трис, рН 7,2, 40 м М KCl 2 м М ЕГТА та 1 мг/мл альбуміну готували в тефлоновому скляному гомогенізаторі із заморожених зразків. Гомогенат центрифугували при 600 ×g протягом 10 хв і супернатант використовували для визначення ферментів після заморожування/розморожування (три рази) у рідкому азоті.
Ензимна активність дихальних ланцюгів комплексів I + III (чутливий до ротенону NADH цитохром с оксидоредуктаза), II + III (чутливий до антиміцину сукцинат-цитохром с оксидоредуктаза), II (сукцинатдегідрогеназа), IV (цитохром с оксидаза) та активність маркера фермент цитратсинтазу в скелетних м’язах вимірювали спектрофотометрично, як описано раніше. 4
Гістологічний та електронно-мікроскопічний аналіз
Десять мікрометрів м'язових зрізів фарбували гематоксиліном та еозином, модифікованим трихромом Гоморі, PAS, суданським чорним B, NADH-тетразолій-редуктазою, сукцинатдегідрогеназою, цитохром-оксидазою, АТФазою при рН 9,4 та після попередньої інкубації при рН 4,3 та 4,6. Додатковий зразок фіксували у 4% глутаральдегіду у фосфатному буфері та готували до електронної мікроскопії стандартними методами.
Результати
Активність OXPHOS
Комплекси I + III, II + III та IV були помітно знижені, тоді як комплекс II, цитрат-синтаза, PDH та ліпоаміддегідрогеназа (E3) знаходились у межах нормальних значень (табл. 1). Співвідношення I + III/CS, II + III/CS та IV/CS значно суттєвіше. Таким чином, є лише недоліки в комплексах, які частково кодуються мтДНК. Комплекс II, єдиний комплекс, кодований ядерною ДНК, не зазнав впливу.
Гістологія скелетних м’язів та ультраструктура
Найвидатнішою знахідкою була наявність рясної жирової інфільтрації, що оточує м’язові пучки (рис. 2а). Пухирці мали різний розмір, а також між м’язовими волокнами було помічено трохи жиру. Суданське чорне пляма B показало великі краплі ліпідів у м’язових волокнах (Рисунок 2b).
(a) Пляма H&E. М’язовий пучок містить кілька ділянок жиру, оточених масивною жировою інфільтрацією. (b) Судан Чорний B пляма. М’язові волокна містять численні крапельки ліпідів.
Фарбування COX, SDH та NADH показало надмірні мітохондрії, які були розподілені по всій площі волокон, а не лише по периферії. Поширення волоконного типу було нормальним. На трихромовій плямі не було помічено рваних червоних волокон. Аналіз електронної мікроскопії (рис. 3) показав або концентричне розташування крист у величезних мітохондріях, або неправильне розташування пластин (рис. 3а). В мітохондріях було видно електронно-щільні тіла. Деякі мітохондрії були величезними (Малюнок 3b). Паракристалічних включень не було.
Електронна мікроскопія біопсії м’язів. (a) Концентричне розташування крист і неправильне розташування пластин. (b) Електронно щільні тіла видно у величезних мітохондріях.
Обговорення
Поєднання клінічних симптомів, включаючи епілептичні напади, гіпогеніталізм, мікроцефалію та ожиріння, ідентично описаним Штейнмюллером та ін. 2 у пацієнтів із синдромом MEHMO. Штайнмюллер та інУ пацієнтів також була жирова печінка і підвищений вміст жирних кислот і ацилкарнітину в крові. У нашого пацієнта не проводилась біопсія печінки, але при біопсії м’язів виявлена помітна інфільтрація жиру, що також свідчить про порушення в обміні жирів. ДеЛозьє-Бланшер та ін 1 описано двох пацієнтів, у яких не було нападів, але було описано, що вони мають дуже аномальну ЕЕГ, а також ненормальний неврологічний статус. У всіх раніше описаних пацієнтів біопсія м’язів не проводилась, а лактат плазми не згадується. У нашого пацієнта підвищений рівень лактату в плазмі, пов’язаний із судомами та прогресуючою мікроцефалією, картина, описана раніше при синдромі Альперса, 6 призводить до отримання біопсії м’язів та аналізу ферментів дихальних ланцюгів.
Множинні дефіцити комплексів дихальних ланцюгів, кодованих мтДНК (I + III, II + III та IV), з нормальним рівнем ядерно кодованих мітохондріальних ферментів (цитрат-синтази, PDH, E3 та комплексу II) та морфологія мітохондрій свідчать про наявність ядерної дефект, що призводить до порушення функції мітохондрій.
Ми не змогли провести дослідження аналізу зв’язків у нашій сім’ї, щоб довести Х-зчеплену спадщину. Сімейна історія двох братів-чоловіків чоловіка, які померли на першому році життя (хоча не було доведено, що вони страждають від тієї самої хвороби), і схожість нашого пацієнта з описаними раніше 2 свідчить про те, що у нашого пацієнта також є Х- пов'язаний синдром MEHMO. Якщо дядьки по матері померли від іншої хвороби і мали одне покоління трьох незайманих хлопчиків, то ми маємо справу зі спорадичною формою дихального ланцюга.
Існує лише декілька Х-зв’язаних мітохондріальних розладів. Mohr-Tranebjaerg (сенсоневральна глухота, сліпота та розлад руху) спричинена мутаціями гена DDP1, який бере участь у транспортних механізмах мітохондрій. 5 Сидеробластична анемія з атаксією - ще одне Х-зчеплене розлад, яке спричинене мутаціями гена ABC-7, який відповідає за збірку кластерів FeS з мітохондрій у білки цитоплазми. 6
Синдром Барта - третє Х-зчеплене мітохондріальне розлад, що характеризується дилатаційною кардіоміопатією. Цей синдром викликаний мутаціями гена G4.5 (тафаззину), функція якого досі невідома. 7
Комплекс I складається з 43 субодиниць, одна з яких (NDUFA1) кодується в Х-хромосомі (Xq24-25). 8 Дотепер не повідомлялося про мутації цієї субодиниці при ізольованому дефіциті комплексу I. Мутація NDUFA1 не є актуальною для нашого пацієнта, оскільки він мав множинні дефіцити дихального ланцюга, і розлад пов’язаний з різним локусом Х-хромосоми.
Унікальна клінічна картина ожиріння та інфільтрації жиру в печінці може бути наслідком вторинного гальмування катаболізму жиру внаслідок зниження активності ферментів дихальних ланцюгів або може бути результатом мікроделеції, яка включає функції мітохондрій та гени метаболізму жиру.
Цей висновок про дисфункцію мітохондрій при MEHMO потребує підтвердження у інших пацієнтів. Зараз ми зосереджуємо свою увагу на пошуку кандидата-мітохондріального гена в області Xp21.1-Xp21.13, який міг би брати участь у цьому унікальному синдромі.
Список літератури
CD Delozier-Blanchet, Haenggeli CA, Engel E. Мікроцефалічний нанізм, важка відсталість, гіпертонус, ожиріння та гіпогонадизм у двох братів: новий синдром? J Genet Hum 1989 рік 37: 353–365
Штейнмуллер Р, Штейнбергер Д, Мюллер У. MEHMO (розумова відсталість, епілептичні припадки, гіпогонадизм і геніталізм, мікроцефалія, ожиріння), новий синдром: присвоєння локусу захворювання Xp21.1-p22.13 Eur J Hum Genet 1998 рік 6: 201–206
CD Delozier-Blanchet, Haenggeli CA, Bottani A. MEHMO, новий синдром: віднесення локусу хвороби до Xp21.1-p22.13 Лист Eur J Hum Genet 1999 рік 7: 621–622
Рустін П, Кретьєн Д, Буржерон Т та ін. Біохімічні та молекулярні дослідження при дефіциті дихальних ланцюгів Клін Чім Акта 1994 рік 228: 35–51
Jin H, May M, Tranebjaerg L та ін. Новий X-зв'язаний ген, DDP, показує мутації в сім'ях із глухотою (DFN-1), дистонією, психічною недостатністю та сліпотою Nat Genet 1996 рік 14: 177–180
Бекрі S, Kispal G, Lange H та ін. Транспортер ABC7 людини: будова генів та мутації, що спричиняють X-пов'язану сидеробластичну анемію з атаксією з порушенням дозрівання цитозольного залізо-сірчаного білка Кров 2000 рік 96: 3256–3263
Bione S, D'Adamo P, Maestrini E та ін. Новий Х-зчеплений ген, G4.5. відповідає за синдром Барта Nat Genet 1996 рік 12: 385–389
Жученко О, Венерт М, Бейлі Дж та ін. Виділення, картографування та геномна структура X-зчепленого гена для субодиниці мітохондріального комплексу людини I Геноміка 1996 рік 37: 281–288
- Людина проти жиру, допомагаючи психічному здоров’ю та ожирінню завдяки футболу
- Лікування ожиріння, пов’язане з психічним здоров’ям Cielo house
- Засоби масової інформації та технології для заохочення активності профілактики ожиріння Джерело Гарвард Т.
- Домашній пил пов'язаний із ожирінням - але лише у мишей - NHS
- Лінивий спосіб життя звинувачують у зростанні ожиріння The Independent The Independent