Материнська дієта з низьким вмістом білка або гіперхолестеринемія зменшує циркулюючі основні амінокислоти та призводить до внутрішньоутробного обмеження росту
Кум Кум С. Бхасін
1 Медичний факультет, Медичний факультет Девіда Геффена, Каліфорнійський університет, Лос-Анджелес, Каліфорнія
Атіла ван Нас
2 Кафедра генетики людини, Медичний факультет Девіда Геффена, Каліфорнійський університет, Лос-Анджелес, Каліфорнія
Ліза Дж. Мартін
2 Кафедра генетики людини, Медичний факультет Девіда Геффена, Каліфорнійський університет, Лос-Анджелес, Каліфорнія
Річард К. Девіс
1 Медичний факультет, Медичний факультет Девіда Геффена, Каліфорнійський університет, Лос-Анджелес, Каліфорнія
Шерин У. Деваскар
3 Департамент педіатрії, Медичний факультет Девіда Геффена, Каліфорнійський університет, Лос-Анджелес, Каліфорнія
Алдонс Дж. Лусіс
1 Медичний факультет, Медичний факультет Девіда Геффена, Каліфорнійський університет, Лос-Анджелес, Каліфорнія
2 Кафедра генетики людини, Медичний факультет Девіда Геффена, Каліфорнійський університет, Лос-Анджелес, Каліфорнія
4 Кафедра мікробіології, імунології та молекулярної генетики, Медичний факультет Девіда Геффена, Каліфорнійський університет, Лос-Анджелес, Каліфорнія
Читачі можуть використовувати цю статтю до тих пір, поки твір цитується належним чином, використання має навчальний характер і не приносить прибутку, і твір не змінюється. Детальніше див. На веб-сайті http://creativecommons.org/licenses/by-nc-nd/3.0/.
Пов’язані дані
Анотація
ЦІЛЬ -Ми дослідили материнські механізми непереносимості глюкози у дорослих, підвищеного ожиріння та атеросклерозу, використовуючи дві моделі мишей для внутрішньоутробного обмеження росту (IUGR): обмеження материнського білка та гіперхолестеринемія.
ДИЗАЙН ДИЗАЙН І МЕТОДИ -Для цих досліджень ми вимірювали рівні амінокислот у дамах на двох моделях мишей для IUGR: 1) годування дам C57BL/6J дієтою з обмеженим вмістом білка та 2) годування дам-рецепторів LD57 - нуль (LDLR -/-) дієта з високим вмістом жиру (західна).
РЕЗУЛЬТАТИ—Як у білків, так і у гіперхолестеринемічних дамб спостерігалося суттєво зниження концентрації незамінної амінокислоти фенілаланіну та незамінних розгалужених ланцюгів амінокислот лейцину, ізолейцину та валіну. Дієта з обмеженим вмістом білка для вагітних дам призвела до послідів зі значним IUGR. Чоловіче потомство з обмеженим вмістом білка демонструвало прискорене зростання до 8-тижневого віку та розвивало підвищене ожиріння та непереносимість глюкози до 32-тижневого віку. LDLR -/- вагітні дами на західній дієті також мали посліди зі значним IUGR. Чоловічі та жіночі LDLR -/- у нащадків західної дієти на 90 днів розвиваються значно більші атеросклеротичні ураження порівняно з нащадками чау-дієти.
ВИСНОВКИ -На двох моделях мишей IUGR ми виявили знижену концентрацію незамінних амінокислот в експериментальних дамбах. Це вказувало на те, що спільні механізми можуть лежати в основі фенотипових наслідків гіперхолестеринемії матері та обмеження материнського білка на потомство.
У людей недоїдання під час вагітності призводить до немовлят із нижчою вагою при народженні та підвищеним ризиком смертності та захворюваності новонароджених (1). Низька вага при народженні також пов'язана з підвищеним ризиком деяких хронічних захворювань, включаючи діабет 2 типу, серцево-судинні захворювання та гіпертонію (2–4). Одне із запропонованих пояснень, що пов'язує низьку вагу при народженні з хронічними захворюваннями, - гіпотеза Баркера щодо "економного фенотипу", яка постулює, що брак адекватних поживних речовин у внутрішньоутробному середовищі "програмує" потомство на виживання в світі, бідному поживних речовин. З цього випливає, що якщо фактичне постнатальне середовище не є бідним поживними речовинами, а натомість багатим поживними речовинами, метаболічні шляхи будуть «неправильно запрограмовані», що призведе до захворювань на метаболічний синдром у дорослих, включаючи атеросклероз та діабет (5). Зараз багато доказів підтверджує гіпотезу Баркера (6); тому сучасні дослідження на людях та на моделях тварин зосереджені на конкретних механізмах внутрішньоутробного програмування (4).
Оскільки обмеження материнського білка та гіперхолестеринемія створюють ненормальне материнське метаболічне середовище, ми припустили, що можуть бути загальні порушення метаболічних шляхів, що впливають на потомство. Щоб перевірити гіпотезу, ми використовували дві моделі мишей для внутрішньоутробних станів, що призводять до IUGR, одна - обмеження білка та одна - гіперхолестеринемії. Потім ми шукали спільні риси на експериментальних дамбах, щоб визначити можливі шляхи розвитку витоків захворювань на метаболічний синдром. В обох моделях у дамбах знизився рівень деяких незамінних амінокислот.
ДИЗАЙН ДИЗАЙН І МЕТОДИ
Тваринництво.
Це дослідження було схвалено Комітетом з досліджень тварин UCLA та проведено відповідно до рекомендацій Національного інституту охорони здоров’я щодо використання експериментальних тварин. Миші FVB/J, C57BL/6J (B6) та LDLR -/- на тлі B6 були придбані в лабораторіях Джексона (Bar Harbor, ME).
Дієти.
Дієта з низьким вмістом білка (D02041002; Дієти досліджень) містила 9% білка за вагою, була ізокалорійною та була сформульована відповідно до дієт з низьким вмістом білка, опублікованих раніше (26). У дієті з низьким вмістом білка вміст жиру становив 4,4%, а вуглеводів - 77 мас.%. Контрольна білкова дієта (стандартна дієта чау TD 7013; Харлан Теклад) використовувалась для годування контрольних білкових дам, прийомних матерів, дам-хоулів LDLR -/- та відлучених нащадків від обох експериментів. Контрольна білкова дієта містила 19% білка, 6,2% жиру та 75% вуглеводів за вагою та вносила 18% ккал з жиру. Західна дієта (TD 88137; Харлан Теклад) містила 42% ккал калорій з жиру та за вагою, як показано: 21% жиру, 17% білка, 49% вуглеводів і 0,2% холестерину.
Дослідження обмеження білка.
Дослідження гіперхолестеринемії.
Аналіз амінокислот у плазмі матері.
Аналіз амінокислот у плазмі крові матері проводили за допомогою високоефективної рідинної хроматографії в Інституті метаболічних захворювань університету Бейлора (http://www.baylorhealth.edu/imd/) (28). Цей експеримент повторювали, щоб виявити можливі зміни в аналізі амінокислот. У першому дослідженні дамбам було дозволено родити своїх цуценят, а потім їм дали анестезію 2% ізофлураном перед ретроорбітальними знекровленнями протягом 4 годин після пологів. Цей час після вагітності був обраний, щоб мінімізувати будь-який негативний вплив знекровлення на плід та максимізувати вплив різних дієт на матерів. У другому дослідженні брали зразки крові у самок через 1-2 тижні після пологів, зберігаючи таку ж дієту, яку вони дотримувались під час вагітності. Ми спостерігали подібні тенденції в обох експериментах і, отже, об'єднали наші дані з двох досліджень.
Тести на толерантність до глюкози.
Тести на толерантність до глюкози проводили, як описано раніше (29), на потомстві з низьким вмістом білка та контролем у віці 126 днів (4 місяці) та 210 днів (7 місяців). Мишей зважували, голили на задніх кінцівках і постили протягом ночі. Наступного ранку глюкозу натще вимірювали в крові, зібраній із пункції підшкірної вени, після чого внутрішньочеревно вводили 2 мг/г глюкози. Послідовне вимірювання рівня глюкози в крові проводили з інтервалом у 0,5 години протягом наступних 2 годин від підшкірних проколів вен. Глюкометр One Touch Ultra (Lifescan) використовували для вимірювання концентрації глюкози в цільній крові (30).
Склад тіла.
Це було виконано в ядерному магнітно-резонансному сканері для гризунів (Bruker Biospin, Billerica, MA), який був стандартизований до внутрішнього контролю, наданого виробником. Мишей індивідуально зважували на вазі, а потім поміщали в сканер для вимірювання складу тіла, аналізували як відсоток маси жиру (також називається ожирінням), відсоток м’язової маси та відсоток маси рідини. Загальний жир у тілі розраховували, використовуючи вагу кожної миші того дня.
Аналіз ліпідів у плазмі крові.
Мишей голодували протягом ночі, а ретроорбітальну кров збирали під ізофлурановим наркозом. Концентрацію загального холестерину в плазмі, холестерину ЛПВЩ, нестерифікованого холестерину, тригліцеридів та вільних жирних кислот визначали, як описано раніше (31).
Аналіз уражень.
Мишей вбивали через 90 днів, а серце та проксимальну аорту видаляли, вбудовували в сполуку ОСТ (лабораторії Майлза) та зберігали при -70 ° C. Серійні кріосекції товщиною 10 мкм із середньої частини лівого шлуночка та дуги аорти були зібрані та встановлені на пластинах, покритих полід-лізином. Зрізи фарбували ліпідним плямою олійного червоного О та гематоксиліном. Області, пофарбовані ліпідами, переглядали під світловим мікроскопом і підраховували сліпим спостерігачем вручну. Бали визначали, як описано раніше (32).
Аналіз даних.
Всі значення виражаються як середні значення ± SE. Середню вагу посліду використовували для порівняння ваги при народженні в моделі обмеження білка IUGR. Це було зроблено, щоб уникнути помилки типу 1, оскільки фактична кількість новонароджених цуценят була дуже великою і щоб мінімізувати ефект відмінностей у посліді. Двостороння модель ANOVA була використана для одночасного порівняння незалежних змінних у двох групах для оцінки впливу статі та материнського середовища на потомство. У підстилках LDLR -/- розміри підстилки та ваги в межах підстилки істотно не змінювались (6–7 цуценят на підстилку), і, отже, натомість усереднювали індивідуальні ваги щенят. Значення P для всіх групових порівнянь були присвоєні з використанням захищеної найменш значущої корекції різниці після спеціальної захисту Фішера. Односторонній ANOVA використовувався при порівнянні одностатевих груп. Для аналізу було використано програмне забезпечення Statview версії 5.0.
РЕЗУЛЬТАТИ
Модель миші з обмеженим вмістом білка для IUGR.
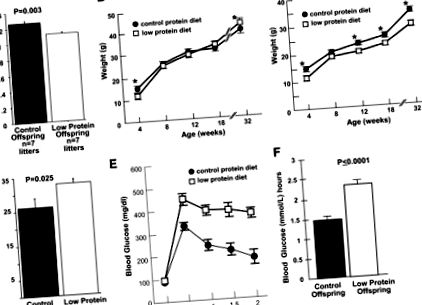
Обмеження внутрішньоутробного розвитку пов’язане з недоїданням під час вагітності, що призводить до порушення обміну речовин у дорослих. Щоб розробити мишачу модель IUGR, ми годували самок C57BL/6J низькобілковою дієтою, починаючи з 0-го дня гестації. Потім ми доставили цуценят від контрольних та обмежених білками дам шляхом кесаревого розтину на 19-й день вагітності та перехресно виховували прийомних дам FVB/J на дієті чау. Середня вага при народженні посліду послідів з обмеженим вмістом білка була значно нижчою, ніж контрольна група (Р = 0,003) (рис. 1А). Низькобілкові та контрольні ваги чоловіків не суттєво відрізнялись, починаючи з 8-тижневого віку (рис. 1В), а на 32-му тижні ваги чоловіків із низьким вмістом білка у нащадків були значно вищими, ніж у контрольних (Р ≤ 0,05) (рис. 1Б). На відміну від цього, низькобілкові жіночі нащадки демонстрували значне обмеження росту порівняно з контролем, поки їх не вбили у віці 32 тижнів (рис. 1С).
Характеристика нащадків від контрольних та обмежених білками послідів. A: Середня вага при народженні посліду в 9% дієт з низьким вмістом білка в порівнянні з 19% контрольних білків, P = 0,003. B: Крива росту чоловічих нащадків у віці від 4 до 32 тижнів. * Ваги значно відрізнялись на рівні Р ≤ 0,05 на 4 та 32 тижні. C: Стійке обмеження росту у жіночих нащадків з обмеженим білком у віці від 4 до 32 тижнів. * Значення суттєво відрізняються на рівні P ≤ 0,05. D: Збільшення ожиріння у нащадків чоловічої статі з низьким вмістом білка у віці 32 тижнів, Р = 0,025. E: Непереносимість глюкози у чоловіків із низьким вмістом білка. Концентрація глюкози в крові нащадків з обмеженим білком у чоловіків після введення стандартного внутрішньочеревного ураження глюкози 2 мг/г маси тіла (мас.). n = 12, 9, 9, 9 і 8 для контрольного потомства; і n = 14, 13, 13, 10 та 9 для нащадків з обмеженим білком за час 0, 0,5, 1, 1,5 та 2 год відповідно. F: Площа під кривою (AUC) для нащадків чоловіків з обмеженим вмістом білка після введення стандартного внутрішньочеревного навантаження глюкозою.
Чоловіче потомство з низьким вмістом білка демонструвало підвищену вагу, ожиріння та непереносимість глюкози.
Чоловіче потомство з низьким вмістом білка мало значно більшу ожиріння (Р = 0,025) у віці 32 тижнів порівняно з контролем (рис. 1D). Ожиріння у нащадків із низьким вмістом білка у жінок у віці 32 тижнів суттєво не відрізнялося від контролю (дані не наведені). Через 32 тижні (але не через 18 тижнів; дані не показані) чоловічі нащадки з низьким вмістом білка продемонстрували значно вищі концентрації глюкози в крові після глюкози (рис. 1E) та значно вищі (P рис. 1F) порівняно з контролем. Базові концентрації глюкози та відповідь на навантаження глюкозою не мали суттєвих відмінностей між нащадками з низьким вмістом білка та контролем у віці 32 тижнів (дані не наведені). Як у чоловіків, так і у жінок нащадків не було значних відмінностей між загальним вмістом білка та контролем загального холестерину, нестерифікованого холестерину, тригліцеридів, вільних жирних кислот або холестерину ЛПВЩ у плазмі (дані не наведені).
Вплив гіперхолестеринемічного середовища плода на доросле потомство.
Характеристика контролю ЛПНЩ -/- та нащадків західної дієти при народженні та у віці 90 днів. В: Загальні плазмові концентрації ЛПНЩ -/- жінок у період вагітності на чау та західних дієтах. B: Вага народження потомства від LDLR -/- дам на західній дієті порівняно з контролем, P = 0,02. С: Нижня маса тіла нащадків із західної дієти у віці 90 днів порівняно з контролем, Р = 0,05. D: Довжина носа до кінчика хвоста у західних нащадків, P = 0,0004 для ефекту холестерину у матері як у чоловіків, так і у жінок. E: Вага жирових тканин гонад, нормалізована за масою тіла, P = 0,04 для ефекту холестерину у жінок для нащадків чоловічої та жіночої статі. F: Розмір атеросклеротичного ураження проксимальної аорти у віці 90 днів, Р = 0,02 для ефекту холестерину у жінок як у чоловіків, так і у жінок. G: Репрезентативні ураження у віці 90 днів у нащадків LDLR -/-, які зазнали гіперхолестеринемії матері. 1, цілий проксимальний відділ аорти; 2, одне ураження збільшено. (Будь ласка, див. Http://dx.doi.org/10.2337/db07-1530, щоб отримати якісне цифрове представлення цієї цифри.)
У 90-денному віці потомство західної дієти значно зменшило вагу (P ≤ 0,05) та довжину (P = 0,0004) порівняно з контролем (рис. 2C та D). Західні дієтичні нащадки мали суттєво нижчі (Р = 0,04) співвідношення жирової тканини статевих залоз до маси тіла, ніж контролі, а чоловіки мали значно вищі співвідношення, ніж жінки (Р = 0,0001) (рис. 2Е). Західна дієта LDLR -/- потомство мало значно більші атеросклеротичні ураження, ніж контролі (P = 0,002) (рис. 2F). Репрезентативний зріз аорти з ураженнями [1) цілий розріз та 2) одне ураження], що спостерігаються у віці 90 днів, показаний на рис. 2G. Чоловіки та жінки не продемонстрували значної різниці у розмірі ураження. Морфологія та клітинний склад уражень (макрофаги проти клітин гладкої мускулатури) не відрізнялися між групами (дані не наведені). Не виявлено суттєвих відмінностей у ліпідах плазми потомства, включаючи вільні жирні кислоти, тригліцериди, загальний холестерин, нестерифікований холестерин та холестерин ЛПВЩ (дані не наведені).
Зниження рівня амінокислот у плазмі крові матері як у дамбі з низьким вмістом білка, так і у гіперхолестеринемічному.
Гіпоаміноацидемія у обмежених білками та дамах з гіперхолестеринемією. A: Концентрація сечовини в плазмі та амінокислот у дамбах на дієті з контролем білка 23% (n = 8; □) та дієті 9% з низьким вмістом білка (n = 3; ▪), а також у дамах LDLR -/- на західній дієті ( n = 11; ▪) та контролювати дієту чау (n = 9; □). * P -/- миші, сприйнятливі до атеросклерозу, викликають ознаки, спричинені IUGR, які можуть сприяти атеросклерозу. У нашому дослідженні потомство LDLR -/- дам, що годувались західною дієтою, мало менше ваги при народженні та більш важкі атеросклеротичні ураження, ніж контролі у віці 90 днів. Особливо важливе значення, як у обмежених білками, так і у гіперхолестеринемічних дам, мало зниження плазмової концентрації кількох незамінних амінокислот.
Моделі IUGR у нашому дослідженні відрізнялись у кількох ключових сферах. По-перше, різницю між статями у збільшенні ваги та непереносимості глюкози було помічено в моделі з низьким вмістом білка. Чоловіки, але не жінки, нагнали вагу контрольного потомства до восьмого тижневого віку і розвинули непереносимість глюкози до 32-тижневого віку. Цю різницю за статтю було виявлено в інших моделях мишей, включаючи нещодавнє дослідження гетерозиготних нульових мишей GLUT3 (30). Крім того, на трансгенній мишачій моделі експресованого гіпоталамусом регулятора споживання їжі, рецептора нейропептиду Y, було помічено статевий ефект. Трансгенні чоловіки NPYR1, але не жінки, набрали надмірну вагу на дієті з високим вмістом жиру і втратили вагу при введенні лептину (38). Таким чином, різниця статі, яку ми побачили у збільшенні ваги, ожирінні та толерантності до глюкози в групі з низьким вмістом білка, узгоджується з іншими висновками та свідчить про ймовірну участь ендокринної системи в етіології цих ознак.
Все більше стає очевидним, що ембріональні та фетальні клітини мають складну систему, що інтегрує харчові сигнали з їхнього середовища, щоб максимізувати потенціал для виживання. Взаємозв'язок недоїдання матері та IUGR, що призводить до порушень обміну речовин у дорослих, таких як ожиріння, діабет 2 типу та атеросклероз, було продемонстровано в кількох епідеміологічних дослідженнях (2,49-51). Наші результати імітували популяційні дослідження на людях, де недоїдання матері та результуюча низька вага тіла при народженні були визначені загальними факторами ризику захворювань, що виникають у дорослих. Крім того, наші дослідження продемонстрували, що обмеження материнського білка та гіперхолестеринемія були пов'язані з материнською гіпоаміноацидемією. Отже, гіпоаміноацидемія матері може бути важливим попередником обох моделей IUGR і може бути важливою ланкою механізмів, що сприяють розвитку непереносимості глюкози, ожиріння та атеросклерозу у дорослих.
- Дієта з низьким вмістом жиру з омега-3 жирними кислотами збільшує концентрацію інсуліноподібного фактора росту в плазмі крові в крові
- Інтестерифікований жир або пальмова олія як замінники частково гідрованого жиру в материнському харчуванні можуть
- Чи дієта з низьким вмістом білка тут здорова; s Що дієтологи думають добре?
- Низькобілкова дієта та прогресування дегенерації сітківки при атрофії жиратів судинної оболонки та
- Дієта матері під час вагітності та концентрація кадмію в крові в спостережній когорті