Гідроліз ліпідів
Гідроліз та окислення ліпідів вважаються можливим джерелом для слабокислих протонофор.
Пов’язані терміни:
- Ліпосома
- Ліпідний
- Жирна кислота
- Фермент
- Білок
- Діацилгліцерин
- Холестерин
- Тріацилгліцерол ліпаза
- Білкова кіназа С
Завантажити у форматі PDF
Про цю сторінку
ТКАНИ АДИПОЗИ | Будова та функції білої жирової тканини
Регуляція метаболізму жирових тканин
І синтез ліпідів, і гідроліз знаходяться під складним гормональним контролем. Гормони регулюють кількість ключових ферментів та інших задіяних білків, а також їх діяльність. Крім того, системи `` передачі сигналу '' (низка реакцій, що передають сигнали, індуковані гормоном, до мішеней у клітині), завдяки яким гормони досягають своїх ефектів, також піддаються самому ендокринному контролю та змінюють здатність адипоцитів передавати такі сигнали є важливою частиною адаптації до деяких фізіологічних станів (наприклад, лактація).
Інсулін посилює синтез і секрецію ліпопротеїн-ліпази; цей ефект підсилюється глюкокортикоїдами. Інгібуючий шлунковий поліпептид також підвищує активність ліпопротеїн-ліпази; цей ефект, ймовірно, буде важливим для сприяння відкладенню жиру у тварин, які харчуються з високим вмістом жиру, оскільки такі дієти стимулюють секрецію цього гормону. Таким чином, інсулін та певні гормони кишечника збільшують синтез жиру, збільшуючи надходження жирних кислот для етерифікації. Інсулін також сприяє утворенню гліцерину 3-фосфату, частково, принаймні, збільшуючи засвоєння глюкози адипоцитами. Сама швидкість етерифікації жирних кислот може не стимулюватися безпосередньо гормонами, але безпосередньо змінюється залежно від наявності жирних кислот. Цікаво, що адипоцити секретують адипсин та два споріднені білки, які взаємодіють у присутності хіломікронів, виробляючи стимулюючий ациляцію білок, який потім діє на адипоцити, стимулюючи етерифікацію та засвоєння глюкози.
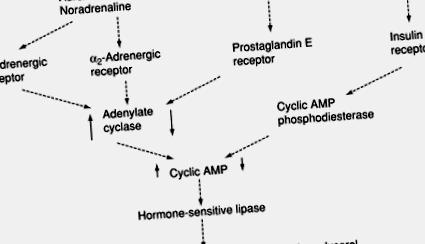
Малюнок 5. Контроль гідролізу триацилгліцерину (ліполізу) за допомогою катехоламінів (адреналіну та норадреналіну) та інсуліну. АМФ, аденозинмонофосфат; ↑, ↓, активність/концентрація збільшуються або зменшуються відповідно стимулом.
Таким чином, метаболізм жирової тканини знаходиться під складним контролем. Загалом, інсулін сприяє синтезу жиру та пригнічує ліполіз, тоді як катехоламіни та глюкагон пригнічують синтез та сприяють ліполізу. Крім того, стероїдні гормони, гормони щитовидної залози та гормон росту діють на модуляцію впливу інсуліну та катехоламінів, частково, принаймні, шляхом модифікації здатності систем передачі сигналів передавати сигнали.
Системи та пристрої-носії на основі ліпосом, що використовуються для легеневої доставки ліків
Іфтіхар Хан,. Вакар Ахмед, Біоматеріали та медична трибологія, 2013
9.4.3 Ліофільне сушіння
Препарати ліпосом не виявляли жодних фізичних змін до або після ліофільного висихання. Однак це підвищило стабільність і скоротило час відновлення ((Elhissi A. M. A. and Taylor 2005, Lee et al. 2007).
Метаболічний аналіз із використанням стабільних ізотопів
Сергій Туманов,. Журре Дж. Камфорст, у Методи в ензимології, 2015
3.2 LC-MS аналіз
Розуміння та оптимізація мікробної деградації оливкової олії
42.5 Визначення кроку обмеження тарифу
Малюнок 42.4. Схематичний огляд клітинних та біохімічних процесів та деяких важливих фізико-хімічних параметрів, що беруть участь у мікробній деградації природних масел. «Міцела» являє собою субстрат у агрегованому стані, тобто у формі адсорбованого моношару, міцели або емульсії згідно з Вергером (1997). Субстрат також присутній у неагрегованій формі у вигляді «мономеру», нижче його критичної концентрації міцели (CMC). «Клітинна стінка» являє собою транспортний бар’єр для транспортування субстрату в клітину та транслокації ліпази з клітини і за своїм структурним складом складніша, ніж намальована. Зауважте, що грамнегативні бактерії, наприклад, мають дві чіткі мембрани і периплазматичний простір між ними, що має вирішальне значення для правильного згортання ліпази.
(Ягер та Еггерт, 2002)
Том 2
Вступ
Протеїнкіназа С (ПКК) була в центрі уваги з часу відкриття понад чверть століття тому, що завдяки своїй активації діацилгліцерином вона передає сигнали від гідролізу ліпідів до фосфорилювання білка [1]. Подальше відкриття, що ПКС є мішенями складних ефірів форболу, негідролізуваних функціональних аналогів ендогенного ліганду, діацилгліцерину, призвело до лавини звітів про вплив складних ефірів форболу на функцію клітин [2–6]. Біофізичні, біохімічні, клітинні та фізіологічні дослідження за останні два десятиліття, доповнені недавніми досягненнями структурної та клітинної візуалізації, відкрили багато секретів цього перетворювача центральної стадії [7–9]. Його неконтрольована сигналізація спричиняє хаос у клітині, що відображається потужними властивостями стимулюючих пухлину ефірів форболу, ставлячи його як терапевтичну мішень при таких захворюваннях, як рак. У цій главі узагальнено наше сучасне розуміння молекулярних механізмів того, як протеїнкіназа С перетворює інформацію від ліпідних медіаторів до фосфорилювання білка.
ПРОБЛЕМИ ВИПУСКУ | Проблеми, спричинені бактеріями
Псування інших молочних продуктів
Мікрофлора незбираного молока, як правило, присутня у складі крему. Оскільки вершки є головним інгредієнтом масла, псування мікробів може бути проблемою. Мікроорганізми, пов’язані з гідролізом ліпідів тригліцеридів до вільних жирних кислот, можуть спричиняти підвищену кислотність, згірклість та мильність у вершковому маслі. Збудники включають Pseudomonas, Micrococcus та Serratia spp. Забруднення поверхні або гнилість є результатом зростання S. putrefaciens.
Бактеріальне забруднення сиру, як правило, є результатом виробництва з молоком, що має високий мікробний вміст (≥1000 КОЕ мл -1). Небажаний ріст молочнокислих бактерій, таких як Leuconostoc spp. та L. lactis, можуть спричинити небажане рожеве забарвлення біля поверхні сиру. Bacillus, Leuconostoc та Pseudomonas spp. може атакувати білки і виробляти вуглекислий газ. Виробництво великої кількості газу може призвести до утворення небажаних дірок у сирі під час виробництва сиру. Ці бактерії відповідають за гіркий смак і слиз у м’яких та твердих сирах (наприклад, Брі та Пармезан відповідно).
У сирі Pseudomonas spp., А саме P. fragi, може змінювати аромати, залишаючи гнильний, прогірклий, гіркий або фруктовий смак. Іншою проблемою є ріст Flavobacterium spp., Який може змінити колір сиру. Кишкова паличка у досить великій кількості (100 000 КОЕ г -1) може привести до нечистого або нудотного смаку, особливо коли сир залишають при кімнатній температурі (22 ° C).
Первинні змішані дисліпідемії
Дефіцит HL
HL є ключовим ферментом печінки, який бере участь у каталізації гідролізу тригліцеридів та фосфоліпідів у залишкових ліпопротеїнах та частинках ЛПВЩ, що, таким чином, відіграє важливу роль у перетворенні IDL у LDL. Гідроліз ліпідів HL в залишкових частинках сприяє їх печінковому засвоєнню через опосередкований апо-Е процес. Крім того, HL бере участь у реконструкції залишкових частинок, HDL та LDL, а також у виробництві дрібних, щільних LDL (Carmena et al., 2004; Kobayashi et al., 2015).
Дефіцит HL є рідкісним аутосомно-рецесивним захворюванням, що призводить до змішаної гіперліпідемії, що характеризується підвищенням рівня холестерину та тригліцеридів, спричиненим накопиченням залишків ліпопротеїнів, і це може супроводжуватися нормальним або підвищеним рівнем HDL-C (Hegele et al., 1993) . Показано, що різні мутації гена HL (LIPC) спричиняють втрату циркулюючої активності HL, спричиняючи збільшення залишків плазми та багатого тригліцеридами ЛПВЩ, що створює підвищений ризик ІХС (Chatterjee and Sparks, 2011). Фенотип подібний до фенотипу, виявленого у FDBL, з підвищеним рівнем загального холестерину та тригліцеридів, передчасною аркусовою рогівкою, долонними та туберо-ерупційними ксантомами та передчасним ССЗ (Семенкович та ін., 2016).
Діагноз вимагає демонстрації дефіциту HL за допомогою in vitro аналізів активності HL у зразках плазми постгепарину або аналіз ДНК для виявлення мутації. Як зазначено при лікуванні FDBL, терапія статинами рекомендується для зменшення залишкових ліпопротеїнів та ризику серцево-судинних захворювань при цій хворобі.
Формування кремів, гелів, лосьйонів та суспензій
4.4 Формування ліпосом
Ліпосоми мають ядро водного розчину, оточене гідрофобною мембраною, у вигляді ліпідного бішару. Під час процесу формулювання гідрофільні матеріали можуть бути розчинені у водному ядрі, а гідрофобні матеріали зроблені для зв'язування з бішаром. Отже, ліпосоми можна використовувати у рецептурах як "носії" як для гідрофільних, так і для гідрофобних інгредієнтів. Клітинні мембрани в шкірі людини також складаються з ліпідних двошарових структур. Ліпідні подвійні шари ліпосом у складі продуктів можуть "зливатися" з двошарами в клітинній мембрані, доставляючи тим самим вміст ліпосом до місця дії. Таким чином, ліпосоми можуть бути використані як засіб для введення поживних речовин та фармацевтичних препаратів.
Наявність поверхнево-активних речовин у рецептурі порушить цілісність ліпосом. Як результат, стабільність стає основною проблемою при спробі формулювання ліпосом в емульсійних системах. Для місцевих або трансдермальних шляхів введення ліпосоми можна безпечно формувати у дозах гелевого типу. Гелі, виготовлені з карбомеру, похідних целюлози та гіалуронових кислот, найбільш придатні для приготування з ліпосомами. Захоплення ліпосом у потовщеному матриксі допомагає продовжити термін їх зберігання, зменшуючи можливість зіткнення ліпосом і ліпосом. Для ін’єкційних ліпосомних ліпосом ліпосоми можна висушити ліофілізацією та забезпечити окремим відповідним носієм середовища (таким як сольовий розчин або розчини для ін’єкцій декстрози). Ліпосоми ресуспендують шляхом змішування із середовищем-носієм безпосередньо перед ін’єкцією в організм.
Деякі з критичних факторів, що впливають на стабільність ліпосом, включають [4]:
рН препарату: готовий препарат рН 6,5 є ідеальним, оскільки при такому рН швидкість гідролізу ліпідів є найнижчою.
Температура зберігання: Ліпосоми дуже сприйнятливі до температур, що сприяють окисленню та витоку захопленого вантажу. Тому зберігання при 2-8 ° C є ідеальним. Крім того, критично важливо не піддавати завантажені ліпосоми умовам заморожування та розморожування, оскільки відомо, що завантажений вантаж, ймовірно, витече після напруги заморожування-відтавання.
Система закриття контейнера: вибір системи закриття контейнера, що використовується для зберігання ліпосомних композицій, є вирішальним. Ліпосоми не сумісні з певними пластичними матеріалами. Для ін’єкційних суспензій ліпосом важливим є тестування на сумісність з еластомерними пробками, які будуть використовуватися з ін’єкційними флаконами. Використання скляних ампул замість закупорених флаконів для ін’єкцій часто є безпечнішим. Оскільки ліпіди сприйнятливі до фотоокислення, настійно рекомендується захищати їх від світла під час зберігання.
Інфузійні трубки: Для інфузійних ліпосомних композицій критично важливим є встановлення сумісності суспензій ліпосом з внутрішньовенними трубками, оскільки ця трубка виготовлена із синтетичних пластикових матеріалів. На етикетці продукту потрібно вказати частини/типи труб, які можна використовувати під час введення препарату.
Ферменти, промислові (огляд)
Ферменти у модифікації жирів та масел
Ліпази (EC 3.1.1.3, гідролази складних ефірів гліцерину) - це всюдисущий клас ферментів, які каталізують гідроліз, етерифікацію (синтез) та переетерифікацію (груповий обмін ефірів). Ці ферменти використовуються для різноманітних цілей, таких як гідроліз жиру, розвиток аромату в молочних продуктах, синтез складних ефірів, переетерифікація жирів та олій, виробництво хіральних органічних сполук, засоби для миття та очищення, а також для обробки побутових та промислових продуктів. Ліполітичні реакції відбуваються на межі розділу ліпід-вода. Існує два широкі типи ліпаз на основі їх позиційної специфіки. Неспецифічна ліпаза вивільняє жирні кислоти з усіх трьох положень гліцеринової частини та використовується для повного гідролізу жирів та олій для звільнення жирних кислот та гліцерину. Їх виробляють Candida sp., Staphylococcus sp. Та Geotrichum sp. Інший тип ферменту - це 1,3-специфічна ліпаза, яка вивільняє жирні кислоти з 1,3 положення та переважно вільні жирні кислоти та ди- та моногліцериди як продукти реакції. Цей тип ліпази виробляється Aspergillus, Mucor, Rhizopus та Pseudomonas sp.
Твердотільна ферментація для виробництва ліпаз для використання в середовищі та на біодизелі
2.5 Застосування ліпаз, отриманих твердим бродінням
Хоча SSF виробляє численні ліпази, лише декілька звітів описують застосування цих біокаталізаторів.
Найбільш вивченими застосуваннями ліпаз SSF є синтез ароматичних і ароматичних ефірів [48,69–72], синтез біодизеля [50,54,57,59,68,73–76] та гідроліз ліпідів стічних вод з високим вмістом олії та жиру [77–84]. Ліпази SSF також використовували для видалення олії з бавовняної тканини [85], посилення аромату чорного чаю [86], енантіоселективної реакції [67], переетерифікації ліпідів [87], селективного гідролізу олії [65] та гідролізу олії та жиру [ 56,88] .
Беручи до уваги широкий спектр застосувань ліпази та декілька областей, покритих ліпазами SSF, залишається ще дослідити велику територію. У наступному розділі детальніше розглядається питання застосування ліпаз SSF для цілей біодизеля.
- Інулін - огляд тем ScienceDirect
- Омела - огляд тем ScienceDirect
- Розчинна кава - огляд тем ScienceDirect
- Дієта з низьким глікемічним індексом - огляд тем ScienceDirect
- Ilex Paraguariensis - огляд тем ScienceDirect