Лікування злоякісного випоту плеври: випадок локалізованої імунотерапії
Анотація
Злоякісний плевральний випіт (МПЕ) - це загальний термінальний шлях для багатьох видів раку, з оцінками захворюваності США понад 150 000 випадків на рік. МПГ є агресивним захворюванням з рівномірним летальним прогнозом та тривалістю життя лише від 3 до 12 місяців. Розробка ефективної таргетної терапії представляє нагальну незадоволену потребу. Цей коментар зосереджується на тому, як клітинні та гуморальні компоненти зумовлюють плевральний простір як середовище, що сприяє розвитку пухлини, загоює рани. Незважаючи на велику кількість потенційних антиген-презентуючих та ефекторних клітин у плеврі, їх фізична ізоляція мезотеліальним бар'єром, концентрація цитокінів та хемокінів, що рухають епітелій до мезенхімального переходу (EMT) та поляризація M2/Th-2, пригнічують специфічний до пухлини імунний ефекторні відповіді. Ми стверджуємо, що локальна імунна реполяризація повинна передувати або імунному контрольному пункту, або клітинній терапії, щоб успішно викорінити пухлину плеври. Ми також припускаємо, що через свій клітинний вміст реполяризований плевральний простір забезпечить ефективне імунне середовище для генерації системної протипухлинної відповіді.
Вступ
Локалізована імунотерапія
Концепція активації імунної системи в умовах злоякісної пухлини грудної клітки відноситься до 1970-х років, коли дослідники відзначали поліпшення виживання у пацієнтів з емпіємою після резекцій раку легенів [4], виправдовуючи переважно невдалі випробування внутрішньоплевральної палички Кальмет-Герена (БЦЖ) [5]. ] та інші бактеріальні антигени. Також було випробувано пряме закапування рекомбінантних цитокінів інтерферону ɣ [6], інтерферону α2b [7] та IL-2 [8, 9]. Внутрішньоплевральний ІЛ-2 добре переносився при недрібноклітинному раку легенів (НМРЛ). Крім того, рівні внутрішньоплеврального введення IL-2 були в 6000 разів вищими, ніж у плазмі [8], що вказує на те, що локально введений IL-2 (маса формули = 15,5 кДа) секвеструється в плевральному просторі. Це дуже важливе спостереження, оскільки можна очікувати, що інші біологічні речовини великих молекул, такі як антитіла, будуть концентруватися так само при безпосередньому введенні в плевру. Хоча внутрішньоплевральний очищений випіт ІЛ-2 у 28 з 31 досліджуваного пацієнта [9] і часткові відповіді спостерігались при інших способах цитокінів, середній час до прогресування коливався від днів [7] до місяців [8]. Таким чином, інстиляція цитокінів, асоційованих з високими дозами Th1, була недостатньою для подолання імунодепресивного середовища плеврального простору.
Терапевтичне використання плеврально-інфільтруючих Т-клітин (PIT)
Імунні інгібітори контрольних точок при МПЕ
PD-L1 експресується на злоякісній мезотеліомі [13] та інших злоякісних пухлинах і, отже, потенційно націлюваний антитілами проти PD-L1. Т-клітини з NSCLC MPE демонструють підвищену експресію PD-1, TIM-3 та CTLA-4 у порівнянні з не злоякісними контролями [14], можливо, через високий рівень TGF-β у випоті, що секретується PD- L1 + асоційовані з пухлиною М2-макрофаги.
На шляху до ефективної локалізованої імунотерапії
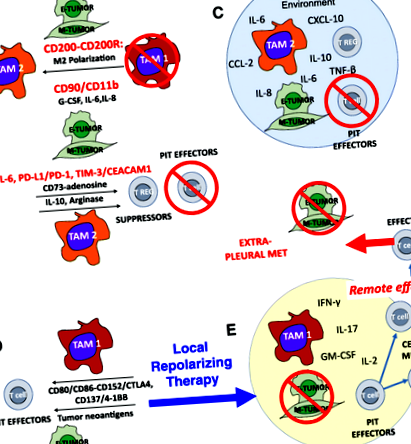
Стає дедалі зрозумілішим, що як звичайні, так і імунотерапевтичні спроби зазнали невдачі при МПЕ, оскільки плевральний простір - це відокремлене середовище, в якому клітини пухлини та імунні клітини взаємодіють на користь пухлини. У плевральному просторі концентруються ранозагоювальні цитокіни та хемокіни, а юкстакринні взаємодії пухлини, макрофагів та мезотеліальних клітин сприяють їх близькості. Результатом є збереження ранозагоювального середовища, в якому Т-клітинні ефектори пригнічуються або вбиваються, а макрофаги спрямовуються на програму М2, яка сприяє ангіогенезу та метастазуванню, що завершується пропагандою агресивного та інвазивного фенотипу пухлини ЕМТ.
Секвестроване середовище
Плевральний простір являє собою відокремлене місцеве середовище, утворене мезотеліальними клітинами, з'єднаними щільними з'єднаннями [15]. Білкові біологічні препарати, такі як IL-2, залишаються висококонцентрованими при внутрішньоплевральному введенні з місцевими концентраціями в тисячі разів вищими, ніж у плазмі [8]. Рух білка з плазми в плевру також утруднений, хоча і в меншій мірі, а плевральний випіт до плазми співвідношення концентрацій білка у зворотному відношенні до їх молекулярної маси [16]. Це дуже важливо для системного введення терапії антитілами, яке, як передбачається, не буде легко переходити в плевральний простір, черевну порожнину або інтерстиціальні простори [17].
Секретом плеври
Юкстакринні взаємодії
Близькість та висока концентрація Т-клітин, макрофагів, мезотеліальних клітин та пухлини у плевральному просторі сприяє контакту клітин-клітин та юкстакриновій передачі сигналів. Приклади включають стимулювання ЕМТ шляхом зв'язування CD90 та EphA4 на пухлину з CD11b та Ephrin на макрофагах відповідно [23]. Подібним чином PD-L1 та PD-L2, експресовані на пухлинних та плевральних макрофагах, зв'язуються з PD-1 на Т-клітинах, сприяючи розвитку енергії, розвитку індукованих регуляторних Т-клітин (iTregs) та апоптозу [32]. Інші ліганди, експресовані на пухлині плеври, такі як CEACAM1, який зв'язується з TIM-3, можуть взаємодіяти з рецепторами імунної контрольної точки, експресованими на PIT. MPE, які регулярно лікують терапевтично, забезпечують унікальне вікно взаємодій, які важче спостерігати в інших метастатичних умовах.
Висновок
Незважаючи на постійні зусилля щодо забезпечення ефективної системної та локалізованої цитотоксичної та імунотерапевтичної терапії, в даний час ефективного лікування злоякісного плеврального випоту немає. Ми стверджуємо, що плевральний простір через фізичний бар'єр, який забезпечує мезотелій, діє як біореактор, в якому взаємодіють клітини карциноми, TAM, PIT та строма (рис. 1). Концентрація ранозагоювальних цитокінів та хемокінів та поляризація навколишнього середовища, що виникають в результаті цих багатосторонніх взаємодій із зворотним зв'язком, сприяють ЕМТ та агресивній поведінці пухлини та заважають протипухлинним імунним ефекторним реакціям за допомогою численних різних і, ймовірно, синергетичних механізмів. Перевага внутрішньоплеврального введення полягає в тому, що високомолекулярні біологічні препарати секвеструються в плевральному просторі [8, 33] за тим самим механізмом, який дозволяє накопичувати високі концентрації локально секретованих цитокінів. Таким чином, реполяризаційні комбінації лікування, які мали б неприйнятні обмежуючі дозу токсичності при системному застосуванні, можуть мати більш прийнятні профілі токсичності при введенні безпосередньо в плевральний простір із часткою системної дози.
Значний прогрес імунотерапевтичних засобів проти раку за останнє десятиліття вимагає розробки нових методів лікувати а не паліативні злоякісні плевральні випоти. Визнаючи плевральний простір як відокремлене середовище, в якому присутні всі компоненти, необхідні для ефективної протипухлинної відповіді, але призначені в режим загоєння ран, ми стверджуємо, що поєднання місцевої реполяризуючої терапії в поєднанні з блокуванням імунної контрольної точки та терапевтичним ефекторних клітин може бути достатньо, щоб перетворити важку клінічну ситуацію на терапевтичну перевагу.
Скорочення
Молекула адгезії клітин, пов’язана з канцероембріональним антигеном
Цитотоксичний білок, асоційований з Т-лімфоцитами 4
Перехід епітелію в мезенхіму
Фракція кристалізується рецептора
індукована регуляторна Т-клітина
Поляризація макрофагів типу М2
Злоякісний плевральний випіт
Запрограмований ліганд смерті
Т-клітина плевральної інфільтрації
Макрофаг, асоційований з пухлиною
Трансформуючий фактор росту
Т2-клітинна поляризація типу Th2
Лімфоцит, інфільтруючий пухлину
Т-клітинний імуноглобулін та муцин-домен, що містить-3
Ендотеліальний фактор росту судин
Список літератури
Клайв А.О., Кахан до н.е., Хупер CE, Бхатнагар Р, Морлі А.Дж., Захан-Еванс Н та ін. Прогнозування виживання при злоякісному плевральному випоті: розробка та підтвердження прогностичного балу LENT. Грудна клітка. 2014 рік.
American Thoracic S. Управління злоякісними плевральними випотами. Am J Respir Crit Care Med. 2000; 162 (5): 1987–2001.
Уоррен В.Х., Калімі Р., Ходадаян Л.М., Кім А.В. Лікування злоякісних плевральних випотів за допомогою катетера Pleur (x). Енн Торак Сург. 2008; 85 (3): 1049–55.
Ruckdeschel JC, Codish SD, Stranahan A, McKneally MF. Післяопераційна емпієма покращує виживання при раку легенів. Документація та аналіз природного експерименту. N Engl J Med. 1972; 287 (20): 1013–7.
Bakker W, Nijhuis-Heddes JM, van der Velde EA. Післяопераційна інтраплевральна БЦЖ при раку легенів: 5-річний звіт про спостереження. Імунол раку. 1986; 22 (2): 155–9.
Yanagawa H, Haku T, Hiramatsu K, Nokihara H, Takeuchi E, Yano S, et al. Внутрішньоплевральне закапування інтерферонової гамми у пацієнтів із злоякісним плевритом внаслідок раку легенів. Імунол раку. 1997; 45 (2): 93–9.
Sartori S, Tassinari D, Ceccotti P, Tombesi P, Nielsen I, Trevisani L, et al. Перспективне рандомізоване дослідження внутрішньоплеврального блеоміцину проти інтерферону альфа-2b за допомогою ультразвукової керованої малогрудної трубки грудної клітки при паліативному лікуванні злоякісних плевральних випотів. J Clin Oncol. 2004; 22 (7): 1228–33.
Goey SH, Eggermont AM, Punt CJ, Slingerland R, Gratama JW, Oosterom R, et al. Внутрішньоплевральне введення інтерлейкіну 2 при мезотеліомі плеври: дослідження фази I-II. Br J Рак. 1995; 72 (5): 1283–8.
Castagneto B, Zai S, Mutti L, Lazzaro A, Ridolfi R, Piccolini E та ін. Паліативна та терапевтична активність імунотерапії ІЛ-2 при нерезектабельній злоякісній мезотеліомі плеври з плевральним випотом: результати дослідження фази II на 31 пацієнтці підряд. Рак легенів. 2001; 31 (2): 303–10.
Чу Х, Ду Ф, Гун З, Ліан П, Вамг З, Лі П та ін. Краща клінічна ефективність ТІЛ для злоякісного плеврального випоту та асциту, ніж цисплатин за допомогою внутрішньоплевральної та внутрішньочеревної інфузії. Протипухлинний Res. 2017; 37 (8): 4587–91.
Maeda K, Hazama S, Tokuno K, Kan S, Maeda Y, Watanabe Y, et al. Вплив хіміотерапії колоректального раку на регуляторні Т-клітини та пухлинний імунітет. Протипухлинний Res. 2011; 31 (12): 4569–74.
Mani NL, Schalper KA, Hatzis C, Saglam O, Tavassoli F, Butler M, et al. Кількісна оцінка просторової неоднорідності інфільтруючих пухлиною лімфоцитів при раку молочної залози. Рак молочної залози Res. 2016; 18: 78.
Khanna S, Thomas A, Abate-Daga D, Zhang J, Morrow B, Steinberg SM, et al. Злоякісні випоти мезотеліоми інфільтруються CD3 + Т-клітинами, що сильно експресують PD-L1, а пухлинні клітини PD-L1 +, що знаходяться в цих випотах, сприйнятливі до ADCC антитілом Avelumab проти PD-L1. Журнал торакальної онкології: офіційне видання Міжнародної асоціації з вивчення раку легенів. 2016 рік.
Li L, Yang L, Wang L, Wang F, Zhang Z, Li J, et al. Порушення функції Т-клітин при злоякісному плевральному випоті обумовлене TGF-бета, отриманим переважно з макрофагів. Int J Рак. 2016; 139 (10): 2261–9.
Амашех С, Марков А.Г., Волгін Г.Н., Воронкова М.А., Яблонський П.К., Фромм М. Бар'єрна функція мезотелію плеври людини складається з щільних з'єднань. FASEB J. 2011; 25 (1_додаток): 1036.3-.3.
Telvi L, Jaubert F, Eyquem A, Andreux JP, Labrousse F, Chretien J. Дослідження імуноглобулінів при плеврі та плевральних випотах. Грудна клітка. 1979; 34 (3): 389–92.
Khaowroongrueng V, Jadhav SB, Fueth M, Ottender MB, Richter W, Derendorf H, редактори. Застосування великопористого мікродіалізу в інтерстиціальній пробі терапевтичних моноклональних антитіл. Клінічна фармакологія у розробці лікарських засобів. Сан-Дієго, Каліфорнія: Wiley; 2017 рік.
Psallidas I, Kalomenidis I, Porcel JM, Robinson BW, Stathopoulos GT. Злоякісний плевральний випіт: від лавки до ліжка. Eur Respir Rev. 2016; 25 (140): 189.
Chen Y-M, Yang W-K, Whang-Peng J, Kuo BI-T, Perng R-P. Підвищення рівня інтерлейкіну-10 при злоякісному плевральному випоті. Грудна клітка. 1996; 110 (2): 433–6.
Hooper CE, Elvers KT, Welsh GI, Millar AB, Maskell NA. VEGF та sVEGFR-1 при злоякісному плевральному випоті: взаємозв'язок із результатами виживання та плевродезу. Рак легенів. 2012; 77 (2): 443–9.
Thomas R, Cheah HM, Creaney J, Turlach BA, Lee YCG. Поздовжнє вимірювання біохімії плевральної рідини та цитокінів при злоякісному випоті плеври. Грудна клітка. 2016; 149 (6): 1494–500.
Dore P, Lelievre E, Morel F, Brizard A, Fourcin M, Clement C, et al. IL-6 та розчинні рецептори IL-6 (sIL-6R та sgp130) у плевральних випотах людини: масове вироблення IL-6 незалежно від основних захворювань. Clin Exp Immunol. 1997; 107 (1): 182–8.
Lu H, Clauser KR, Tam WL, Frose J, Ye X, Eaton EN та ін. Ніша стовбурових клітин раку молочної залози, підтримувана юкстакриновою сигналізацією від моноцитів та макрофагів. Nat Cell Biol. 2014; 16 (11): 1105–17.
Fujino S, Yokoyama A, Kohno N, Hiwada K. Interleukin 6 - це аутокринний фактор росту нормальних мезотеліальних клітин плеври людини. Am J Respir Cell Mol Biol. 1996; 14 (6): 508–15.
Malhotra D, Fletcher AL, Astarita J, Lukacs-Kornek V, Tayalia P, Gonzalez SF та ін. Транскрипційне профілювання строми із запалених та спокійних лімфатичних вузлів визначає імунологічні ознаки. Nat Immunol. 2012; 13 (5): 499–510.
Mittendorf EA, Philips AV, Meric-Bernstam F, Qiao N, Wu Y, Harrington SM, et al. Експресія PD-L1 при потрійному негативному раку молочної залози. Рак Імунол Res. 2014 рік.
Scheller J, Chalaris A, Schmidt-Arras D, Rose-John S. Про- та протизапальні властивості цитокіну інтерлейкіну-6. Biochim Biophys Acta. 2011; 1813 (5): 878–88.
Lo C-W, Chen M-W, Hsiao M, Wang S, Chen C-A, Hsiao S-M та ін. Транссигналізація IL-6 у формуванні та прогресуванні злоякісного асциту при раку яєчників. Рак Res. 2011; 71 (2): 424.
Lee SO, Yang X, Duan S, Tsai Y, Strojny LR, Keng P, et al. IL-6 сприяє зростанню та епітеліально-мезенхімальному переходу клітин CD133 + недрібноклітинного раку легені. Oncotarget. 2016; 7 (6): 6626–38.
Андо К, Такахасі Ф, Мотодзіма С, Накашима К, Канеко Н, Хоші К та ін. Можлива роль тоцилізумабу, антитіла до рецептора інтерлейкіну-6, у лікуванні ракової кахексії. J Clin Oncol. 2013; 31 (6): e69–72.
Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, et al. Химерні Т-клітини рецептора антигену для стійких ремісій при лейкемії. N Engl J Med. 2014; 371 (16): 1507–17.
Jin H-T, Ahmed R, Okazaki T. Роль PD-1 у регулюванні імунітету Т-клітин. В: Ахмед Р, Хонджо Т, редактори. Негативні ко-рецептори та ліганди. Берлін, Гейдельберг: Springer Berlin Heidelberg; 2011. с. 17–37.
Ruf P, Kluge M, Jager M, Burges A, Volovat C, Heiss MM, et al. Фармакокінетика, імуногенність та біоактивність терапевтичного антитіла катумаксомаб внутрішньочеревно вводять хворим на рак. Br J Clin Pharmacol. 2010; 69 (6): 617–25.
Подяки
Фінансування
Ця робота підтримується Фондом торакальної хірургії для досліджень та освіти Науково-дослідний грант STS (7/2016–7/2018), BC032981, BC044784, W81XWH-12-1-0415 та BC132245_W81XWH-14-0258 від Міністерства оборони, Національний Грант Інституту раку R21 CA191647, Фонд «Проблиск надії» та Фонд Девіда Даунінга.
Наявність даних та матеріалів
Інформація про автора
Альберт Д. Донненберг та Віра С. Донненберг зробили однаковий внесок у цю роботу.
Приналежності
Кафедра медицини, відділення гематології-онкології, Університет Пітсбурзької школи медицини, Пітсбург, Пенсільванія, США
Альберт Д. Донненберг
Кафедра кардіоторакальної хірургії, Відділ торакальної та передньої кишки, Медична школа Університету Пітсбурга, Пітсбург, Пенсільванія, США
Джеймс Д. Лукетіч, Радєєв Дхупар та Віра С. Донненберг
Департамент фармацевтичних наук, Університет Пітсбурзької фармацевтичної школи, Пітсбург, Пенсільванія, США
Віра С. Донненберг
Кафедри медицини та інфекційних хвороб та мікробіології, Університет Пітсбурга, Медичний факультет та Вища школа охорони здоров'я, Центр раку Хіллмана, Дослідницький павільйон, 5117 Center Ave, Пітсбург, Пенсільванія, 15213, США
Альберт Д. Донненберг
Відділи кардіоторакальної хірургії та фармацевтичних наук, Університет Пітсбурга, Медичні та фармацевтичні школи, Онкологічний центр Hillman, Дослідницький павільйон, 5117 Center Ave, Suite 2.42, Пітсбург, Пенсільванія, 15213, США
Віра С. Донненберг
Ви також можете шукати цього автора в PubMed Google Scholar
- Стратегія лікування дитячої гігантської муцинозної цистаденоми Звіт про випадок
- Лікування злоякісних гліом кетогенними або калорійними дієтами Систематичний огляд
- Важливість відновлення маси жирових відкладень у лікуванні нервової анорексії
- Систематичний огляд шлункової електростимуляції при лікуванні ожиріння Експертний огляд медичних наук
- Причини, симптоми та лікування теніозу