Короткочасне споживання дієти з високим вмістом жиру збільшує сприйнятливість господаря до інфекції Listeria monocytogenes
Ванесса Лас Герас
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
2 Школа мікробіології, Університетський коледж Корка, Корк, Ірландія
Адам Г. Клуні
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
Страх Дж. Райан
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
Рауль Кабрера-Рубіо
3 Центр досліджень їжі Teagasc, Мурепарк, Фермой, Корк, Ірландія
Пет Г. Кейсі
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
Кара М. Хьюстон
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
Хорхе Пінейро
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
2 Школа мікробіології, Університетський коледж Корка, Корк, Ірландія
Джастіна К. Рудкін
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
2 Школа мікробіології, Університетський коледж Корка, Корк, Ірландія
Сільвія Мелгар
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
Пол Д. Коттер
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
3 Центр досліджень їжі Teagasc, Мурепарк, Фермой, Корк, Ірландія
Колін Хілл
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
2 Школа мікробіології, Університетський коледж Корка, Корк, Ірландія
Кормак Г. М. Гахан
1 APC Microbiome Ireland, University College Cork, Корк, Ірландія
2 Школа мікробіології, Університетський коледж Корка, Корк, Ірландія
4 Школа фармації, Університетський коледж Корка, Корк, Ірландія
Пов’язані дані
Сировинні зразки 16S-рРНК доступні на SRA під номером підключення SRP139708.
Анотація
Передумови
Відомо, що західна дієта, що включає високу калорійність тваринних жирів, впливає на розвиток патологічних запальних станів. Однак порівняно невелика увага приділяється наслідкам таких дієт для прогресування інфекційних захворювань. Тут ми досліджували вплив дієти з високим вмістом жиру (HF) на параметри, що впливають на інфекцію Listeria monocytogenes у мишей.
Результати
Ми визначили, що короткочасне вживання ВЧ дієти збільшує кількість келихоподібних клітин, відомого місця зв'язування збудника, в кишечнику, а також індукує глибокі зміни мікробіоти та сприяє профілактиці профілю експресії прозапального гена у господаря. Фізіологічні зміни господаря відповідали суттєво підвищеній сприйнятливості до пероральної інфекції L. monocytogenes у мишей, які отримували високочастотну дієту щодо тварин з низьким вмістом жиру (LF) - або чау. До зараження лістерією короткочасне вживання ВЧ дієти підвищувало рівень Firmicutes, включаючи копрокок, бутирицикок, туріцибактер та клостридій XIVa. Під час активного зараження L. monocytogenes зміни мікробіоти ще більше перебільшувались, але запальні реакції господаря значно зменшувались порівняно з групами, інфікованими Listeria, або групами, що годували чау, що свідчить про глибоке загартування реакції господаря під впливом інфекції в контексті ВЧ дієта. Ефекти дієти були помітні за межами кишечника, оскільки ВЧ-дієта також підвищувала чутливість мишей до системної інфекції та змінювала профілі експресії генів у печінці.
Висновки
Ми застосували системний підхід для виявлення впливу ВЧ дієти на інфекцію L. monocytogenes шляхом аналізу реакцій господаря та змін мікробіоти (як до, так і після зараження). Загалом, результати вказують на те, що короткочасне споживання вестернізованої дієти здатне суттєво змінити сприйнятливість господаря до інфекції L. monocytogenes одночасно зі змінами у фізіологічному ландшафті господаря. Отримані дані свідчать про те, що при розробці моделей, що відображають інфекційні захворювання людини, слід враховувати дієту.
Електронний додатковий матеріал
Інтернет-версія цієї статті (10.1186/s40168-019-0621-x) містить додаткові матеріали, доступні для авторизованих користувачів.
Передумови
Збільшення споживання «вестернізованої» дієти, що включає високу калорійність споживання жирів та зменшення споживання ферментованої клітковини, пов’язане із сучасною пандемією хронічних запальних станів, таких як ожиріння, діабет 2 типу, запальні захворювання кишечника та алергічна астма [1] . Дієта, багата жирами тваринного походження, може зменшити шлунково-кишкову бар’єрну функцію, впливати на склад мікробіоти та змінювати шлунково-кишкові та системні запальні реакції [1–3]. Такі глибокі фізіологічні реакції у господаря, ймовірно, будуть підґрунтям для патологічних змін, особливо на поверхнях слизової [1]. Однак потенціалу дієти із високим вмістом жиру, яка вестернізується, впливати на прогресування інфекційних захворювань приділяється порівняно мало уваги. Ми запропонували дослідити це явище за допомогою Listeria monocytogenes, харчового збудника, який викликає серйозне інвазивне захворювання (лістеріоз) у сприйнятливих господарів, все частіше асоціюється з великими спалахами загальних джерел і має високий рівень смертності.
L. monocytogenes широко досліджувались як модельний внутрішньоклітинний збудник з метою виявлення біологічних механізмів, що беруть участь у вторгненні клітин хазяїна, внутрішньоклітинному паразитизмі та результуючому імунітеті господаря [4]. Більшість таких досліджень використовували моделі культури клітин або системну мишачу інфекцію. Однак все більше досліджень почали зосереджуватись на шлунково-кишковій фазі інфекції. Зрозуміло, що збудник може відчувати і реагувати як на місцеві фізико-хімічні сигнали [5–7], так і на наявність автохтонних організмів [6] у шлунково-кишковому середовищі, і адаптація середовища, ймовірно, впливатиме на здатність збудника виживати і тимчасово реплікуються в кишечнику [5, 7]. Подальша інвазія господаря відбувається через взаємодію між мікробним інтерналіном A (InlA) та E-кадгерином господаря (E-cad), процес, який є найбільш ефективним поблизу келихоподібних клітин, де E-cad, швидше за все, буде доступним [8 ]. Крім того, мікробіота відіграє важливу роль у забезпеченні бар'єру для інфекції та у місцевій локальній модифікації імунної відповіді хазяїна на патоген [6, 9-11].
Ми застосували системний підхід для вивчення впливу ВЧ дієти на ряд параметрів, пов’язаних з інфекційним процесом як до, так і після зараження L. monocytogenes. Зокрема, ми вивчали як мікробіоти, так і фізіологічні зміни господаря, що впливають на дієту, як безпосередньо перед зараженням, так і в піковий період активної інфекції. Отримані нами дані вказують на те, що відносно короткочасна зміна дієти до вестернізованої ВЧ дієти збільшує сприйнятливість до оральної інфекції L. monocytogenes одночасно зі значно зміненим фізіологічним ландшафтом як у шлунково-кишковому тракті, так і в печінці. Крім того, наші висновки показують, що дієта впливає лише на системну фазу інфекції, що свідчить про глибокі загальносистемні зміни в фізіології господаря, які змінюють сприйнятливість до інфекції.
Результати і обговорення
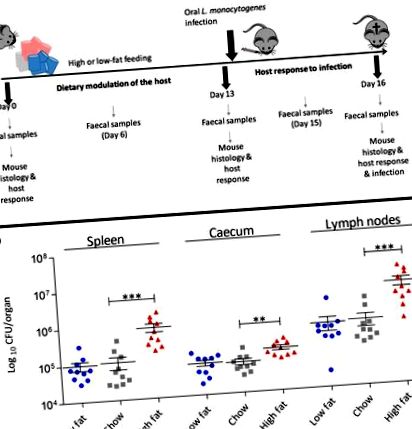
Дієта з високим вмістом жиру збільшує сприйнятливість до пероральної інфекції L. monocytogenes
Дієтальна модуляція фізіології господаря до зараження
Відомо, що дієта впливає на фізіологію господаря, і значні дослідження зосереджувались на змінах, пов’язаних із початком ожиріння у мишей, які харчувались ВЧ-дієтою [20]. На відміну від цього, порівняно небагато досліджень досліджували шлунково-кишкові або системні зміни, що відбуваються до початку ожиріння в цій моделі [21]. Тому ми досліджували вплив різних дієт на фізіологічну відповідь мишей після 2 тижнів дієтичного втручання, безпосередньо перед зараженням ротовою порожниною L. monocytogenes. Це є показником найближчого оточення, в яке вводиться лістерія, і воно повинно встановити раннє зараження. Ми особливо зупинились на параметрах, які, як відомо, відіграють певну роль у патогенезі L. monocytogenes.
Сліпий гістологічний аналіз вказував на значне збільшення кількості кишкових келихоподібних клітин у мишей, які харчувались високочастотною дієтою, як щодо груп, що харчувались НЧ та чау (рис. 2, а). Наші дані свідчать про ранню реакцію кишечника на ВЧ дієтичне харчування, яке передбачає генерацію келихоподібних клітин, і підтверджують попередні дослідження, що показують підвищену кількість келихоподібних клітин, пов’язану з початком ожиріння, хоча і на значно пізнішому етапі ВЧ дієтичного харчування [22]. Оскільки келихоподібні клітини є переважним місцем інвазії L. monocytogenes, включаючи штами L. monocytogenes, що експресують муринізований InlA (модель, використана в цьому дослідженні) [8, 16], підвищена кількість келихоподібних клітин, яка спостерігається в нашій системі, швидше за все, принаймні частково, уможливити посилене зараження.
Загальна транскрипція генів, що кодують білки з щільним з'єднанням в клубовій кишці, була знижена у тварин, що годувались ВЧ, порівняно з іншими групами. Експресія білків із щільним з'єднанням може бути використана як оцінка бар'єрної функції, і раніше було показано, що вона знижується у мишей із ожирінням [34, 35]. Короткотермінові дослідження на гризунах демонструють зниження рівня клаудіну-7 після 4 тижнів ВЧ дієти [36], але жодних змін у Зо-1 на 3 дні [37] або 1 тиждень [35] ВЧ дієтичного харчування, що передбачає час -залежні зміни, які ми спостерігаємо через 2 тижні дієтичного втручання. Нарешті, експресія генів, що кодують mN-cad [8] та MET [38], відомі місця зв’язування факторів вторгнення L. monocytogenes InlA та InlB у нашій мишачій моделі зараження, не були змінені в клубовій кишці HF-мишей, але були значно збільшився в печінці цих тварин у порівнянні з групами, що харчуються НЧ або чау. Ген, що кодує E-cad, був знижений в клубовій кишці разом з іншими білками епітеліального з'єднання. Загалом, ми демонструємо значні зміни шлунково-кишкового середовища завдяки короткочасному ВЧ-годуванню безпосередньо перед зараженням у нашій модельній системі із багатьма змінами, потенційно важливими для патогенезу L. monocytogenes.
Короткочасна ВЧ дієта змінює мікробіоти кишечника
Для подальшого вивчення будь-яких потенційних зв'язків між змінами мікробіоти та реакцією хазяїна на дієтичне харчування ми корелювали зміни у експресії гена господаря з великою кількістю окремих членів фекальної мікробіоти на рівні роду (рис. 2, е). Butyricicoccus, Clostridium XIVa, Streptococcus та Mucispirillum були більш поширеними у мишей, які харчувались високочастотною дієтою, і їх велика кількість корелювала з індукцією генів, що кодують запальні реакції господаря. Раніше повідомлялося про зв'язок між цими родами та запальними станами [40, 44]. Парабактероїдів та бактероїдів було порівняно більше у мишей, що годувались НЧ, і раніше повідомлялося, що вони беруть участь у підтримці імунного гомеостазу в кишечнику та підтримці цілісності кишкового бар’єру [45, 46]. У цьому документі ми ідентифікували роди (наприклад, Clostridium XI, Clostridium XIVa, Enterococcus spp.), На які впливають зміни дієти СН та корелюють з експресією генів, що кодують рецептори L. monocytogenes, а також генів, пов’язаних із запаленням в клубовій кишці та печінці.
Дієта з високим вмістом жиру змінює фізіологічну реакцію на інфекцію L. monocytogenes
Кореляція мікробних родів з експресією гена хазяїна (рис. 3, f) підкреслює загальну знижену регуляцію експресії гена хазяїна після зараження лістерією у групі, що годується HF. Спрямовані зміни до конкретних мікробних родів, на які впливає ВЧ-дієта (рис. 3, f), були подібними до тих, які, як виявляється, спричинені лише дієтою (рис. 2, е). Однак кореляції з асоційованими профілями експресії генів хазяїна, як правило, були зворотними, вказуючи на те, що інфекція L. monocytogenes у контексті ВЧ дієти була значним негативним модулятором вибраних генів господаря.
Дієта з високим вмістом жиру збільшує сприйнятливість до системної інфекції L. monocytogenes
Хоча це дослідження показало, що лише дієта є рушієм фізіологічних змін в клубовій кишці, воно також підкреслило несподіване збільшення експресії генів, що кодують місця зв'язування L. monocytogenes (включаючи E-Cad, N-Cad, gC1qR) у печінці (рис. . 2 б). Ми також відзначили зміни рівнів експресії генів, що кодують цитокіни в печінці, які мають потенціал впливати на стійкість до інфекції, включаючи збільшення транскрипції протизапального цитокіну IL-10 у тварин, які харчуються ВЧ-дієтою (рис. 2, b) . Оскільки ці зміни відбулися до зараження, ми продовжили визначати вплив дієти на системну фазу зараження. Внутрішньочеревинну (ІП) інфекцію L. monocytogenes EGDe m вводили через 2 тижні дієтичної модуляції (рис. 4). Результати виявляють чіткий вплив високочастотної дієти на системну фазу L. monocytogenes порівняно з дієтами чау та НЧ. Це явище спостерігалося як для муринованого EGDe m, так і для штамів EGDe дикого типу (додатковий файл 6: Рисунок S6) L. monocytogenes, що свідчить про те, що цей ефект обумовлений не лише збільшенням mN-Cad. Дані свідчать про те, що вестернізована ВЧ дієта змінює фізіологію господаря поза кишечником, щоб підвищити сприйнятливість до інфекційних захворювань.
Підвищений вміст жиру в організмі збільшує сприйнятливість господаря до системної інфекції L. monocytogenes EGDe m. Бактеріальне навантаження лістерії в селезінці та печінці мишей C57BL/6, яких годували протягом 13 днів різними дієтами та згодом інфікували шляхом ІР (n = 10). Стандартне відхилення від середнього, статистичний аналіз проводили за допомогою одностороннього тесту ANOVA та множинного порівняльного тесту Даннета щодо дієти чау. *** p m, центрифугували (7000 × g протягом 5 хв), двічі промивали PBS і ресуспендували в PBS. Інокулюм на 200 мкл містив 3,2 × 10 9 КУО для ІГ-інфекції та 9 × 10 4 для ІР-інфекції. Прогресування інфекції спостерігалося протягом 3-х днів [13, 53], при цьому миші дотримувались певної дієти для цього періоду. Мишей евтаназували, а внутрішні органи асептично видаляли та гомогенізували за допомогою мішків для шлунку та PBS. Для підрахунку КУО на орган розведення висівали на агарові тарілки BHI (інфузія серця мозку). Після зараження IG, на 14-й день (1-й день після зараження) і 16 (3-й день після зараження), фекальні гранули збирали і висівали на КУО для визначення випадіння L. monocytogenes.
Екстракція РНК та кількісний RT-PCR аналіз
Зразок печінки та клубової кишки збирали для аналізу регуляторної реакції хазяїна як на дієту, так і на інфекцію (аналіз транскриптома). Зразки стабілізували за допомогою RNAlater (Sigma) і зберігали при - 80 ° C до повного вилучення РНК (RNeasy Plus Universal Mini Kit, Qiagen). Загальну вилучену РНК обробляли ДНКазою (TURBO DNA-free ™ Kit, Ambion), і транскриптомічний аналіз проводили за допомогою RT-PCR (Transcriptor Reverse Transcriptase, Roche). Протокол qPCR здійснювався за допомогою LightCycler® 480 Probes Master (Roche) з універсальною бібліотекою зондів від Roche. Праймери викладені в додатковому файлі 7: Таблиця S1. Використовувана установка ампліфікації складала 45 пробіжок на 384-лункових пластинах із форматом виявлення зонда гідролізу MonoColor.
Зразки фекалій та профілювання мікробіоти
Фарбування тканин та мікроскопія
Статистичний аналіз
Статистичний аналіз проводили за допомогою Prism 5 (програмне забезпечення Graph-Pad). Для порівняння засобів двох груп використовували тест Манна-Уітні. Односторонній ANOVA з тестом множинного порівняння Даннета використовували для парного порівняння засобів із більш ніж двох груп стосовно контролю, або з пост-спеціальним тестом Тукі для порівняння середніх значень щодо середнього значення контрольної групи.
Якщо значення р опускається вище 0,05, середні відмінності вважалися статистично незначимими (NS). Для статистично значущих відмінностей * p (306K, pdf)
Рисунок S1. Склад дієти та вага мишей до зараження ротовою порожниною. (PDF 306 кб)
Рисунок S2. Збільшення харчового жиру з тваринного джерела збільшує сприйнятливість господаря до оральної інфекції Listeria monocytogenes EDGe m pIKM2 (PDF 413 kb)
Рисунок S3. Оцінка різноманітності всередині вибірки (альфа-різноманітність) у групах, що харчуються дієтами з високим вмістом жиру або низьким вмістом жиру. (PDF 498 кб)
Рисунок S4. метрики β-різноманітності. (PDF 434 кб)
Рисунок S5. Оцінка за гістопатологію. (PDF 490 кб)
Рисунок S6. Підвищений жировий жир компрометує системну імунну відповідь господаря та підвищує сприйнятливість господаря до ІР-інфекції з EGDe L. monocytogenes дикого типу. (PDF 355 кб)
Таблиця S1. Набори букварів для аналізу транскриптомів. (PDF 370 кб)
Подяки
Ми вдячні за технічну допомогу та керівництво Калаймати Говіндараджана, Бхаг'ї Рекхи, Анни Голубєвої та Джонатана Кіна.
Фінансування
Це дослідження фінансувалось Програмою досліджень та інновацій Європейського Союзу «Горизонт 2020» в рамках угоди про надання гранту Марії Склодовської-Кюрі № 641984 за рахунок фінансування консорціуму List_MAPS. Ми також визнаємо фінансування та підтримку Наукового фонду Ірландії (SFI) у формі гранту центру (APC Microbiome Ireland grant SFI/12/RC/2273).
Наявність даних та матеріалів
Сировинні зразки 16S-рРНК доступні на SRA під номером підключення SRP139708.
Внески авторів
VLH проводив експериментальну роботу, розробляв експерименти та аналізував дані. VLH та CG написали статтю із значним внеском від усіх авторів. AC, FR та RR проводили біоінформатичний аналіз. PGC та CH розробили та провели дослідження інфекції із значним входом VLH. Гістологічний аналіз проводили VLH, JP та SM. JR, SM, PC, CH та CG розробили та скоординували дослідження та проаналізували дані. Остаточний рукопис був прочитаний та схвалений усіма авторами.
Примітки
Схвалення етики та згода на участь
Усі процедури на тваринах проводились у відповідності до керівних принципів Європейської комісії щодо поводження з лабораторними тваринами (директива 2010/63/ЄС) відповідно до дозволів, виданих Органом регулювання охорони здоров’я (HPRA, Ірландія) на використання тварин. для наукових цілей та затверджена Комітетом з етики експериментів на тваринах Університетського коледжу Корка.
Конкуруючі інтереси
Автори заявляють, що у них немає конкуруючих інтересів.
Примітка видавця
Springer Nature залишається нейтральним щодо юрисдикційних вимог в опублікованих картах та інституційних приналежностей.
- Чи потрібно їсти дієту з високим вмістом жиру для тіла з низьким вмістом жиру
- Дефіцит Per-Arnt-Sim кінази (PASK) збільшує клітинне дихання за звичайної дієти та
- Мій досвід короткочасних дієт - CalorieBee - дієта; Вправа
- Кількісна оцінка транслокації Listeria monocytogenes у щурів за допомогою похідних оксиду азоту в сечі
- PLOS ONE добавка марганцю оленям при збалансованому харчуванні збільшує енергію впливу та вміст