Контроль судом за допомогою кетогенної дієти, пов’язаної із середньоланцюговими жирними кислотами
Пішан Чанг
Центр біомедичних наук, Школа біологічних наук, Лондонський університет Королівського Холлоуей, Ігем, TW20 0EX, Великобританія
Ніколь Тербах
Центр біомедичних наук, Школа біологічних наук, Лондонський університет Королівського Холлоуей, Ігем, TW20 0EX, Великобританія
Нік Завод
b Центр токсикології, Факультет охорони здоров'я та медичних наук, Університет Суррея, Гілдфорд, GU2 7XH, Великобританія
Філіп Е. Чен
Центр біомедичних наук, Школа біологічних наук, Лондонський університет Королівського Холлоуей, Ігем, TW20 0EX, Великобританія
Метью С. Уокер
c Відділ клінічної та експериментальної епілепсії, Інститут неврології, Університетський коледж Лондона, WC1N 3BG, Великобританія
Робін С.Б. Вільямс
Центр біомедичних наук, Школа біологічних наук, Лондонський університет Королівського Холлоуей, Ігем, TW20 0EX, Великобританія
Анотація
Ця стаття є частиною спеціального випуску „Нові цілі та підходи до лікування епілепсії”.
Основні моменти
► Середньоланцюгові прямі та розгалужені жирні кислоти досліджували для контролю нападів in vitro. ► Для цих сполук була показана структурна специфічність. ► Були вивчені побічні ефекти щодо активних сполук, що контролюють судоми. ► Для цих сполук було показано контроль нападів in vivo, седацію та нейропротекцію. ► Середньоланцюгові жирні кислоти, пов’язані з кетогенною дієтою МСТ, можуть брати активну участь у контролі судом.
1. Вступ
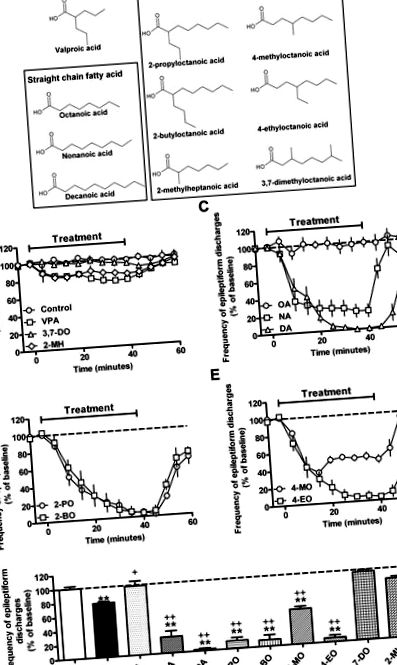
Кетогенна дієта із тригліцеридами із середньою ланцюгом (МСТ) забезпечила один з найефективніших терапевтичних підходів для дітей із стійкою до наркотиків епілепсією (Kossoff et al., 2009; Liu, 2008; Neal et al., 2009; Rho and Stafstrom, 2012; Sills та ін., 1986b; Vining та ін., 1998). Однак його використання було обмежене поганою переносимістю, особливо у дорослих, що викликало необхідність у розробці нових методів лікування, заснованих на цій дієті. Дієта MCT спричинює зростання утворення кетонового тіла, але це погано корелює з контролем судом (Likhodii et al., 2000; Thavendiranathan et al., 2000). Це також спричинює накопичення середньоланцюгових жирних кислот у плазмі крові (зокрема, октанової та деканової кислот, рис. 1 А) (Haidukewych et al., 1982; Newport et al., 1979; Sills et al., 1986a), хоча Роль цих жирних кислот, якщо такі є, у контролі нападів залишається незрозумілою.
Коротколанцюгова жирна кислота вальпроєва кислота (VPA, 2-пропілпентанова кислота) є широко використовуваним протиепілептичним препаратом широкого спектра дії, але є неоптимальною через численні побічні ефекти: Два найбільш значущих з них - тератогенність (Jentink et al., 2010; Koren et al., 2006), що корелювало з інгібуванням активності гістондеацетилази (Gottlicher et al., 2001; Gurvich et al., 2004; Phiel et al., 2001), хоча тут можуть функціонувати й інші механізми; та гепатотоксичність (Lagace et al., 2005; Stephens and Levy, 1992), потенційно зумовлена ефектом на β-окислення (Elphick et al., 2011; Silva et al., 2008). Крім того, жирні кислоти зі структурами, пов'язаними з VPA, також були пов'язані зі значними седативними властивостями, часто перешкоджаючи перетворенню в клінічні випробування (Bojic et al., 1996; Keane et al., 1983; Palaty and Abbott, 1995). Ці ефекти вплинули на пошук нових структур жирних кислот з підвищеною ефективністю проти нападів і з кращим профілем побічних ефектів, ніж VPA.
У пошуках нових методів контролю нападів недавнє дослідження показало, що дія VPA передбачає модифікацію обороту фосфоїнозитолу в соціальній амебі Dictyostelium discoideum (Chang et al., 2011). Виходячи з цього механізму, групу середньоланцюгових жирних кислот, що включають сполуки, пов'язані з дієтою МСТ, та нове сімейство споріднених розгалужених жирних кислот було визначено як потенційні нові препарати для лікування епілепсії. Тому краще розуміння цих сполук може допомогти у виробництві більш ефективних методів лікування епілепсії.
У цьому дослідженні ми досліджували ефективність ряду жирних кислот із середньою прямою та розгалуженою ланцюгом при контролі нападів за допомогою модельної системи in vitro, що дозволяє точно дозувати препарат, уникаючи таких факторів, як метаболізм/гематоенцефалічний бар'єр та швидка пропускна здатність, у порівнянні до VPA. Ми використовували модель in vitro, в якій VPA у високих дозах (2 мМ) демонструє лише часткову ефективність (Armand et al., 1998), щоб визначити сполуки, які потенційно перевершують VPA. Потім ми оцінили отримані активні сполуки для інгібування гістонової деацетилази та токсикології печінки, щоб визначити дві перспективні жирні кислоти із середнім ланцюгом для подальшого дослідження. Ці два з'єднання продемонстрували дозозалежний контроль нападів у моделі in vitro (PTZ) та більш потужний контроль нападів, ніж VPA in vivo, використовуючи стійкий до лікарських засобів епілептичний статус (модель стимулювання перфорантного шляху) (Holtkamp et al., 2001). Крім того, ми показуємо, що одна з цих сполук викликає меншу седацію та має більший нейропротекторний (потенційно модифікуючий хворобу) ефект, ніж VPA. Таким чином, наші дані вказують на ряд жирних кислот, які демонструють підвищену ефективність у контролі нападів та потенційно зменшені побічні ефекти порівняно з наявним на сьогодні протиепілептичним препаратом VPA.
2. Матеріали та методи
2.1. Тварини
Самців щурів Спрег-Доулі (SD) утримували в контрольованих умовах навколишнього середовища (24-25 ° C; 50-60% вологості; 12 год цикл світло/темрява) з вільним доступом до їжі та води. Всі експерименти проводились відповідно до керівних принципів Закону про тварини (про наукові процедури) 1986 р. Були зроблені всі зусилля, щоб мінімізувати страждання тварин та зменшити кількість тварин, що використовуються.
2.2. Електрофізіологія in vitro
2.3. Аналіз активності HDAC
Активність гістондеацетилази (HDAC) аналізували за допомогою комерційного аналізу in vitro, набору активності HDAC для виявлення лікарських засобів (Biomol, Plymouth Meeting, PA). Аналізи проводили при кімнатній температурі згідно з протоколом виробника, використовуючи трихостатин А (інгібітор HDAC; 1 мкМ) як позитивний контроль. Дані нормалізували для контролів (без VPA або тестуючих сполук) для кожного експерименту.
2.4. Аналіз печінкової токсичності
В аналізі печінкової токсичності використовувались клітини Huh7, люб’язно надані доктором Стівом Гудом (GlaxoSmithKline), культивованим у модифікованому середовищем орела Дульбекко (DMEM) з l-глутаміном та фенольним червоним, що містить 10% плодової бичачої сироватки, 1% незамінних амінокислот, 100 Од/мл пеніциліну та 100 мкг/мл стрептоміцину. Всі реагенти для культури клітин були придбані у Invitrogen (Пейслі, Великобританія). Клітини висівали на 1 × 10 4 клітин на лунку в 96-лункові планшети протягом ночі і вирощували приблизно до 80% злиття клітин до впливу 0,01–5 мМ досліджуваної сполуки (або контроль носія підтримував нижче 0,5% (об/об)) для всіх умови). Після впливу досліджуваного з'єднання протягом 24 годин додавали 0,5 мг/мл 3- (4,5-диметилтіазол-2-іл) -2,5-дифенілтетразолію броміду (МТТ) і клітини інкубували ще 2 години, щоб забезпечити розвиток кольору . Потім середовище відсмоктували і замінювали 100 мкл ДМСО на лунку, а абсорбцію читали при 540 нм.
2.5. Модель епілептичного статусу in vivo
Дані in vivo аналізували повторним аналізом ANOVA з часом вимірювання як фактор, що знаходиться в межах суб’єкта, і лікування як фактор між суб’єктами. Постійний аналіз лікування проти контролю проводили за допомогою двостороннього t-тесту Даннета, а порівняння між лікуваннями проводили за допомогою тесту Tukey HSD у SPSS (версія 20).
Для гістології тварин приносили в жертву через 2 місяці після SSSE із передозуванням пентобарбіталу натрію (500 мг/кг в/в) (Fort dodge Animal Health, Саутгемптон, Великобританія), а мозок занурювали у 4% параформальдегіду в 0,1 М фосфатно-забуференному фізіологічний розчин pH 7,4 (PBS) протягом 24 годин, а потім зберігають при 4 ° C перед перенесенням у PBS з 30% сахарозою у вигляді розчину після фіксації. Зрізи мозку (товщиною 40 мкм) вирізали за допомогою віброслікера (Leica VT 1000S Microsystems, Вецлар, Німеччина), а фарбування по Ніслю використовували для підтвердження положення електродів та вивчення ступеня нейродегенерації в гілусі за допомогою аналізу частинок у програмі ImageJ ( це обчислює частку гілусу, в якому присутні ядра клітин) у порівнянних зрізах від кожної тварини (усереднені дані з чотирьох зрізів на обробку).
2.6. Седативний експеримент
VPA, 4-метилоктанову кислоту та нонаєву кислоту вводили (внутрішньовенно) в дозі 200, 400 або 600 мг/кг самцям щурів SD. Ступінь седації оцінювали за допомогою усталеної шкали: 0, спонтанний рух; 1, переривчастий спонтанний рух; 2, відсутність спонтанного руху; 3, втрата слухового рефлексу; 4, втрата рогівкового рефлексу; 5, втрата реакції на защемлення хвоста (Fisher et al., 2004; Holtkamp et al., 2001; Lee et al., 1998). Рівень седації реєстрували через 10 хв після в/в. ін'єкції, а потім кожні 30 хв протягом 3 год.
2.7. Статистичний аналіз
У всіх наданих даних результати представлені як середнє значення ± SEM. Статистичне порівняння проводили за допомогою критерію Манна – Уітні та одного способу ANOVA з подальшим Даннетом для пост-хок-аналізу з використанням SPSS.
3. Результати
3.1. Вплив жирних кислот із середнім ланцюгом на активність контролю нападів in vitro
Щодо кетогенної дієти MCT, тут слід зазначити, що концентрація деканової кислоти в сироватці крові пацієнтів, які дотримуються дієти (середня концентрація 157 мкМ (Haidukewych et al., 1982)), нижча за таку, що застосовується в наших in vitro аналіз. Повторюючи ці експерименти щодо контролю епілептиформного розряду з використанням нижчої концентрації деканоєвої кислоти (100 мкМ), ми виявили значне зменшення частоти епілептиформних розрядів (додатковий рис. S2), що перевищувало еквімолярний VPA. Крім того, ефективність деканової кислоти також була вищою, ніж потенція вальноктаміду (VCD; структуру див. На додатковому рис. S1) - похідного VPA другого покоління (Bialer and White, 2010). Ці дані вказують на те, що деканоєва кислота при концентраціях, виявлених у пацієнтів під час лікування кетогенною дієтою, може забезпечити покращений контроль нападів порівняно з сучасними методами лікування та лікування нового покоління.
3.2. Вплив жирних кислот із середнім ланцюгом на активність гістондеацетилази людини (HDAC)
VPA та пов’язані з ним жирні кислоти добре задокументовані для пригнічення активності HDAC (Gottlicher et al., 2001; Gurvich et al., 2004; Phiel et al., 2001), що, ймовірно, може спричинити тератогенність і, таким чином, обмежувати їх використання під час вагітності. (Jentink et al., 2010; Koren et al., 2006). Таким чином, ми перевірили цю важливу відповідальність за побічні ефекти у сполуках, що демонструють покращене інгібування епілептиформної активності в моделі PTZ порівняно з VPA (рис. 2). Як і слід було очікувати, VPA показав дозозалежне пригнічення активності HDAC, зростаючи до 82,9 ± 1,8% пригнічення при 10 мМ. Деканоева кислота не виявляла інгібування HDAC при низьких концентраціях, але подібна інгібуюча активність до VPA при 10 мМ (79,3 ± 16,5% інгібування). На відміну від цього, нонанова кислота виявляла мінімальну інгібуючу активність при всіх досліджуваних концентраціях (до 10 мМ). Як передбачалося в інших дослідженнях (Eikel et al., 2006), середньоланцюгові жирні кислоти, розгалужені на другому вуглеці, також виявляють високу інгібуючу активність HDAC (2-пропілоктанова кислота та 2-бутилоктанова кислота); однак сполуки з розгалуженням на четвертому вуглеці не виявляли інгібування HDAC до 10 мМ. Ці дані показують, що деканоєва кислота та сполуки, розгалужені на другому вуглеці, виявляють небажане інгібування HDAC, тоді як це не видно у споріднених сполуках, що містять гілку на четвертому вуглеці.
- Стратегії досягнення здорової дієти та зменшення здоров’я наджирних і насичених жирних кислот -
- Омега-3 жирні кислоти та ожиріння SciTechnol
- Добавки з вітамінами групи В або жирними кислотами n-3 та симптоми депресії в серцево-судинній системі
- Патофізіологія та еволюційні аспекти харчових жирів та довголанцюгових поліненасичених жирних кислот
- Ожиріння та вільні жирні кислоти (ЗЖЖ)