Компенсаційне збільшення ваги через дофамінергічну гіпофункцію: нові дані та власні випадкові спостереження
Анотація
З'являється все більше доказів про роль дофаміну у розвитку ожиріння. Більш конкретно, дофамінергічна гіпофункція може призвести до (надмірно) компенсаційного споживання їжі. Переїдання та призводить до збільшення ваги можуть бути спричинені генетичною схильністю до зниження дофамінергічної активності, але це також може бути поведінковим механізмом компенсації зниженого сигналу дофаміну після дофамінергічного надмірного стимулювання, наприклад, після відмови від куріння або надмірного споживання їжі, що смакує. Ця гіпотеза відповідає нашим випадковим виявленням збільшення приросту ваги після припинення фармацевтичної дофамінергічної надмірної стимуляції у щурів. Ці висновки підтверджують вирішальну роль дофамінергічної сигналізації для харчової поведінки та пропонують пояснення набору ваги після припинення діяльності, пов'язаної з високою дофамінергічною сигналізацією. Вони також підтримують можливість використання дофамінергічних препаратів для помірного споживання їжі.
Передумови
Харчування та дофамінергічна передача сигналів тісно пов’язані. Харчова винагорода та пов'язані з їжею винагороди підвищують рівень дофаміну у важливих компонентах схем винагороди мозку [1, 2]. Насправді їжа може бути найважливішим природним стимулятором системи винагороди в мозку [3]. Отже, переїдання може представляти спробу компенсувати дефіцит гедонічного винагороди в умовах зниженої дофамінергічної активності.
Відносний дофамінергічний дефіцит може бути спричинений різними станами, наприклад, генетичною схильністю або після адаптивного зниження регуляції дофамінергічної системи через попередню надстимуляцію. Таким чином, замісний прийом їжі може пояснити набір ваги після відмови від куріння, під час прийому антипсихотичних препаратів та ожиріння.
Відскочуючий ефект харчової поведінки після дофамінергічної надмірної стимуляції може спричинити збільшення ваги, часто пов’язане з відмовою від куріння, оскільки під час куріння нікотин збуджує дофамінвмісні клітини в вентральній тегментальній зоні, що призводить до вивільнення дофаміну в мезолімбічних та мезокортикальних проекціях [4].
Крім того, збільшення маси тіла є побічним ефектом багатьох часто використовуваних препаратів. Зокрема, нейролептики антидопамінергічної дії, трициклічні антидепресанти, літій та деякі протисудомні засоби сприяють набору ваги. На сьогоднішній день основні механізми все ще недостатньо вивчені, хоча взаємодія з дофаміновою системою була пов'язана з цим [5].
Подібним чином, при ожирінні індекс маси тіла негативно корелює з щільністю рецепторів D2 в смугастому тілі [6, 7], що може відображати нейроадаптацію, вторинну надмірному стимулюванню смачною їжею [8, 9]. Таким чином, збільшення споживання їжі може бути компенсаційною поведінкою при низькому дофамінергічному спонуканні [10]. Стіце та ін. нещодавно повідомлялося, що нижча активація стриату у відповідь на прийом їжі пов'язана з ожирінням. Крім того, це співвідношення модулювалось генетично обумовленою наявністю рецепторів D2 [11].
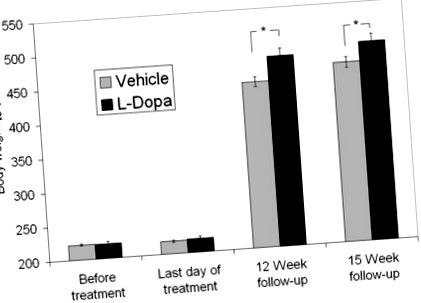
Ці результати узгоджуються з нашими власними випадковими спостереженнями збільшення маси тіла після фармацевтичної дофамінергічної надмірної стимуляції на тваринній моделі. Вже було продемонстровано регулювання годування за допомогою гострої дофамінергічної стимуляції [наприклад, [12]], але ефектів відскоку після надмірної стимуляції не повідомлялося. Щури з обмеженим харчуванням отримували попередник допаміну леводопу протягом п’яти днів, а потім були виведені з дофамінергічного препарату. Згодом тваринам було дозволено годувати довільно. Протягом наступних 12 тижнів інтервенційна група набрала на 15% більше ваги, ніж група транспортних засобів (p Рисунок 1
Індивідуальні дані про збільшення маси тіла. Усі щури, крім одного, із групи транспортних засобів набрали менше ваги, ніж середній приріст ваги групи L-DOPA. Близько половини щурів з групи L-DOPA набрали більшої ваги, ніж майже всі щури з групи транспортних засобів. Результати представляють індивідуальну різницю у масі тіла кожного щура з обох груп між останнім днем лікування та 15-тижневим спостереженням.
Обговорення
З'являється все більше доказів про роль дофамінергічної сигналізації у розвитку ожиріння. Компенсаційне харчування, обумовлене гіпофункціональністю дофамінергічної системи, може базуватися не тільки на генетично обумовлених факторах, але також може бути індуковано попередньою надмірною стимуляцією з природною стимуляцією або фармакологічним посиленням. Пізніше було продемонстровано нашими випадковими виявленнями, що знижений дофамінергічний тонус (відносно попереднього періоду зовнішньо підвищеного дофамінергічного потягу) посилював збільшення ваги після періоду позбавлення їжі.
Хоча гостре введення леводопи в поєднанні з карбідопою призводить до підвищення рівня дофаміну в мозку [13, 14], зменшення дофамінергічних реакцій на зовнішню стимуляцію спостерігається після багаторазового введення леводопи [15–17]. (Надмірна) стимуляція дофамінергічної системи прийомом дофамінергічних речовин або хронічне надмірне споживання їжі [10], призводить до адаптаційних процесів у дофамінергічній системі [18, 19]. Це зниження регуляції, ймовірно, буде складним і, мабуть, передбачає зниження синтезу дофаміну [20] та зниження експресії постсинаптичних рецепторів [21, 22]. На додаток до гедонічних або мотиваційних змін у відповідь на їжу, взаємодія дофамінергічної системи із сигналами ожиріння могла спричинити зміни у поведінці годування [див. [23] для огляду]. Ми припускаємо, що в нашому дослідженні гіпердопамінергічний стан під час багаторазового введення леводопи викликав гіподопамінергічний стан після відміни препарату, що призвело до відскоку ефекту збільшення ваги як компенсаторного механізму [3].
Дофамінергічна модуляція таких ефектів відскоку може пояснити збільшення ваги після припинення діяльності, пов’язаної з високою дофамінергічною сигналізацією. Крім того, вони пропонують пояснення щодо індивідуальних відмінностей та фармакологічного лікування, пов’язаних із збільшенням ваги після куріння. Наприклад, у курців із варіантами поліморфізму рецепторів дофаміну, пов’язаних із нижчим спонуканням дофаміну, їжа, здається, має більший підсилюючий ефект, на що вказує підвищений приріст ваги після відмови від куріння щодо осіб без цього варіанту [24, 25].
Наші результати також підвищують можливість того, що дофамінергічні ліки можуть бути корисними у запобіганні компенсаційному споживанню їжі та пропонують потенційне фармакологічне лікування ожиріння [26]. Посилене підсилення їжі та збільшення ваги у колишніх курців можуть бути послаблені бупропіоном, інгібітором зворотного захоплення допаміну та норадреналіну, який підвищує рівень дофаміну в мозку та підвищує активацію рецепторів [27]. Подібним чином, після збільшення мозаїчного синаптичного дофаміну через фармакологічне інгібування транспортера дофаміну, чоловіки з ожирінням зменшили споживання енергії на третину порівняно з плацебо під час їжі дуже смачної їжі [28]. З іншого боку, дофамінергічне лікування хвороби Паркінсона або синдрому неспокійних ніг може бути пов’язане із зворотним ефектом, тобто небажаною втратою ваги [29].
Висновок
Наші висновки підтверджують докази дофамінергічно спричиненої харчової поведінки для компенсації низького рівня дофамінергічної сигналізації. Вони повинні попередити нас про можливість того, що переїдання після відміни може бути потенційним побічним ефектом дофамінергічної стимуляції. З іншого боку, наші результати також підвищують можливість того, що дофамінергічні ліки можуть бути корисними для запобігання компенсаційному споживанню їжі. Ці можливості та обмеження дофамінергічної стимуляції на мотивацію заслуговують на подальше дослідження.
Список літератури
Бассарео V, Ді К'яра G: Диференціальний вплив механізмів асоціативного та неасоціативного навчання на реакцію передачі префронтального та акумбального дофаміну на харчові подразники у щурів, яких годували ad libitum. J Невроски 1997 рік, 17: 851-861.
Малий ДМ, Джонс-Готман М, Дагер А: Вивільнення допаміну, викликане годуванням, у спинному стриатумі корелює з оцінками приємності їжі у здорових добровольців. Нейровізуалізація 2003 рік, 19: 1709-1715. 10.1016/S1053-8119 (03) 00253-2
Епштейн Л.Х., Ледді Дж. Харчове підкріплення. Апетит 2006 рік, 46: 22-25. 10.1016/j.appet.2005.04.006
Кауер Я.А .: Неврологія: дім для нікотинової звички. Природа 2005 рік, 436: 31-32. 10.1038/436031а
Goudie AJ, Halford JC, Dovey TM, Cooper GD, Neill JC: Спорідненість до Н (1) -гістамінних рецепторів передбачає короткочасне збільшення ваги типових та атипових антипсихотичних препаратів. Нейропсихофармакологія 2003 рік, 28: 2209-2211. 10.1038/sj.npp.1300291
Ван Дж. Дж., Волков Н.Д., Логан Дж., Паппас Н.Р., Вонг КТ, Чжу В., Нетусіл Н., Фаулер Й.С .: Дофамін мозку та ожиріння. Ланцет 2001 рік, 357: 354-357. 10.1016/S0140-6736 (00) 03643-6
Haltia LT, Rinne JO, Merisaari H, Maguire RP, Savontaus E, Helin S, Nagren K, Kaasinen V: Вплив внутрішньовенного введення глюкози на дофамінергічну функцію в мозку людини in vivo. Синапс 2007 рік, 61: 748-756. 10.1002/син.20418
Колантуоні С, Швенкер Дж, Маккарті Дж, Рада П, Ладенхайм Б, Кадет JL, Шварц Дж, Моран Т., Хобель БГ: Надмірне споживання цукру змінює зв’язування з дофаміновими та му-опіоїдними рецепторами мозку. Нейрорепортаж 2001 рік, 12: 3549-3552. 10.1097/00001756-200111160-00035
Bello NT, Lucas LR, Hajnal A: Повторний доступ сахарози впливає на щільність рецепторів дофаміну D2 в смугастому тілі. Нейрорепортаж 2002 рік, 13: 1575-1578. 10.1097/00001756-200208270-00017
Девіс С, Страчан С, Берксон М: Чутливість до винагороди: наслідки для переїдання та надмірної ваги. Апетит 2004 рік, 42: 131-138. 10.1016/j.appet.2003.07.004
Stice E, Spoor S, Bohon C, Small DM: Взаємозв'язок між ожирінням та притупленою смугастою реакцією на їжу модерується алелем TaqIA A1. Наука 2008 рік, 322: 449-452. 10.1126/наук.1161550
Heffner TG, Zigmond MJ, Stricker EM: Вплив дофамінергічних агоністів та антагоністів годування у інтактних щурів, які отримували 6-гідроксидопамін. J Pharmacol Exp Ther 1977 рік, 201: 386-399.
Раєвський К.С., Гайнетдінов Р.Р., Будигін Е.А., Манністо П, Вайтман М: Дофамінергічна передача в стриатумі щурів in vivo в умовах фармакологічної модуляції. Neurosci Behav Physiol 2002 рік, 32: 183-188. 10.1023/A: 1013931609942
Родрігес М, Моралес I, Гонсалес-Мора JL, Гомес I, Сабате M, Допіко JG, Родрігес-Ороз MC, Obeso JA: Різні дії леводопи на позаклітинні басейни дофаміну в стриатумі щурів. Синапс 2007 рік, 61: 61-71. 10.1002/син.20342
Браннан Т, Приходжан А, доктор медицини Яхр: Вплив багаторазового введення l-DOPA та апоморфіну на поведінку кругообігу та утворення стрифатального дофаміну. Мозок Res 1998 рік, 784: 148-153. 10.1016/S0006-8993 (97) 01191-8
Opacka-Juffry J, Ashworth S, Ahier RG, Hume SP: Модулюючі ефекти L-DOPA на рецептори дофаміну D2 у стриатумі щурів, виміряні за допомогою мікродіалізу in vivo та ПЕТ. J Нейронна трансм 1998 рік, 105: 349-364. 10.1007/s007020050063
Мурата М, Каназава I: Повторне введення L-допи знижує здатність зберігати дофамін і скасовує надчутливість дофамінових рецепторів у смугастому тілі непошкоджених щурів. Neurosci Res 1993 рік, 16: 15-23. 10.1016/0168-0102 (93) 90004-A
Південь T, Хуан XF: Дієта з високим вмістом жиру збільшує рецептор дофаміну D2 і зменшує щільність зв'язування рецепторів транспортера допаміну в ядрі і в хвостатому путамені мишей. Neurochem Res 2008 рік, 33: 598-605. 10.1007/s11064-007-9483-x
Nader MA, Morgan D, Gage HD, Nader SH, Calhoun TL, Buchheimer N, Ehrenkaufer R, Mach RH: ПЕТ-зображення дофамінових рецепторів D2 під час хронічного самоконтролю кокаїну у мавп. Nat Neurosci 2006 рік, 9: 1050-1056. 10.1038/nn1737
Imperato A, Obinu MC, Carta G, Mascia MS, Casu MA, Gessa GL: Зменшення вивільнення та синтезу дофаміну шляхом повторного лікування амфетаміном: роль у поведінковій сенсибілізації. Eur J Pharmacol 1996 рік,317(2-3): 231-7. 10.1016/S0014-2999 (96) 00742-X
Dagher A, Bleicher C, Aston JA, Gunn RN, Clarke PB, Cumming P: Знижене зв’язування рецепторів дофаміну D1 у вентральному смугастому сигареті курців. Синапс 2001 рік, 42: 48-53. 10.1002/син.1098
Борде R, Рідрей S, Шварц JC, Соколоф П: Залучення прямого стриатонігрального шляху до індукованої леводопою сенсибілізації у щурів, уражених 6-гідроксидопаміном. Eur J Neurosci 2000 рік, 12: 2117-2123. 10.1046/j.1460-9568.2000.00089.x
Пальмітер РД: Чи є дофамін фізіологічно важливим посередником харчової поведінки? Тенденції Neurosci 2007 рік, 30: 375-381. 10.1016/j.tins.2007.06.004
Lerman C, Shields PG, Wileyto EP, Audrain J, Pinto A, Hawk L, Krishnan S, Niaura R, Epstein L: Фармакогенетичне дослідження лікування відмови від куріння. Фармакогенетика 2002 рік, 12: 627-634. 10.1097/00008571-200211000-00007
Lerman C, Berrettini W, Pinto A, Patterson F, Crystal-Mansour S, Wileyto EP, Restine SL, Leonard DG, Shields PG, Epstein LH: Зміни в нагородженні за їжу після відмови від куріння: фармакогенетичне дослідження. Психофармакологія (Берл) 2004 рік, 174: 571-577. 10.1007/s00213-004-1823-9
Бальчоглу А, Вюрман Р.Д .: Вплив фентерміну на вивільнення дофаміну та серотоніну в смугастих організмах у свідомих щурів: дослідження мікродіалізу in vivo. Int J Obes Relat Metab Disord 1998 рік, 22: 325-328. 10.1038/sj.ijo.0800589
Лерман С, Ніаура Р: Застосування генетичних підходів до лікування нікотинової залежності. Онкоген 2002 рік, 21: 7412-7420. 10.1038/sj.onc.1205801
Леді Джей Джей, Епштейн Л.Х., Яроні Дж.Л., Ремміх Ю.Н., Палух Р.А., Голдфілд Г.С., Лерман С: Вплив метилфенідату на їжу у людей із ожирінням. Obes Res 2004 рік, 12: 224-232. 10.1038/ob.2004.29
Palhagen S, Lorefalt B, Carlsson M, Ganowiak W, Toss G, Unosson M, Granerus AK: Чи сприяє лікування L-допою зменшенню маси тіла у пацієнтів літнього віку з хворобою Паркінсона? Acta Neurol Scand 2005 рік, 111: 12-20. 10.1111/j.1600-0404.2004.00364.x
Подяки
Ця робота була підтримана Фондом Volkswagen (Az .: I/80 708), а також Мережею досліджень та навчання Марії Кюрі: Мова та мозок (RTN: LAB), що фінансується Європейською Комісією (MRTN-CT-2004-512141) в рамках своєї шостої рамкової програми, Neuromedical Foundation Muenster та BMBF-консорціум Дофамінергічного вдосконалення навчання (01GW0520).
Інформація про автора
Приналежності
Департамент неврології, Університет Мюнстера, Альберт-Швейцер-Штрассе 33, 48129, Мюнстер, Німеччина
Джулія Рейнгольц, Олівер Скопп, Іво Бор та Стефан Кнехт
Кафедра фармакології та токсикології, Університет Мюнстера, Домагкштрассе 12, 48149, Мюнстер, Німеччина
Олівер Скопп та Хілке Вінтерхофф
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Відповідний автор
Додаткова інформація
Конкуруючі інтереси
Автори заявляють, що у них немає конкуруючих інтересів.
Внески авторів
JR провів статистичний аналіз даних та підготував остаточний рукопис. ОС організувала дослідження та зібрала дані. Е. Брав участь у задумі та розробці основного дослідження. І. Б. брав участь у підготовці остаточного рукопису. HW та SK розробляли та контролювали основне дослідження, SK складав початковий рукопис.
Усі автори прочитали та схвалили остаточний рукопис.
Оригінальні подані авторами файли для зображень
Нижче наведено посилання на оригінальні подані авторами файли зображень.
- Чи підсолоджувачі роблять вагу здоровим харчуванням SF Gate
- Ген для; Тонкість; Визначено, що може допомогти протистояти набору ваги
- Вплив проковтування глутамату натрію ad libitum на збільшення ваги у мишей C57BL6J - FullText
- Непереносимість глютену та збільшення ваги
- ГМО-продукти, пов’язані із запобіганням набору ваги