Кальцифікація черевної аорти на звичайному рентгені та зв’язок зі значним захворюванням ІХС у безсимптомних хворих на хронічний діаліз
Анотація
Передумови
Ішемічна хвороба серця (ІХС) є поширеною у безсимптомних хворих на хронічний діаліз і відіграє важливу роль у їх поганому виживанні. Рання ідентифікація цих пацієнтів із високим ризиком може покращити лікування та знизити смертність. Кальцифікація черевної аорти (AAC) раніше була пов'язана з ІХС у дослідженнях розтину. Оскільки AAC можна легко оцінити за допомогою бокового рентгена поперекового відділу, ми висунули гіпотезу, що ступінь AAC, оцінений на боковому рентгені попереку, може передбачати наявність значної ІХС у хворих на діаліз.
Методи
До цього дослідження були включені всі пацієнти, які в даний час приймають участь у дослідженні ICD2 без анамнезу АКШ або ЧКВ з імплантацією стенту. Всім пацієнтам була проведена КТ-ангіографія (КТА) та бічний рентген живота. Кількісний показник AAC на рентгені був використаний заздалегідь затвердженою системою підрахунку балів, після чого оцінювали зв'язок між AAC та наявністю значних ІБС.
Результати
Всього в це дослідження було включено 90 пацієнтів (71% чоловіків, 67 ± 7 років). У 46 пацієнтів було виявлено значну ІХС. AAC-бал був значно вищим у пацієнтів з ІХС (10,1 ± 4,9 проти 6,3 ± 4,6 (стор
Передумови
Оклюзивна ішемічна хвороба серця (ІХС) суттєво сприяє поганому виживанню хворих на хронічний діаліз [1–3]. Отже, оптимізація стратегій лікування ІХС може суттєво покращити результат у цій групі пацієнтів. Хоча відомо, що ІХС є дуже поширеним серед хворих на діаліз, нинішній рівень поширеності, ймовірно, є недооцінкою фактичної поширеності. Кілька досліджень показали, що, також серед пацієнтів з безсимптомним діалізом, ІХС переважає приблизно у 40-50% пацієнтів [4-6]. Виявлення цих пацієнтів дозволило б провести більш ранні та більш оптимальні методи лікування. У хворих на діаліз нещодавно було продемонстровано, що кальцифікація аорти є незалежним предиктором серцево-судинної захворюваності та смертності. Тому було висловлено припущення, що цю методику скринінгу можна використовувати для точної оцінки серцево-судинного ризику у хворих на діаліз [7, 8]. Поряд із цією взаємозв'язком із серцево-судинними подіями було також продемонстровано в результаті аутопсійного дослідження, проведеного у> 600 дорослих середнього віку, що ступінь кальцифікації живота пов'язана із ступенем кальцифікованих коронарних бляшок [9].
Враховуючи ці взаємозв'язки, ми припустили, що ступінь кальцифікації аорти, оцінена на простому боковому рентгені поперекового відділу, може передбачати наявність значної ІХС у хворих на діаліз. Метою цього дослідження було оцінити прогностичну цінність кальцифікації живота на наявність значущої ІХС за допомогою перевіреної бальної системи, яка раніше використовувалась для оцінки клінічної цінності кальцифікації черевної аорти [7].
Методи
Навчання населення
Для цього аналізу були включені всі пацієнти, які брали участь у дослідженні ICD2 (ISRCTN20479861) до червня 2013 року. Передумови, цілі та методи цього дослідження вже повідомлялись раніше [10]. Підсумовуючи, це дослідження оцінить ефективність профілактичної імплантації МКБ у хворих на хронічний діаліз. Перед рандомізацією пацієнтів проводять інтенсивний скринінговий протокол, що включає комп’ютерну томографічну ангіографію (КТА) та рентген поперекового відділу попереку. Усі пацієнти надали письмову інформовану згоду, а проект дослідження схвалив місцевий комітет з питань етики. Пацієнти з попереднім аортокоронарним шунтуванням (АКШ) або черезшкірним коронарним втручанням (ЧКВ) з імплантацією стента не були включені, як і пацієнти з аортальним протезом та пацієнти, у яких КТ-сканування було неможливим або вважалося нерозбірливим.
Протокол КТ Multi Slice та аналіз даних MSCT
До отримання КТ пацієнти з високим пульсом, який визначався як> 65 ударів на хвилину, отримували пероральні пероральні β-адреноблокатори (метопролол 50 або 100 мг, разова доза, за 1 год до обстеження), якщо вони переносились. Залежно від залишкової функції нирок вживались попередні та післяпроцедурні заходи, щоб запобігти подальшому погіршенню стану. Ці заходи включали гідратацію до та після процедури (доза та шлях залежно від залишкової функції нирок у пацієнтів), а також у хворих на гемодіалізі сканування проводили за день до наступного сеансу діалізу.
Дослідження проводили за допомогою 64-детекторного рядкового КТ-сканера (Aquilion 64, Toshiba Medical Systems, Токіо, Японія) або 320-детекторного рядкового КТ-сканера (Aquilion ONE, Toshiba, Токіо, Японія), як описано раніше [11].
Аналіз даних проводили два досвідчені спостерігачі КТ (включаючи JWJ). Якщо між цими двома рецензентами не було консенсусу, проводилась консультація 3-го незалежного рецензента. Дані всіх основних сегментів епікарда (у сегментах RCA 1–3; у сегментах LAD 5–8; та у сегментах 11 і 13 LCx) були проаналізовані, як описано раніше. Значним ІБС було визначено як звуження коронарного просвіту ≥ 50% [11].
Кількісне визначення кальцифікації черевної аорти
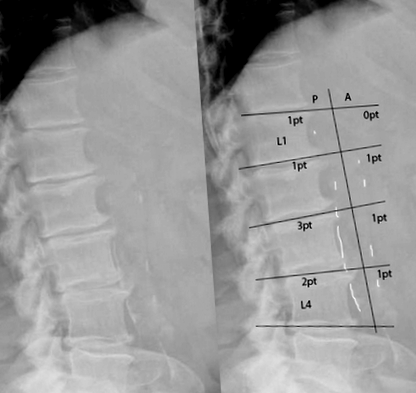
Ступінь кальцифікації аорти розраховували на боковому поперековому рентгені (MKB та MSB). Бічний рентген зроблений у положенні стоячи за допомогою стандартного рентгенологічного обладнання. Сортування проводили за допомогою попередньо затвердженої системи оцінювання [12, 13], в якій ступінь кальцинових відкладень класифікують на основі кожного сегмента, використовуючи поперекові сегменти хребців L1-L4. За сегмент оцінка становила від 0 до 3 як для передньої, так і для задньої стінки аорти. Ці вісім балів привели до складової оцінки кальцифікації черевної аорти (оцінка AAC) в межах від 0 до 24 балів (див. Рис. 1).
Класифікація кальцифікації черевної аорти. Для всіх сегментів як передня, так і задня стінка оцінюються за ступенем кальцифікації судин. Оцінка: 0 балів: відсутні кальцинові відкладення; 1 бал: кальцинована менше 1/3 стінки; 2 бали: між 1/3 і 2/3 ураженої стіни; 3 бали: більше 2/3 ураженої стіни. права панель показує приклад цього розрахунку
Статистичний аналіз
Безперервні змінні виражаються як середнє значення ± SD при нормальному розподілі за оцінкою тесту Колмогорва-Смірнова. Ненормально розподілені дані були виражені як медіана (25-й та 75-й процентилі Q1, Q3). Постійні дані порівнювали за допомогою двоступінського студента т-тест на неспарені дані або за допомогою U-критерію Манна – Уїтні, коли він не розподілений нормально. Категоричні дані виражали як частоти та відсотки та порівнювали за допомогою критерію хі-квадрат. За допомогою логістичного регресійного аналізу оцінювали одновимірне передбачувальне значення базових параметрів на наявність ішемічної хвороби серця. Згодом багатовимірний аналіз (контролюючий для всіх одновимірних предикторів з стор
Результати
Для цього дослідження 90 із 142 пацієнтів, які брали участь у дослідженні ICD2, мали право на цей аналіз; 23 пацієнти не були включені через анамнез АКШ, 10 пацієнтів через анамнез ЧКВ з імплантацією стента, шість пацієнтів через високий/нерегулярний пульс, чотири пацієнти мали недіагностичну CTA, три пацієнти мали аортальний протез і чотири пацієнти відмовились від CTA. Крім того, у двох пацієнтів не було отримано бокового рентгена поперекового відділу.
Пацієнтами були переважно чоловіки (71%) із середнім віком 67 ± 7 років. Більшість пацієнтів перебували на гемодіалізі (69%) із середньою тривалістю протягом 18 [9, 29] місяців. Середній показник кальцифікації черевної аорти становив 8,2 ± 5,1 бала (діапазон 0–20,5 балів). Базові характеристики узагальнені в таблиці 1. Жодних суттєвих побічних явищ, пов’язаних з КТ-ангіографією чи рентгенографією поперекового відділу, не зафіксовано.
Ішемічна хвороба серця
Значне захворювання ІХС було зафіксовано у 46 (51%) пацієнтів. Порівняно з пацієнтами без значної ІХС, ці пацієнти були значно старшими (69 ± 7 проти 65 ± 7 років, стор Таблиця 2 Універсальні та багатовимірні предиктори наявності CAD
Чутливість та специфічність
За допомогою аналізу кривої ROC оцінювали оптимальний поріг для оцінки AAC. З граничним рівнем 6,5 балів, показник AAC мав чутливість 85% та специфічність 57% для прогнозування значущої ІХС. Крім того, коли використовується цей граничний показник, оцінка AAC має негативне прогнозне значення 78% та позитивне прогнозне значення 67% (таблиця 3). Аналіз кривої робочих характеристик приймача продемонстрував область під кривою 0,72 (стор Таблиця 3 Наявність значущих САПР із використанням межі показників AAC у 6,5 балів
ROC-аналіз AAC-балу
Коли цю межу вводили в багатовимірну модель, як було описано раніше, оцінка AAC ≥ 6,5 була пов'язана з 6,56 (95% ДІ 2,28–18,85, стор
Обговорення
Це дослідження демонструє, що ступінь кальцифікації черевної аорти, оцінена за допомогою простого латерального рентгена черевної порожнини, передбачає наявність значної ІХС у хворих на хронічний діаліз.
Необхідність виявлення значної ІХС у хворих на діаліз
ІХС широко поширена серед хворих на діаліз і є основним фактором, що сприяє поганому результату діалізних хворих [2, 14]. Однак оптимальне лікування ІХС може призвести до значних поліпшень. Наприклад, було продемонстровано, що реваскуляризація у хворих на діаліз, у яких виявляється значне ІХС, дійсно може збільшити виживання [15-17]. Проте, незважаючи на ці спостереження, слід зазначити, що повідомлялося, що інвазивне лікування ІХС недостатньо використовується у хворих на діаліз [18].
Оскільки значний ІХС широко поширений серед пацієнтів з безсимптомним діалізом, значна частина, ймовірно, не піддається оптимальному лікуванню. Цілком можливо, що цим пацієнтам буде корисніше більш інтенсивне медичне лікування або навіть реваскуляризація. Однак щодо цієї теми залишаються певні суперечки, оскільки визначення оптимального лікування у цій групі пацієнтів не є чітким випадком. Для вирішення цієї проблеми в майбутньому потрібні подальші дослідження. Хоча це не було продемонстровано, представляється обгрунтованим вважати, що, враховуючи високу частоту розвитку ІХС серед хворих на діаліз та той факт, що деякі пацієнти, мабуть, виграють від більш інтенсивного лікування, скринінг на ІХС є обов’язковим для пацієнтів на діалізі з метою оптимізації лікування для CAD. Тим не менше, справжнє значення скринінгу на ІХС у хворих на діаліз потрібно розглянути в майбутніх дослідженнях.
Кальцифікація черевної аорти та ішемічна хвороба серця
Вже в 1950-х роках на основі аутопсійних досліджень> 600 дорослих середнього віку повідомлялося, що існує дуже значна зв'язок між ступенем кальцифікації черевної аорти та наявністю кальцифікованого нальоту в коронарних артеріях [9]. Після цих висновків було продемонстровано серед загальної популяції, що за допомогою простого латерального рентгена черевної порожнини можна передбачити тяжкість кальцифікації аорти. Більше того, повідомлялося про взаємозв'язок між ступенем кальцифікації аорти, виявленим на боковому рентгені поперекового відділу, та серцево-судинною захворюваністю та смертністю [13, 19]. Отже, цей взаємозв'язок також був задокументований у хворих на діаліз [7]. Наскільки нам відомо, це перше дослідження, яке продемонструвало, що показник AAC є передбачувальним щодо наявності значної ІХС у хворих на діаліз.
Інші способи виявлення значущих САПР
На даний момент доступно багато способів виявлення САПР, однак кожен із них має свої обмеження. Золотий стандарт діагностики ІХС - коронарна ангіографія (КГА) - запропонований як звичайний інструмент скринінгу ІХС у хворих на діаліз [5, 20]. Однак, враховуючи його інвазивний характер, високі витрати та ризики ускладнень, інші діагностичні засоби, мабуть, були б кращими в цій безсимптомній популяції. Запропоновані також інші методи візуалізації, такі як добутамінова стресова ехокардіографія та перфузійна сцинтиграфія міокарда [21].
Хоча неможливо здійснити справжнє порівняння між методом скринінгу, який досліджується в даний час, та іншими діагностичними інструментами ішемічної хвороби артерій, імовірно, що звичайний бічний рентген попереку має фінансові та матеріально-технічні переваги перед іншими згаданими методами діагностичного скринінгу.
Клінічні наслідки
ІХС є дуже поширеним серед хворих на діаліз, але досі не вирішено, який спосіб діагностики є кращим. Однак звичайний скринінг на ІХС з використанням однієї з багатьох доступних методик скринінгу видається виправданим, щоб покращити бездонні результати цієї групи пацієнтів. Ми показали, що кальцифікація аорти на простому бічному рентгені поперекового відділу поперекового відділу передбачає наявність значної ІХС. За допомогою цього недорогого, неінвазивного методу скринінгу можна легко ідентифікувати пацієнтів із високим ризиком розвитку ІХС. Згодом може бути розпочата найбільш оптимальна стратегія діагностики або лікування. Однак слід ще раз зазначити, що майбутні дослідження повинні додатково дослідити, якими мають бути ці стратегії лікування ІХС у хворих на діаліз, оскільки це ще не чіткий випадок.
Обмеження
Хоча нещодавно наша група повідомляла, що КТ-ангіографія є можливою для виявлення ІХС у хворих на діаліз, коронарні ангіограми все-таки слід вважати золотим стандартом [11]. Таким чином, майбутні дослідження повинні співвіднести показник AAC з CAD, виявленим CAG, щоб підтвердити наші спостереження.
Висновок
Кальцифікація аорти, оцінена на простому боковому рентгені поперекового відділу, передбачає наявність значної ІХС у безсимптомних хворих на хронічний діаліз. За допомогою цього рентгенівського знімка можна виявити пацієнтів з високим ризиком розвитку ІХС.
- Рентген черевної порожнини медицини Джонса Гопкінса
- Аортальна регургітація COR Medical Group
- Заміна аортального або мітрального клапана на Biocor та Biocor Supra - Повний текст
- КТ черевної порожнини UCLA Health
- Жирова маса живота та гіноїдів пов’язана з факторами серцево-судинного ризику у чоловіків та жінок -