Інгібуючий ефект екстракту зелених кавових зерен на накопичення жиру та збільшення маси тіла у мишей
Хіросі Шимода
1 Oryza Oil & Fat Chemical Co., Ltd., Відділ досліджень і розробок, 1 Numata Kitagata-cho, Ічіномія, Айчі 493-8001, Японія
Емі Секі
1 Oryza Oil & Fat Chemical Co., Ltd., Відділ досліджень і розробок, 1 Numata Kitagata-cho, Ічіномія, Айчі 493-8001, Японія
Мічіо Айтані
1 Oryza Oil & Fat Chemical Co., Ltd., Відділ досліджень і розробок, 1 Numata Kitagata-cho, Ічіномія, Айчі 493-8001, Японія
Це стаття з відкритим доступом, що поширюється на умовах ліцензії Creative Commons Attribution (http://creativecommons.org/licenses/by/2.0), яка дозволяє необмежене використання, розповсюдження та відтворення на будь-якому носії за умови, що оригінальна робота правильно цитується.
Анотація
Передумови
Епідеміологічне дослідження, проведене в Італії, показало, що кава має найбільшу антиоксидантну здатність серед загальновживаних напоїв. Зелена кава в зернах багата хлорогеновою кислотою та спорідненими сполуками. Вплив екстракту зелених кавових зерен (GCBE) на накопичення жиру та масу тіла мишей оцінювали з метою вивчення впливу GCBE на легке ожиріння.
Методи
Самців мишей-дідів протягом 14 днів годували стандартним раціоном, що містить GCBE та його основні складові, а саме кофеїн та хлорогенну кислоту. Крім того, рівень печінкового тригліцериду (ТГ) також досліджували після послідовного введення (13 днів) GCBE та його складових. Щоб вивчити вплив GCBE та його складових на поглинання жиру, оцінювали зміни вмісту TG у сироватках у мишей, завантажених оливковою олією. Крім того, для дослідження впливу на метаболізм печінкової ТГ, оцінювали активність карнітинпальмітоїлтрансферази (СРТ) у мишей після послідовного прийому (6 днів) GCBE та його складових (кофеїну, хлорогенної кислоти, неохлорогенної кислоти та суміші ферулойлхінової кислоти).
Результати
Було встановлено, що 0,5% та 1% GCBE знижували вісцеральний жир та масу тіла. Кофеїн та хлорогенова кислота виявили тенденцію до зменшення вісцерального жиру та маси тіла. Пероральне введення GCBE (100 та 200 мг/кг на добу) протягом 13 днів показало тенденцію до зниження печінкового TG у мишей. У тій же моделі хлорогенова кислота (60 мг/кг на добу) знижувала рівень печінкового ТГ. У мишей, завантажених оливковою олією (5 мл/кг), GCBE (200 та 400 мг/кг) та кофеїном (20 та 40 мг/кг) знижували рівень ТГ у сироватці крові. GCBE (1%), неохлорогенова кислота (0,028% та 0,055%) та суміш ферулоїлхінової кислоти (0,081%) значно посилюють активність печінкової CPT у мишей. Однак не виявлено, що ні кофеїн, ні хлорогенова кислота посилюють активність СРТ.
Висновок
Ці результати свідчать про те, що GCBE, можливо, ефективний проти збільшення ваги та накопичення жиру шляхом пригнічення всмоктування жиру та активації метаболізму жиру в печінці. Встановлено, що кофеїн є пригнічувачем всмоктування жиру, тоді як хлорогенова кислота частково бере участь у супресивному ефекті GCBE, що призводить до зниження рівня печінкового ТГ. Фенольні сполуки, такі як неохлорогенова кислота та суміш ферулоїлхінової кислоти, крім хлорогенової кислоти, можуть посилити печінкову активність СРТ.
Передумови
Методи
Тварини
Для експериментів використовували мишей-самців (Японія SLC Inc., Шидзуока, Японія). Тварин утримували при температурі 23 ° C ± 1 ° C і годували стандартною нечищеною дієтою (CE-2, Clea Japan Inc., Сідзуока, Японія) та водою з-під крану за бажанням. Експерименти проводились відповідно до Керівних принципів експериментів на тваринах (Японська асоціація лабораторних наук про тварин, 1987). Усі експериментальні конструкції були схвалені Етичним комітетом з використання експериментальних тварин.
Підготовка та визначення GCBE
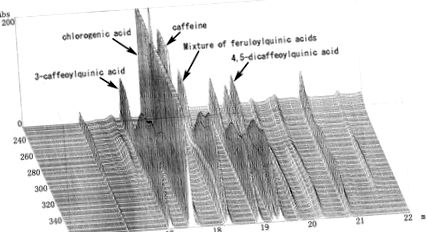
GCBE (вихід: 13,7%) екстрагували із зерен зеленої кави (coffea canephora) при 70 ° C протягом 2 годин із використанням 70% етанолу. Кофеїн, хлорогенова кислота та споріднені сполуки аналізували за допомогою ВЕРХ із використанням безводного кофеїну (Kishida Chemical Co., Ltd., Осака, Японія) та хлорогенової кислоти (Sigma-Aldrich Co., Ltd., Сент-Луїс, Міссурі, США) як стандартів (рис. (рис. 1). 1). Використовували ВЕРХ, оснащену Capcellpack C18 (4,6 φ × 250 мм, Шисейдо, Токіо, Японія) та детектор фотодіодних решіток (SPD-10 Avp, Shimadzu, Кіото, Японія). Використаний розчинник включав (A) 2 мМ H3PO4 та (B) CH3CN; лінійний градієнт (A) був змінений на (B) через 35 хв. Швидкість потоку підтримували на рівні 1,0 мл/хв. Кількість виявленого кофеїну та хлорогенової кислоти становила 10,0% та 27,0%. Як показано на малюнку Рисунок 2, 2, GCBE містить хлорогенову кислоту та інші споріднені сполуки, а саме 3-кофеоїлхінову кислоту (неохлорогенну кислоту) та суміш ферулоїлхінових кислот. Ці сполуки були виділені та ідентифіковані з GCBE [14]. Кількість 3-кофеоїлхінової кислоти та суміші ферулоїлхінової кислоти із застосуванням стандартної хлорогенної кислоти становила 5,5% та 16,0%. Вміст 4,5-дикафеоїлхінової кислоти становив 5,2% із використанням автентичного зразка, виділеного з японської білокопитниці.
Тривимірна хроматограма ВЕРХ GCBE.
Хімічні структури складових GCBE.
Реагенти
В якості еталонних сполук використовували Сезамін (Industrial Research, Ltd., Веллінгтон, Нова Зеландія) та орлістат (Hoffman-La Roche Ltd., Базель, Швейцарія). EDTA був придбаний у Kishida Chemical Co., Ltd. (Осака, Японія), тоді як пальмітоїл CoA та L-карнітин були отримані у Sigma-Aldrich Co., Ltd. (MA, США). Фізіологічний розчин, забуференний фосфатом без кальцію та магнію [PBS (-)], тригліцерид Е-тест Wako, оливкова олія, сахароза, Triton X-100 та 5,5'-дитиобіс (2-нітробензоат) (DTNB) придбані у Wako Pure Chemicals Industries, Ltd., Осака, Японія.
Вимірювання маси тіла мишей та вісцеральних жирів
Шість тижневих мишей отримали вільний доступ до неочищеної дієти (CE-2), що містить 0,5% або 1% GCBE, протягом 14 днів. До дієти додавали кофеїн (0,05% та 0,1%) та хлорогенову кислоту (0,15% та 0,3%). Мишей зважували кожні 2 дні. Миші епідидимальний та периренальний жири видаляли та зважували наприкінці експерименту. Орлістат, ліки, призначені від ожиріння, використовували як позитивний контроль.
Вимірювання рівня тригліцеридів печінки у мишей
Суспензію акацієвої камеді (5%), що містить GCBE (100 і 200 мг/кг · день), кофеїн (10 і 20 мг/кг · день) та хлорогенову кислоту (30 і 60 мг/кг · день) вводили щодня до 5 тижнів -старіші миші протягом 13 днів. На 14 день печінку видалили і приблизно 200 мг печінки гомогенізували в 1 мл PBS (-). Потім цю суспензію центрифугували (2200 × g, 10 хв) з наступною екстракцією печінкового тригліцериду (TG) із застосуванням суміші хлороформу та метанолу (2: 1). Екстракт випаровували і ресуспендували в 1 мл PBS (-). Вміст TG вимірювали за допомогою тригліцеридного Е-тесту Wako. Сезамін використовували як позитивний контроль.
Визначення TG в сироватці крові у мишей, навантажених оливковою олією
Експерименти проводили, як описано Shimoda et al. [15]. Початкові зразки крові відбирали з подглазничного венозного сплетення мишей (віком від 5 до 6 тижнів) після голодування протягом 20–22 год. Мишам вводили суспензію акацієвої камеді (5%), що містить GCBE (200 та 400 мг/кг), кофеїн (20 та 40 мг/кг) та хлорогенову кислоту (60 та 120 мг/кг). Через 30 хв мишам вводили оливкову олію (5 мл/кг). Зразки крові відбирали з інтервалом у 2 год після завантаження оливковою олією. Зразки центрифугували і вимірювали TG в сироватці крові за допомогою тригліцеридного Е-тесту Wako. Орлістат використовували як позитивний контроль.
Вимірювання активності карнітинпальмітоїлтрансферази печінки у мишей
Шість тижневих мишей годували дієтою (CE-2), що містить GCBE (0,5% та 1%), кофеїн (0,05% та 0,1%), хлорогенову кислоту (0,15% та 0,3%), неохлорогенну кислоту (0,028% та 0,055 %) та суміш ферулоїлхінової кислоти (0,081%) протягом 6 днів. Печінку мишей видаляли та гомогенізували в буфері Tris-HCl (pH 7,4), вага якого в 6 разів перевищував вагу печінки, що містить 0,25 М сахарози та 1 мМ EDTA. Гомогенат центрифугували (880 × g, 4 ° C, 10 хв) і збирали супернатант; після цього проводилося друге центрифугування (11770 × g, 4 ° C) для отримання фракції мітохондрій. Осад мітохондріальної фракції промивають і суспендують у буфері, отримуючи концентрацію білка 6 мг/мл. Активність CPT вимірювали згідно з методикою, описаною Markwell et al. [16]. Тріс-буфер (58 мМ, рН 8,0, 1 мл), що містить 1,25 мМ ЕДТА, 0,1% Тритон Х-100 і 0,25 мМ DTNB, 37,5 мкМ пальмітоїл КоА (20 мкл) і фракцію мітохондрій 6 мг/мл (20 мкл) змішували, і оптичну щільність (OD) реєстрували при 412 нм протягом 5 хв. Згодом додавали 1,25 мМ L-карнітину (20 мкл) і реєстрували OD протягом 5 хв. Діяльність КПТ була розрахована наступним чином:
ΔOD a: Лінійність зміни оптичної щільності протягом 1 хв після додавання розчину L-карнітину
ΔOD b: Лінійність зміни оптичної щільності протягом 1 хв на вихідному рівні
c: Об’єм фракції мітохондрій (мкл)
d: Молярний коефіцієнт екстинкції пальмітоїл-КоА
e: Вміст білка в мітохондріальній фракції (мг білка/мл)
Статистика
Результати були виражені як середнє значення ± SE. Значимість відмінностей досліджували за допомогою одностороннього методу ANOVA, а потім тесту Даннета. Результати з p Таблиця1. 1. Кількість споживання дієти не зменшувалася під час лікування GCBE. GCBE (0,5% та 1%) суттєво пригнічував масу тіла мишей. Вага епідидимальних та периренальних жирів мишей була значно знижена у групі, яка отримувала GCBE (0,5%). Однак результати впливу кофеїну (0,05% та 0,1%) на придушення маси тіла та вісцерального жиру не були значущими. Хлорогенова кислота (0,15% та 0,3%) продемонструвала слабку супресивну дію на масу тіла та накопичення периренального жиру. Орлістат (0,1%), позитивний контроль, продемонстрував незначний супресивний ефект на накопичення епідидимального та перинального жиру, але не пригнічуючий ефект на масу тіла.
Таблиця 1
Вплив GCBE та його складових на збільшення маси тіла та накопичення вісцеральних жирів
| Вміст у дієті (%) | Середнє загальне споживання їжі (г/тіло) | Початкова вага тіла День 0 (г) | Кінцева вага тіла 14 день (г) | |
| Контроль | -- | 75.3 | 28,2 ± 0,6 | 37,5 ± 1,6 |
| GCBE | 0,5 | 80,0 | 27,3 ± 0,5 | 33,2 ± 0,6 * |
| 1 | 75,5 | 26,9 ± 0,7 | 32,8 ± 1,2 ** | |
| Кофеїн | 0,05 | 74,9 | 27,0 ± 0,4 | 35,0 ± 1,0 |
| 0,1 | 74.3 | 26,6 ± 0,4 | 33,9 ± 0,7 | |
| Хлорогенова кислота | 0,15 | 81.3 | 27,3 ± 0,5 | 35,2 ± 0,5 |
| 0,3 | 76,5 | 26,4 ± 0,3 | 34,5 ± 0,5 | |
| Контроль | -- | 73,8 | 26,8 ± 0,4 | 34,6 ± 1,2 |
| Орлістат | 0,05 | 82.4 | 27,0 ± 0,2 | 35,0 ± 0,4 |
| 0,1 | 81.3 | 26,3 ± 0,2 | 34,2 ± 1,0 | |
| Вміст у дієті (%) | Приріст маси тіла (г) | Епідидимальний жир (мг) | Периренальний жир (мг) | |
| Контроль | -- | 9,3 ± 0,4 | 605 ± 71 | 223 ± 39 |
| GCBE | 0,5 | 6,0 ± 0,1 * | 393 ± 59 * | 106 ± 20 * |
| 1 | 5,8 ± 0,2 * | 448 ± 68 | 124 ± 23 | |
| Кофеїн | 0,05 | 8,0 ± 0,2 | 536 ± 57 | 146 ± 29 |
| 0,1 | 7,3 ± 0,2 | 491 ± 39 | 150 ± 20 | |
| Хлорогенова кислота | 0,15 | 7,9 ± 0,1 | 574 ± 48 | 173 ± 24 |
| 0,3 | 8,1 ± 0,1 | 605 ± 82 | 175 ± 25 | |
| Контроль | -- | 7,8 ± 0,9 | 588 ± 55 | 249 ± 60 |
| Орлістат | 0,05 | 8,1 ± 0,4 | 612 ± 56 | 251 ± 45 |
| 0,1 | 7,8 ± 0,9 | 481 ± 51 * | 180 ± 33 * |
Мишей годували нечищеною дієтою (CE-2), що містить кожен зразок, протягом 14 днів. Кожне значення представляє середнє значення ± SE від 6 до 7 мишей. Зірочки позначають суттєві відмінності від контрольної групи *: p Малюнок 3 3 ілюструє вплив GCBE, кофеїну та хлорогенної кислоти на печінковий TG. GCBE та кофеїн продемонстрували тенденцію до пригнічення печінкового TG. Крім того, рівень печінкового ТГ був значно знижений хлорогеновою кислотою (60 мг/кг · добу), що свідчить про її роль у придушенні печінкового ТГ у групі, яка отримувала GCBE.
Вплив GCBE, кофеїну, хлорогенної кислоти та сезаміну на накопичення печінкового TG у мишей. Кожну пробу вводили один раз на день протягом 13 днів. Колонки представляють середнє значення ± SE 7 мишей. Подвійні зірочки позначають суттєву відмінність від контрольної групи **: p Рисунок4. 4. Подібним чином кофеїн (20 та 40 мг/кг) також виявляв супресивний ефект на підвищення рівня ТГ у сироватці крові. Однак хлорогенова кислота в концентраціях 60 та 120 мг/кг не впливала на рівень ТГ у сироватці крові. Вважається, що кофеїн є основною сполукою для придушення всмоктування жиру у мишей, оброблених GCBE. Підвищений рівень ТГ у сироватці крові повністю пригнічувався орлістатом (60 мг/кг).
- Виробники таблеток для схуднення із зелених кавових зерен, представлені на Dr.
- Екстракт зеленого кавового зерна Kunena Topic - чи корисний він для втрати жиру (11)
- Зелена кава в зернах MetaSlim 45% хлорогенних кислот Webber Naturals CA
- Втрата ваги тіла за допомогою чашки цейлонського зеленого чаю - Блог EDB
- Схуднути, не займаючись зеленими кавовими зернами!