Індукована жирними кислотами диференційна регуляція генів, що кодують активований проліфератором пероксисоми рецептор γ-коактиватор-1α та -1β у клітинах скелетних м’язів людини, які диференціювали in vitro
Анотація
Цілі/гіпотеза
Транскрипційний коактиватор проліфератора пероксисоми, активований рецептором γ-коактиватор-1α (PGC-1α), посилює метаболічно відповідні шляхи, такі як глюконеогенез, окислення жирних кислот, термогенез, окисне фосфорилювання та біогенез мітохондрій. Оскільки регуляція експресії гена, що кодує PGC-1α (PPARGC1A) за поживними речовинами/метаболітами не було детально оцінено, метою цього дослідження було визначити, чи PPARGC1A (і PPARGC1B) експресія модулюється загальними жирними кислотами плазми в клітинах скелетних м'язів людини.
Методи
Міотрубки людини, які диференціювали in vitro, обробляли 0,5 ммоль/л міристату (C14: 0), пальмітату (C16: 0), стеарату (C18: 0), пальмітолеату (C16: 1ω7), олеату (C18: 1ω9) або лінолеат (C18: 2ω6). PPARGC1A/B МРНК визначали кількісно за допомогою RT-PCR. Активність мітохондрій визначалася утворенням формазану.
Результати
Неліковані клітини експресуються в 28 разів більше PPARGC1B мРНК ніж PPARGC1A мРНК (13,33 ± 2,86 проти 0,47 ± 0,08 фг/мкг загальної РНК, n= 5). PPARGC1A експресія збільшилася в два-три рази за рахунок усіх випробуваних ненасичених жирних кислот (UFA) (стор
Вступ
PGC-1β, структурний гомолог, найближчий до PGC-1α, кодується окремим геном і демонструє подібний розподіл у тканинах. Роль, яку відіграє PGC-1β, недостатньо зрозуміла, але суттєве функціональне перекриття з PGC-1α передбачається тим фактом, що обидва білки, принаймні частково, здатні коактивувати однакові фактори транскрипції та викликати експресію подібний набір генів-мішеней. Однак нові знахідки у близнюків також вказують на функціональні відмінності, причому PGC-1β є більш важливим у мітохондріальному β-окисленні [4].
Даних про регуляцію цих двох транскрипційних коактиваторів поживними речовинами та метаболітами недостатньо. Таким чином, метою цього дослідження було визначити, чи модулюють експресію загальних плазмових НЕФА, які отримують з раціону, або ліполітично вивільняються із запасів тригліцеридів. PPARGC1A і PPARGC1B в клітинах скелетних м’язів людини in vitro.
Предмети, матеріали та методи
Культура клітин
Первинні клітини скелетних м’язів людини отримували за допомогою голчастих біопсій м’яза просторового бічного м’яза та вирощували та диференціювали, як описано раніше [5]. На 5-й день диференціації клітини обробляли або BSA без жирних кислот (Sigma-Aldrich, Тауфкірхен, Німеччина), як контроль, або 0,5 ммоль/л NEFA (Sigma-Aldrich), зв’язаного з BSA. Вихідні розчини (8 ммоль/л) міристату (C14: 0), пальмітату (C16: 0), пальмітолеату (C16: 1ω7), олеату (C18: 1ω9) та лінолеату (C18: 2ω6) та 4-ммоль/1 основний розчин стеарату (C18: 0) готували в буфері Кребса – Рінгера – HEPES, що містить 20% BSA, шляхом нічного перемішування при 37 ° C під азотом. Донори м’язових клітин були набрані в рамках дослідження сімей Тюбінгена для діабету 2 типу та дали письмову письмову згоду на це дослідження. Дослідження було схвалено місцевим етичним комітетом.
RT-PCR у реальному часі
Клітини обробляли протягом 20 год, а потім промивали та збирали методом трипсинізації. РНК виділяли за допомогою колонок RNeasy (Qiagen, Hilden, Німеччина). Загальна РНК, оброблена ДНКазою без РНКази I, була транскрибована в кДНК за допомогою зворотної транскриптази AMV та набору синтезу кДНК First Strand від Roche Diagnostics (Мангейм, Німеччина). Кількісну ПЛР проводили в трьох примірниках із SYBR Green на LightCycler (Roche Diagnostics), використовуючи такі праймери (Invitrogen, Карлсруе, Німеччина): PPARGC1A: вперед 5′-TGTGCAACTCTCTGGAACTG-3 ′, реверс 5′-TGAGGACTTGCTGAGTGGTG-3 ′; PPARGC1B: вперед 5′-GCTCTCCTCCTTCTTCCTCA-3 ′, реверс 5′-ATAGAGCGTCTCCACCATCC-3 ′; 28S рРНК: пряма 5′-ACGGCGGGAGTAACTATGACT-3 ′, зворотна 5′-CTTGGCTGTGGTTTCGCT-3 ′. Умови ПЛР були такими: PPARGC1A мРНК: температура відпалу 65 ° C, 45 циклів; PPARGC1B мРНК: температура відпалу 68 ° C, 45 циклів; Температура відпалу 28S рРНК 63 ° C, 50 циклів (MgCl2 у всіх реакціях 4 ммоль/л).
Визначення активності мітохондрій
Після обробки клітини, культивовані в двох примірниках, інкубували протягом 4 год з 0,5 мг/мл 3- (4,5-диметилтіазол-2-іл) -2,5-дифеніл тетразолію броміду (МТТ) перед лізисом протягом ночі додаванням двох об'ємів 10% SDS у 0,01 моль/л HCl. Був використаний набір для проліферації клітин I (MTT) від Roche Diagnostics. Лізати переносили в пробірки, струшували, а потім фотозамірювали барвник формазану, вироблений мітохондріальними дегідрогеназами, при 565 нм.
Результати
Неліковані in vitro диференційовані міотрубки людини виражали низький, але постійно виявляється рівень PPARGC1A мРНК (0,47 ± 0,08 фг/мкг загальної РНК, n= 5). Рівні PPARGC1B мРНК були в 28 разів вищими в тих самих клітинах (загальна РНК 13,33 ± 2,86 фг/мкг, n= 5).
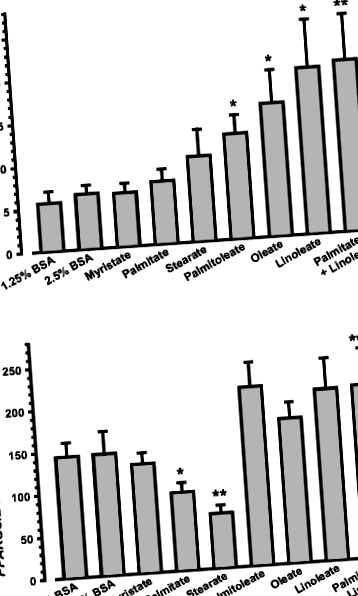
Лікування BSA (контроль), одноразовим NEFA (0,5 ммоль/л) або комбінацією пальмітату та лінолеату протягом 20 год не змінило вміст клітинної 28S рРНК або життєздатність клітин (n= 5, дані не відображаються); таким чином, 28S рРНК використовували для нормалізації. Рівні PPARGC1A мРНК були в два-три рази вищими в клітинах, оброблених ненасиченим пальмітолеатом NEFA (UFA) (стор= 0,0282, n= 5), олеат (стор= 0,0412, n= 5) або лінолеат (стор= 0,0432, n= 5), ніж у контрольних осередках (рис. 1а). Однак лікування насиченими NEFA (SFA) міристатом, пальмітатом або стеаратом не модулювало PPARGC1A Рівні мРНК (рис. 1а, n= 5). Коінкубація міотрубок з пальмітатом і лінолеатом показала, що пальмітат не в змозі блокувати стимулюючий ефект лінолеату на PPARGC1A вираз (рис. 1а).
На відміну від них, клітинний PPARGC1B Вміст мРНК не підвищувався при обробці UFA або SFA (рис. 1b, n= 5). Однак у порівнянні з такою в контрольних клітинах експресія PPARGC1B мРНК регулюється пальмітатом SFA (стор= 0,0356, n= 5) і стеарат (стор= 0,0235, n= 5) на 35 та 55% відповідно (рис. 1б). Спільна інкубація міотрубок з пальмітатом та лінолеатом призвела до повного скасування інгібуючої дії пальмітату на PGC-1β (рис. 1b; стор= 0,0340 для пальмітату проти пальмітату + лінолеату, n= 5).
Оскільки модуляція PPARGC1A і PPARGC1B Очікується, що експресія впливатиме на активність мітохондрій, ми провели тест МТТ для визначення активності дегідрогенази мітохондрій. Інкубація зі стеаратом протягом 20 год значно зменшила утворення формазану (рис. 2; стор= 0,0003 проти контролю, n= 5), тоді як SFAs міристат та пальмітат не мали ефекту. Активність мітохондрій зросла у відповідь на лікування пальмітолеатом UFA (стор Рис.2
Обговорення
Недавні дослідження на людях показали, що інфузія ліпідів знижує регуляцію роботи м’язів PPARGC1A вираз [6], тоді як втручання нікотинової кислоти пригнічує рівень NEFA у плазмі крові та одночасно збільшує м’язи PPARGC1A мРНК [7]. Однак не було встановлено, чи було це змінено PPARGC1A експресія безпосередньо зумовлена зміною концентрації NEFA у плазмі крові. Тут ми показуємо, що обробка міотрубок людини окремими видами NEFA при високих, але фізіологічних концентраціях дала унікальну схему регулювання експресії генів, що кодують ізоформи PGC-1: UFA збільшуються PPARGC1A вираз, але не мають регулятивного впливу на PPARGC1B вираз; з іншого боку, ДФЗ регулюють PPARGC1B вираз, але не модулюють PPARGC1A вираз. Як ці NEFA впливають на м’язи PPARGC1A/B експресія опосередкована, все ще невідома, але можливо, що активовані NEFA фактори транскрипції, такі як PPAR, відіграють певну роль.
Більше того, ми обробляли міотрубки комбінацією лінолеату та пальмітату. Стимулююча дія лінолеату UFA на PPARGC1A експресія не викликала протидії пальмітату SFA. Це спостереження узгоджується з даними, отриманими на ізольованих острівцях щурів, де також збільшилась суміш UFA/SFA (олеат/пальмітат) PPARGC1A експресія мРНК [8]. Причини, чому ці дані не відображають результатів досліджень втручання [6, 7], незрозумілі, але їх можна пояснити вторинними ефектами маніпуляцій in vivo. Примітно, що інгібуючий вплив пальмітату на міотрубки PPARGC1B вираз повністю перевернув лінолеат. Таким чином, наші висновки свідчать про те, що UFAs не лише надають прямий сприятливий вплив на клітинний метаболізм глюкози/ліпідів через PGC-1α, але також захищають від згубних метаболічних ефектів SFA на рівні PGC-1β.
Повідомлялося про іншу схему регуляції експресії генів, що кодують ізоформу PGC-1, у первинних мишачих гепатоцитах [9]: жодна із ізоформ не була регульована жодним із випробуваних NEFA; Ppargcla індукувався лише стеаратом, тоді як Ppargclb був індукований UFA та SFA. Ці різні результати можуть відображати специфічну для тканини регуляцію генів, що кодують дві ізоформи, як це вже було показано in vivo: у діабетичних станах типу 2, PPARGC1A експресія зменшується в скелетних м'язах [2, 3] і збільшується в печінці [10].
Ми також оцінили, чи зміни в міотрубці PPARGC1A/B експресія супроводжувалась зміною активності мітохондрій, що вказує на біологічну значимість. UFA стимулювали активність дегідрогеназ мітохондрій, тоді як стеарат SFA знижував їх активність. Ці спостереження можна пояснити посиленою та послабленою трансактивацією NRF-1 відповідно. На відміну від стеарату, пальмітат не інгібував. Це може бути пов'язано з функціональною компенсацією його слабкого репресивного впливу на PPARGC1B експресія (у порівнянні із стеаратом) супутньою тенденцією до стимулювання PPARGC1A вираз.
Відомо два основних шляхи просування PPARGC1A експресією в скелетних м'язах є осі цАМФ-протеїнкінази А та осі кальциневрин – кальцій – кальмодулін-залежна протеїнкіназа IV (для огляду див. [1]). Ми перевірили, чи опосередковують UFA PPARGC1A індукція в міотрубах людини за одним із цих шляхів. Однак ми не виявили утворення цАМФ після стимуляції жодним із випробуваних NEFA. Крім того, блокада протеїнкінази А та кальциневрину (з використанням Н-89 та циклоспорину А відповідно) показала, що цей шлях не задіяний. Таким чином, повинні існувати інші опосередковані UFA шляхи, які просувають PPARGC1A вираз.
На закінчення в цьому дослідженні ми продемонстрували диференціальне регулювання PPARGC1A і PPARGC1B вираз NEFA: УФА стимулюють PPARGC1A вираз, тоді як ДФС репресують PPARGC1B вираз. Хоча абсолютний вміст мРНК ізоформи PGC-1 в міотрубках людини не відображає рівні експресії, що спостерігаються в біопсіях нативних м'язів людини (де PPARGC1A рівною мірою [4] або більше [3], ніж PPARGC1B) і представлені лише дані мРНК, ми припускаємо, що НЕФА відіграють важливу роль у регуляції окислення м’язових жирних кислот та окисного фосфорилювання.
Скорочення
3- (4,5-диметилтіазол-2-іл) -2,5-дифеніл тетразолій бромід
- Експресія виділених генів, що кодують механістичні шляхи, транспортери поживних речовин та амінокислот у
- Вплив генетичної лінії та збагачених олеїновою кислотою змішаних дієт на підшкірну жирну кислоту
- Повна стаття Ефективність втручань у спосіб життя при НАЖХП (неалкогольна жирова хвороба печінки
- Депресія у хворих на неалкогольну жирову хворобу печінки та хронічний вірусний гепатит В і С -
- Вплив дієти Заходу на лямбліоз Роль жирних кислот і мікробіоти кишечника в стійкості