Журнал терапії ожиріння та схуднення
Відкритий доступ
Наша група щороку організовує 3000+ Глобальних конференційних серій по всій території США, Європи та Азії за підтримки ще 1000 наукових товариств та видає 700+ журналів з відкритим доступом, що містить понад 50000 видатних особистостей, відомих вчених як членів редакційної ради.
Журнали з відкритим доступом отримують більше читачів та цитат
700 журналів та 15 000 000 читачів у кожному журналі отримує 25 000+ читачів
Це число читачів у 10 разів більше порівняно з іншими журналами підписки (Джерело: Google Analytics)
- Звіт про справу
- J Obes Втрата ваги Ther 9: 388, том 9 (4)
Дата отримання: 30 квітня 2019 р./Дата прийняття: 30 липня 2019 р./Дата публікації: 06 серпня 2019 р
Анотація
Вступ: Близько 25% пацієнтів, які страждають серцевою недостатністю на кінцевій стадії (ESHF), страждають ожирінням. ІМТ> 40 заважає пацієнтам отримувати трансплантат органу, оскільки патологічне ожиріння (MO) різко збільшує смертність після трансплантації серця (HTx). Більше того, МО (ІМТ> 40) збільшує ризик тромбоемболічних подій на 20%. Лікування ESHF у пацієнтів із ожирінням повинно включати лікування ожиріння.
Баріатрична хірургія (БС) є найефективнішим методом лікування МО, однак має загрожувальну хірургічну смертність у пацієнтів з ESHF. Однією із стратегій є спочатку імплантація лівошлуночкового допоміжного пристрою (LVAD), щоб забезпечити гемодинамічну стабільність під час БС і врешті-решт зменшити ІМТ пацієнта до значень, сумісних з HTx (підхід від кандидата до кандидата). Однак припинення антикоагуляції при БС збільшує ризик тромбозу LVAD та/або тромбоемболічних явищ, особливо за наявності МО. Ми повідомляємо про терапевтичний шлях, який ми застосували для вирішення цієї непростої ситуації.
Метод: Чоловік 54 років, колишній курець, з ІМТ 43,8 кг/м 2 та синдромом апное сну, страждав від ESHF внаслідок ішемічної (оклюзія LAD) та ритмічної кардіоміопатії (позаклапанної фібриляції передсердь) з оцінкою CHA2DS2-VASC 5. Ліворуч Фракція викиду шлуночка становила 20%. Середній легеневий тиск становив 35 мм рт. Ст., А серцевий індекс - 2,0 л/хв/м 2. Його ІМТ був єдиним протипоказанням до HTx. Наша інституційна команда серцевої недостатності вирішила імплантувати LVAD безперервного потоку, щоб поліпшити гемодинамічний стан пацієнта, а потім виконати рукавну гастректомію (SG).
Ключові слова: Баріатрична хірургія лівого шлуночка; Лапароскопічна рукавна резекція шлунка; Кінцева стадія серцевої недостатності; Пересадка серця
Вступ
Підтримка LVAD забезпечує гемодинамічну стабільність під час BS. Однак припинення антикоагуляції у пацієнтів із ожирінням щодо БС підвищує ризик тромбозу LVAD та/або тромбоемболічних явищ. Ми повідомляємо про терапевтичний шлях, який ми застосували для вирішення цієї непростої ситуації.
Опис справи
Пацієнт проходив лікування між 02.2018 та 01.2019 в університетській лікарні Во (CHUV, Лозанна, Швейцарія).
Пан Р. С, чоловік п’ятдесяти чотирьох років, колишній курець при 45 ПА, страждає на високий кров’яний тиск, ожирінням III стадії з ІМТ 43,8 кг/м 2 (134 кг на 175 см) та синдромом апное сну, який лікувався CPAP. Крім того, пацієнт в анамнезі мав численні операції на черевній порожнині (9 відкритих операцій та одна лапароскопічним підходом).
На серцевому фоні він страждає на ішемічну хворобу серця після оклюзії ЛАД з хронічним рестенозом стента в такому положенні. Він має стійку неклапанну фібриляцію передсердь (оцінка CHA2DS2-VASC 5 балів) як ритмічні порушення, які антикоагулюються апіксабаном. Пацієнт також має імплантований кардіовертерний дефібрилятор для первинної профілактики раптової серцевої смерті. МРТ серця, зроблене трьома роками раніше, показало розширення ЛШ зі зниженою фракцією викиду
(LVEF 28%), дискінезія передньої стінки та верхівки на семи сегментах міокарда разом із трансмуральним фіброзом.
Він поступив з гострою серцевою недостатністю з задишкою NYHA IV стадії. Діагноз поширеної СН при ішемічній хворобі серця (ІХС) був збережений. Йому було поставлено діагноз: перенесена серцева недостатність через ІХС.
Трансторакальна ехокардіограма за 4 місяці до операції LVAD підтвердила важку дилатацію лівого шлуночка з сильно зниженою фракцією викиду (LVEF 20%), передню та передньосептальну акінезію з апікальною дискінезією, діастолічною дисфункцією та дилатацією лівого передсердя об’ємом 39 куб./М. 2. Значної серцевої вальвулопатії не виявлено. Систолічний тиск у легеневій артерії вимірювали при 30 мм рт.
Фармакологічне лікування СН було обмеженим через важку гіпотензію. Після обговорення серцевою командою імплантація LVAD у “Підхід до кандидатури” була збережена.
Катетеризація правого серця показала сильно знижений серцевий індекс при 2,0 л/хв/м 2, легеневий капілярний тиск при 24 мм рт. Ст. І середній тиск у легеневій артерії 35 мм рт. Ст. Не реагує на Добутамін на частоту, витрату або тиск наповнення. Ми завершили передопераційну оцінку за допомогою циклу ергометра з субмаксимальним стрес-тестом на рівні метаболізму, який був перерваний через сильну задишку (9/10). Ми дійшли висновку щодо сильно зміненої аеробної ємності з макс. MVO2 при 11,0 мл/кг/хв і нахилом VE/VCO2 до 38. Ми додали принаймні сканування комп’ютерної томографії (КТ), а також КТ синусів, не виявило жодних відхилень, що протипоказали б хірургія.
Імплантацію LVAD (Abbott HeartMate 3) виконували під серцево-легеневим шунтуванням (CPB; 75 хв) з використанням мінімального інвазивного підходу через верхню міні-стернотомію та ліву передню геміторакотомію. Операція та післяопераційна фаза проходили без змін. Перебіг післяопераційного курсу у пацієнта проходив безперебійно (тривалість ШВЛ 2, абсолютна жирова маса відповідно до статуру пацієнта. Загальна маса жиру становила 47,8%, а індекс маси жиру (МВФ) = 19,05 кг/м 2 .
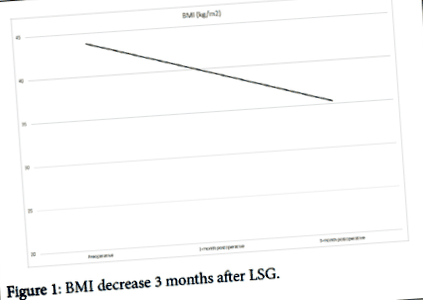
Незважаючи на управління харчуванням та реабілітацію, вага пацієнта протягом післяопераційного періоду збільшився на 7 кг. Таким чином, було вирішено провести рукавну гастректомію за допомогою лапароскопічного підходу через 10 місяців після імплантації LVAD. Під час підготовки до баріатричної хірургії (БС) пероральну антикоагуляцію призупинили за 3 дні до процедури і замінили на профілактичний внутрішньовенний гепарин (анти-Ха 2. Після перших 3 післяопераційних місяців пацієнт досягає загального зниження ІМТ на 9 балів і втрата ваги 22 кг. Зараз пацієнт перерахований для трансплантації серця з ІМТ 35,3 кг/м 2 .
Обговорення
ESHF (NYHA IV) корелює з високою смертністю, до 40-50% до року без HxT. Близько 25% пацієнтів, які страждають серцевою недостатністю на кінцевій стадії (ESHF), страждають ожирінням. ІМТ> 40 заважає пацієнтам отримувати трансплантат органу, оскільки патологічне ожиріння (MO) різко збільшує смертність після трансплантації серця (HTx). У ваговому мосту до Htx єдиним способом є імплантація опори LVAD, яка не протипоказана їх ожирінням. Дійсно, ожиріння не впливає на середньотривале виживання після імплантації LVAD, але воно пов’язане з помірно підвищеним ризиком інфікування трансмісією [2,3] та тромбозу.
У нашого пацієнта, незважаючи на управління харчуванням та реабілітацію, що явно покращує фізичні здібності пацієнта, вага збільшилася на 7 кг за шість місяців після імплантації апарата допомоги безперервного лівого шлуночка (CF-LVAD). Насправді, фізична навантаження у пацієнтів із серцевою недостатністю залишається зниженою за підтримки LVAD [4], що ускладнює втрату ваги. Наша інституційна команда серцевої недостатності вирішила виконати рукавну гастректомію (SG), щоб врешті-решт знизити ІМТ пацієнта до значень, сумісних з HTx (підхід мостової до кандидатури).
До нас мало хто працював над комбінованим підходом LVAD/SG у хворих із ожирінням ESHF як «місток до кандидатури», проте великих досліджень не проводилось. Дійсно, до найширших належать не більше одинадцяти пацієнтів [5]. У всіх описаних випадках жоден пацієнт не хворів на ГМ III і повідомлялося про тромботичні події [6].
Хронічна серцева недостатність була потужним предиктором смертності у пацієнтів, які перенесли операцію. Причина тому здавалося розумним спочатку імплантувати LVAD безперервного потоку (Abbott Heartmate III ™), щоб покращити гемодинамічний стан пацієнта, перш ніж розглядати рукавну гастректомію (SG).
Ми використовували попередні дослідження для вибору техніки СГ. У кількох роботах було продемонстровано перевагу СГ порівняно з резекцією шлунка у Y, що, здається, викликає імунологічний розлад, що компрометує імуносупресивну терапію після HTx. Підозрювали про структурну модифікацію слизової. Лапароскопічний підхід був найбезпечнішим хірургічним методом [7]. Таким чином, можна уникнути розрізу, який був би занадто близько до кабелю насоса або кабелю передачі. Інші команди пробують BS з іншим підходом, використовуючи (Roux en– Y- шлунковий шунтування) [8].
Десять місяців між імплантацією LVAD та LSG. Незважаючи на те, що було проведено кілька досліджень, щоб продемонструвати безпеку несерцевої хірургічної процедури у пацієнтів, обладнаних LVAD, баріатрична хірургія рідко описувалась, що змушувало стикатися з кількома проблемами.
Під час операції, з одного боку, були ускладнення насоса. Першим складним кроком операції було лікування гемодинамічних порушень, спричинених пневмоперитонеумом. Дійсно, газова інсуфляція та антитренд на показник венозного звороту до ризику знеструмлення насоса, що змушує нас постійно підтримувати інсуфляційний тиск 40), збільшує ризик тромбоемболічних подій на 20% більше, збільшуючись при зупинці антикоагуляції при БС, збільшує ризик тромбозу LVAD та/або тромбоемболічних подій, особливо за наявності МО.
Застосування HM III, безперервного проточного роторного насоса (неімпульсний), великої підвіски з пробілами крові з електромагнітною суспензією, що контактує з кров’ю, має текстуровану поверхню, є революційним пристроєм допомоги у шлуночках, що забезпечує менший ризик тромбозу. Порівняйте дослідження Порівняйте HM II з HM III і дійшли висновку, що пристрій HM III має більшу ефективність порівняно з HM II, але також зменшує тромботичні ускладнення [9]. Тому Мехра та ін. у дослідженні momuntum показано 9,4 відсотка різниці у виживаності на 6 ротовій порожнині без інсульту мозку або повторної операції при тромбозі помпи між HM II та HM III [9]. LVAD нового покоління роблять лікування антикоагулянтним лікуванням безпечнішим, ніж будь-коли, навіть у пацієнтів з високим ризиком тромбоемболічних ускладнень, що дозволяє розглядати LSG безтурботно.
Можливість переходу на відкриту хірургію не була незначною у нашого пацієнта через історію численних операцій на черевній порожнині, 9 - відкритими та одна - лапароскопічним. Геморагічне ускладнення внаслідок адгезіолізу, ангіодисплазії та артеріовенозних вад розвитку посилювалось лікуванням аспірином.
Ми також були стурбовані ризиком поганих рубцевих змін у шлунку. Дійсно, непульсаційні перфузії, спричинені LVAD, викликають гіпоперфузію в травній системі.
Через три місяці після ЛСГ пацієнт схуд на 22 кг (Фігура 1), що досягає ІМТ 35,3 кг/м 2 (Малюнок 2). Незважаючи на надмірну втрату ваги, жодних травм, переломів або переміщень кабелю не спостерігалося як додатковий ефект.
Фігура 1: Зниження ІМТ через 3 місяці після ЛСГ.
- Корекція патології ожиріння, хірургія патології ожиріння в Аллахабаді, Лакхнау, Нойда, Делі, Індія
- Як поговорити з коханим про баріатричну хірургію - Коаліцію проти ожиріння
- Поліпшення однієї хірургії за один раз - День баріатричної хірургії, присвячений національному тижню охорони ожиріння
- Лапароскопічна гастректомія рукавів у пацієнтів із серцевою недостатністю на кінцевій стадії може бути виконана безпечно
- Лапароскопічна хірургія, що регулюється на шлунку, для зображення патологічного ожиріння в нормальних анатомічних умовах