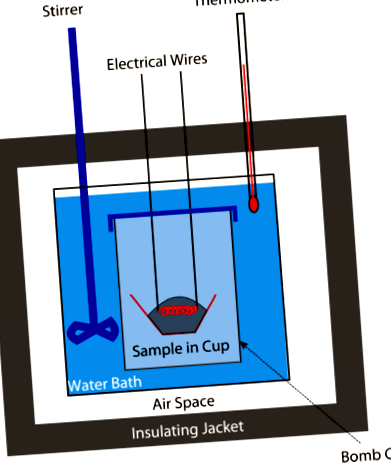
Калориметрія
Скільки калорій у вашій їжі?
Свого часу калорії в продуктах вимірювали за допомогою бомбового калориметра (див. Малюнок вище). Відважену кількість їжі поміщали в калориметр, а потім систему герметизували і наповнювали киснем. Електрична іскра запалила харчово-кисневу суміш. Кількість тепла, що виділяється при спалюванні їжі, дасть уявлення про калорії їжі. Сьогодні калорії розраховуються на основі вмісту білка, вуглеводів та жиру в їжі (все це визначається хімічним аналізом). Більше бомб не потрібно.
Калориметрія
Калориметрія - це вимірювання передачі тепла в систему або з неї під час хімічної реакції або фізичного процесу. A калориметр є ізольованим контейнером, який використовується для вимірювання теплових змін. Більшість реакцій, які можна проаналізувати в експерименті з калориметрії, - це або рідини, або водні розчини. Часто використовуваний і недорогий калориметр - це набір вкладених поролонових чашок, обладнаних кришкою для обмеження теплообміну між рідиною в чашці та повітрям в оточенні (див. Малюнок нижче). У типовому експерименті з калориметрії конкретні обсяги реагентів розподіляються в окремі контейнери і вимірюється температура кожного з них. Потім їх змішують з калориметром, який запускає реакцію. Суміш реагентів перемішують до завершення реакції, при цьому температура реакції постійно контролюється.
Малюнок 17.6
Простий калориметр з постійним тиском.
Ключем до всіх експериментів з калориметрії є припущення про відсутність теплообміну між ізольованим калориметром та приміщенням. Розглянемо випадок реакції, що відбувається між водними реагентами. Вода, в якій тверді речовини розчинені, є оточенням, тоді як розчинені речовини є системою. Вимірювана зміна температури - це зміна температури, що відбувається в оточенні. Якщо температура води зростає в міру того, як відбувається реакція, реакція екзотермічна. Система виділяла тепло в навколишню воду. Ендотермічна реакція поглинає тепло з навколишнього середовища, тому температура води зменшується, коли тепло залишає оточення, щоб потрапити в систему.
Зміна температури води вимірюється в експерименті, а питома теплота води може бути використана для розрахунку тепла, що поглинається навколишнім середовищем .
У рівнянні, - це маса води, це питома теплоємність води і є. Тепло, що поглинається навколишнім середовищем, рівне, але протилежне за знаком теплу, що виділяється системою. Оскільки зміна тепла визначається при постійному тиску, тепло, що виділяється системою, дорівнює зміні ентальпії .
Ознака позитивна для ендотермічної реакції та негативна для екзотермічної реакції.
Зразок проблеми: Зміни калориметрії та ентальпії
В експерименті 25,0 мл 1,00 М HCl при 25,0 ° C додають до 25,0 мл 1,00 M NaOH при 25,0 ° C в пінопластовому калориметрі. Відбувається реакція, і температура піднімається до 32,0 ° C. Обчисліть зміну ентальпії в кДж для цієї реакції. Припустимо, що щільність розчинів становить 1,00 г/мл, а їх питома теплоємність така ж, як і води.
Крок 1: Перелічіть відомі величини та сплануйте проблему .
- Щільність = 1,00 г/мл
За об’ємом і щільністю можна знайти масу розчину після перемішування. Потім обчисліть зміну ентальпії за допомогою .
Крок 3: Подумайте про результат .
Зміна ентальпії є негативною, оскільки реакція виділяє тепло в навколишнє середовище, що призводить до підвищення температури води.
Резюме
- Описано процес калориметрії.
- Проілюстровано розрахунки, що включають зміни ентальпії.
Практика
Опрацюйте проблеми за посиланням нижче:
Огляд
- Які типи реакцій зазвичай аналізують в калориметрі?
- Що таке калориметр з постійним тиском?
- Чому пінопластові чашки використовуються в калориметрі?
- Харчова хімія - Чи має печений хліб таку ж кількість калорій, як і його інгредієнти Хімія
- Посібник з вивчення хімії -5
- Вибір їжі європейською козулею (Capreolus capreolus) вплив рослинної хімії та
- Надлишок і обмеження реагентів - хімія LibreTexts
- Загальна теорія розділення - хімія LibreTexts